Uso de anticuerpos monoclonales como opción terapéutica para el tratamiento del cáncer de mama: reseña
Use of monoclonal antibodies as a therapeutic option for breast cancer treatment: A review
Aldeir Alvarado-Arce1, Nazareth Rueda-Carrillo2, Sebastián Ramírez-Chaves3, Mónica Vargas-Salas4, Steven Vargas-Cascante5
Fecha de recepción: 20 de noviembre, 2024
Fecha de aprobación: 18 de febrero, 2025
Alvarado-Arce, A; Rueda-Carrillo, N; Ramírez-Chaves, S; Vargas-Salas, M; Vargas-Cascante, S. Uso de anticuerpos monoclonales como opción terapéutica para el tratamiento del cáncer de mama: reseña. Tecnología en Marcha. Vol. 38, No 3. Julio-Setiembre, 2025. Pág. 88-96. https://doi.org/10.18845/tm.v38i3.7592
https://doi.org/10.18845/tm.v38i3.7592
Palabras clave
Biotecnología; biomédica; sistema inmune; anticancerígeno; terapia dirigida.
Resumen
[Objetivo] El objetivo de la investigación fue compilar/analizar la información disponible sobre el uso de anticuerpos monoclonales como terapia contra el cáncer de mama. [Metodología] Se realizó una revisión bibliográfica a través de bases de datos y publicaciones de revistas que abordaran los anticuerpos monoclonales como tratamiento contra la enfermedad del cáncer. Durante la revisión se procuró tomar datos actuales, que reflejaran los alcances y limitaciones de la terapia monoclonal en distintos tipos de cáncer. Así mismo, se sugirió una estrategia para mitigar los efectos secundarios negativos que acarrea el tratamiento en el paciente. [Resultados] Las células hibridomas actúan sobre receptores responsables de la proliferación de células cancerígenas, como el HER2 en el cáncer de mama, inhibiendo su multiplicación y facilitando que el sistema inmune pueda atacar las células dañadas mediante linfocitos. A pesar de ser un tratamiento prometedor, tiene asociado efectos secundarios negativos, por lo que se propone un plan de tratamiento de supresión inmunológica para contrarrestarlos sin afectar la efectividad del tratamiento. En Costa Rica, debe de promoverse la investigación que incluya a los anticuerpos monoclonales como posible tratamiento contra el cáncer para aumentar la calidad de vida de los pacientes. [Conclusiones] El uso de anticuerpos monoclonales como tratamiento contra el cáncer de mama ha dado resultados positivos en los pacientes, ya que es una técnica muy específica. No obstante, aún hay muchos obstáculos en la aplicación de esta, generando brechas que dificultan la investigación para mejorar la prognosis de los pacientes.
Keywords
Biotechnology; biomedical; immune system; anticancer; targeted therapy.
Abstract
[Objective] The objective of the research was to compile/analyze the information available about the use of monoclonal antibodies as a therapy for breast cancer. [Methodology] A bibliographic review was conducted using databases and journal publications addressing monoclonal antibodies as a treatment for cancer. The review focused on current data reflecting the scope and limitations of monoclonal therapy in different types of cancer. Additionally, a strategy was proposed to mitigate the negative side effects associated with the treatment in patients of cancer. [Results] Hybridoma cells target receptors responsible for the proliferation of cancer cells, such as HER2 in breast cancer, inhibiting their multiplication and facilitating the immune system’s ability to attack damaged cells through lymphocytes. Despite being a promising treatment, it has associated negative side effects. Therefore, an immunosuppression treatment plan is proposed to counteract these effects without compromising the therapy’s effectiveness. In Costa Rica, research including monoclonal antibodies as a potential cancer treatment should be promoted to improve patients’ quality of life. [Conclusions] The use of monoclonal antibodies as a treatment for breast cancer has shown positive results in patients, as it is a highly specific technique. However, many obstacles remain in its application, creating gaps that hinder research aimed at improving patient prognosis.
Introducción
Los anticuerpos monoclonales (mAbs), son moléculas producidas y diseñadas para ser anticuerpos sustitutos que restauran, mejoran o imitan el ataque del sistema inmunológico a las células cancerosas al unirse a sus antígenos [1]. Estos anticuerpos son producidos por clones de una célula B única, todos los cuales se unen a porciones específicas de un antígeno o epítopo [2].
El cáncer de mama es la neoplasia maligna más frecuente en mujeres en todo el mundo y es curable en ~70–80% de las pacientes con enfermedad no metastásica en etapa temprana, de estar más avanzado con metástasis en órganos distantes, es considerado incurable [3]. En lo que Costa Rica respecta, en el año 2020 se reportaron 13139 casos nuevos de cáncer, siendo 1624 casos (24.5%) diagnosticados de cáncer de mama en mujeres, haciéndolo el tipo de cáncer más frecuente en mujeres del país [4].
En el cáncer de mamá generalmente se utilizan anticuerpos humanizados o quiméricos, que se crean uniendo sus regiones hipervariables murinas de las cadenas ligeras y pesadas a una estructura de anticuerpos humanos [1] [5].
En cuanto a la producción de mAbs, el método principal es la tecnología de hibridomas. Se utilizan modelos animales que son inmunizados con el antígeno de interés y una vez alcanzada la inmunización deseada, se extraen las células B del bazo mediante centrifugación en gradiente de densidad, y los anticuerpos en el suero se detectan mediante técnicas como ELISA o citometría de flujo [6].
El siguiente paso es fusionar las células B con células de mieloma sometidas a a las que se ha silenciado la expresión de la enzima HGPRT lo cual se utiliza como marcador genético. La HGPRT convierte a la hipoxantina a inosina monofosfato, y a la guanina a guanina monofosfato; y el análogo de purina 8-azaguanina (8-AG) compite con la HGPRT activa. Las células con HGPRT funcional se incuban con 8-AG, metabolizan el análogo, produciendo un nucleótido 8-AG que se incorpora a la síntesis de ácidos nucleicos, resultando en muerte celular para las células HGPRT no mutadas, dejando a las células HGPRT– vivas [6].
Una vez seleccionados, las hibridomas se clonan mediante dilución limitante para asegurar que cada línea celular provenga de una única célula productora de anticuerpos. Tras el crecimiento de los clones, se realiza una prueba de ELISA para confirmar la producción de anticuerpos específicos, garantizando su monoclonalidad y estabilidad. Posteriormente, las hibridomas pueden propagarse in vivo, usualmente en ratones, o in vitro en medios de cultivo celular, siendo esta una opción de bajo costo y producción continua [6].
Este conjunto de procedimientos asegura la producción estable y continua de anticuerpos monoclonales específicos, que pueden utilizarse para aplicaciones biomédicas y terapéuticas. El objetivo de esta revisión es evaluar el uso terapéutico de anticuerpos monoclonales para tratar el cáncer de mama, tomando en cuenta su mecanismo de acción, su uso actual y las limitaciones que posee.
Mecanismos de acción
Bloqueo de señales de crecimiento en las células cancerosas.
Las células cancerosas por lo general presentan sobreexpresión de receptores que promueven el crecimiento y la proliferación descontrolada [7]. La posibilidad de inhibir o inhabilitar estos receptores, resulta en una disminución de la proliferación celular. Uno de los receptores más conocidos en el cáncer de mama es el HER2 [8]. HER2 desempeña un papel en la regulación de la proliferación y crecimiento celular, pero en ciertas formas de cáncer de mama como el subtipo HER2+ se produce una sobreexpresión de este receptor [9], lo que produce un crecimiento acelerado de las células.
Anticuerpos monoclonales como el Trastuzumab (Herceptin®), se diseñan específicamente para su unión con HER٢ en su dominio extracelular IV [10], bloqueando la señalización, al evitar que se envíen señales de crecimiento dentro de la célula, impidiendo la dimerización de HER2, que se relaciona con la proliferación de tumores [11].
Marcaje de células cancerígenas
Otro mecanismo de acción de los anticuerpos monoclonales es marcar las células cancerosas para que el sistema inmune las reconozca y destruya más fácilmente [12]. Al unirse a antígenos específicos de la célula, los anticuerpos funcionan como señales que identifican las células cancerígenas. Esto permite que células inmunitarias como los linfocitos eliminen las células malignas [13]. Trastuzumab ha demostrado ser efectivo al señalar las células cancerosas que sobreexpresan HER2, facilitando su eliminación por el sistema inmune [14].
Activación de genes supresores de tumores (TSG)
Los TSG son los responsables de la regulación del crecimiento celular y promover la muerte programada de las células cuando se requiere. En muchos tipos de cáncer, los TSG se encuentran silenciados o inactivos, permitiendo el desarrollo descontrolado del cáncer [15]. Algunos anticuerpos monoclonales pueden revertir este proceso al modificar el entorno celular y reactivar la función de TSG, cmo lo en el caso de p53, [16]. Además de activar los TSG, algunos anticuerpos monoclonales inactivan oncogenes al bloquear la acción de proteínas; por ejemplo, Bevacizumab se une al factor de crecimiento endotelial vascular [17], reduciendo la formación de nuevos vasos sanguíneos, que es crucial para el crecimiento tumoral.
Uso de los anticuerpos monoclonales en la actualidad
Investigaciones recientes muestran cómo las células cancerosas logran esquivar el ataque del sistema inmunológico aprovechando receptores inhibidos en los linfocitos T que suelen regular la respuesta inmune para evitar afectación a tejidos sanos. Esta interacción es la que se explota en la terapia con anticuerpos monoclonales, que bloquean esos receptores, permitiendo que el sistema inmune recupere su capacidad de reconocer y atacar al cáncer [5] [18].
Actualmente, los anticuerpos monoclonales se consideran una herramienta eficaz para tratar varios tipos de cáncer al atacar moléculas específicas que las células tumorales usan para evitar ser detectadas por el sistema inmune. Un buen ejemplo es el cáncer de mama HER2 positivo, en el que el anticuerpo trastuzumab bloquea la proteína HER2, responsable de estimular el crecimiento del tumor. Al hacerlo, este tratamiento ralentiza la proliferación de las células malignas y mejora las tasas de supervivencia de los pacientes [19]. De manera similar, en el carcinoma colorrectal, cetuximab inhibe el receptor EGFR, lo que limita la señalización que favorece la división celular, reduciendo el crecimiento del tumor [20].
El carcinoma microcítico de pulmón, un tipo de tumor muy agresivo pero que responde bien a la quimioterapia, pero esta acarrea muchos efectos secundarios que implicarían la ingesta de más medicamentos para contrarrestar su sintomatología. Este tipo de cáncer está muy relacionado con el consumo de tabaco, lo que provoca una alta cantidad de mutaciones. Esto lo convierte en un buen candidato para este tipo de terapia. La terapia con anticuerpos monoclonales ha mostrado que los efectos secundarios graves son significativamente menores en comparación con la quimioterapia tradicional; sin embargo, aunque estos anticuerpos pueden activar una respuesta inmune contra las células tumorales, también pueden provocar enfermedades autoinmunes [18] [21].
Es importante destacar la detección temprana del cáncer de pulmón para mejorar las opciones de tratamiento. Además, aunque hay estudios que han demostrado la eficacia de los anticuerpos monoclonales, aún no queda claro en qué tipo específico de cáncer de pulmón podrían ser más beneficiosos [21].
Limitaciones de los anticuerpos monoclonales
A pesar de presentar resultados prometedores en su aplicación, los anticuerpos monoclonales presentan complicaciones que comprometen su uso. A nivel farmacológico, sus principales limitaciones se basan en los efectos adversos que pueden ocasionar en los pacientes, conocidos como reacciones de infusión, las cuales pueden manifestarse con la utilización de los mAbs y causar erupciones cutáneas, síntomas pseudogripales, problemas cardiovasculares, entre otros; sin embargo, todos estos pueden ser contrarrestados con la aplicación de otros fármacos pre y post tratamiento en el paciente [22].
Aunque no se ha logrado eliminar por completo la incidencia de efectos adversos, se ha logrado determinar que según los anticuerpos monoclonales utilizados se puede aumentar o disminuir la incidencia de estos síntomas, por lo que se opta por realizar tratamientos altamente individualizados, con el propósito de aplicar una terapia específica, tomando en consideración desde el tipo de cáncer, hasta el estado general del paciente y su respuesta al tratamiento, ejemplo de esto sería el planteamiento en la investigación de [23] donde se busca combinar el tipo de quimioterapia aplicada con los mAbs específicos para mejorar su efectividad y disminuir los posibles riesgos. De esta forma una terapia y monitoreo personalizado permitirá tanto una mayor efectividad del tratamiento como la disminución de afectaciones secundarias por parte de este, volviéndolo menos invasivo para el organismo.
Otra limitante frecuente es la ineficacia de la terapia, en este caso no relacionada a los efectos adversos del paciente, si no por la resistencia de cáncer en sí ante el tratamiento, provocada tanto por los mecanismos de resistencia de las células cancerígenas, como por la respuesta inmunológica de los organismos tratados. En el primer caso esto es determinado principalmente por la fisiología del tumor, ya que en casos donde estos son sólidos o con un alto grado de desarrollo, dificulta o anula considerablemente el efecto de los mAbs, debido a la alta producción de antígenos que restringe el funcionamiento de los anticuerpos a zonas de bajo impacto en el tumor [24]. Así mismo, como es frecuente con otros medicamentos o tratamientos, se han reportado casos en que el cuerpo de los pacientes genera respuestas inmunes para contrarrestar los efectos de los anticuerpos monoclonales introducidos, así como estimular la inmunidad para los fármacos pre y post operatorios, generando antígenos que logran inhibir sus efectos, y por ende anulan su efectividad [25]; bajo este nuevo reto se busca modificar los mAbs de forma que no sean detectados por el sistema inmune, o bien aplicarlos bajo el efecto de represores que impidan la respuesta inmunológica en casos como el antes mencionado. No obstante, todas estas limitantes siguen en investigación, y en su mayoría han logrado superarse mediante la hibridación de esta terapia con otras ya aplicadas, por lo que no resultan en una problemática mayor para utilizar esta tecnología.
Panorama actual del tratamiento con anticuerpos monoclonales en cáncer de mama
Las reacciones adversas son un desafío en la aplicación a los pacientes, lo que lleva a buscar alternativas que compensen o minimicen estas, pero que no comprometan la eficacia de los anticuerpos monoclonales.
Una manera de lograr esto es usando mAbs humanos, ya que las reacciones inmunológicas se ven engañadas al no haber una combinación con células provenientes de otras especies; sin embargo, esto mismo significa un desafío, puesto que hace que el costo de fabricación de esta terapia aumente. Además de que implica una limitación en la obtención, debido a las consideraciones éticas y de salud en las personas donantes. Es por lo que los anticuerpos monoclonales de origen quimérico son los más comunes y analizados [26], lo que lleva a plantear su uso, pero afectando otras vías de respuesta de manera selectiva para combatir las consecuencias negativas.
Por otro lado, respecto al sistema inmune con los antígenos, se generan y liberan las células T-helper (específicamente Th2), que inducen la respuesta de los linfocitos T [27]. Estas pueden provocar efectos adversos, llevando a que, si se hace el uso de fármacos para suprimir de manera controlada el sistema inmune, se puede reducir notoriamente las reacciones desencadenadas por las células T [28]. Al suprimir el sistema inmune de forma temporal, se permite la aplicación del tratamiento, y que luego se pueda restablecer.
Además, si esta técnica es acoplada con mAbs biespecíficos, se aumenta la precisión del tratamiento, ya que los receptores del sistema inmune pueden ser unidos al antígeno y a la célula inmunitaria simultáneamente, y aunque pueden desencadenar reacciones inmunológicas adversas, este efecto es contrarrestado por lo planteado anteriormente [26].
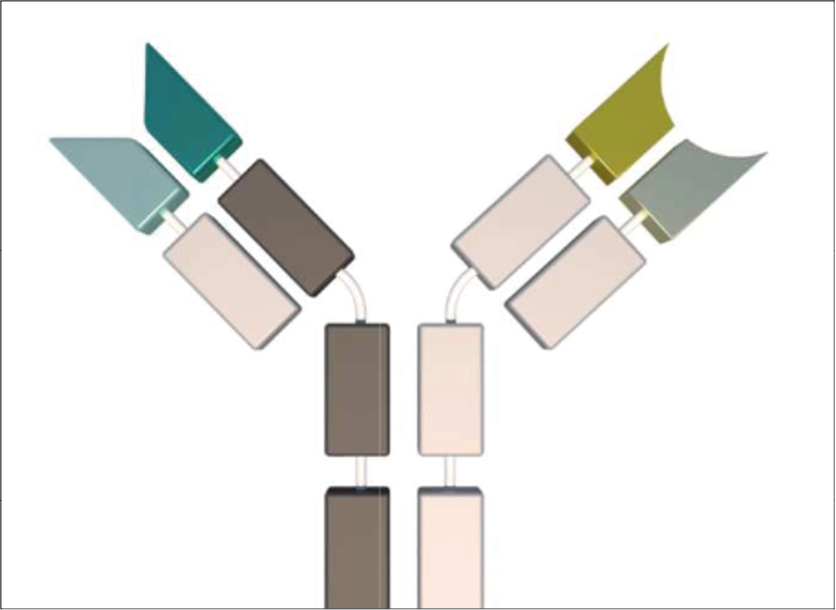
Figura 1. Diseño de un mAbs biespecífico [29].
Con esta propuesta se consigue una terapia más precisa y con la posibilidad de contrarrestar los efectos secundarios, puesto que se dirigen las células del sistema inmune directamente a las del cáncer mediante la biespecificación, mientras se ofrece una alternativa para minimizar los efectos adversos de la terapia, sin generar consecuencias perjudiciales permanentes al paciente.
Una de las mayores limitantes de los mAbs se encuentra en la aplicación de esta técnica, refiriéndose en el área económica y de accesibilidad. La producción, testeo y comercialización de los mAbs resulta sumamente compleja y meticulosa lo que implica un costo elevado de obtención, y por ende aumenta la brecha de obtención para países menos desarrollados o pacientes que no tengan la posibilidad de costear el tratamiento. Si bien la FDA pronostica este tipo de terapias como un mercado en ascenso, y que por ende se esperaría que su costo se reduzca en los próximos años, actualmente en Estados Unidos un año de tratamiento para una sola persona puede superar los cien mil dólares [30], lo que claramente limita la aplicación de esta terapia a zonas con alto capital monetario, por lo que trabajar en la reducción de costos debe ser prioridad entre los objetivos de la aplicación de tratamientos con anticuerpos monoclonales.
El mAb tipo Rituximab (en diferentes presentaciones) es el único disponible en Costa Rica para tratamiento de enfermedades oncológicas de acuerdo con [31] en su última actualización del medicamento, que, en comparación con la consulta realizada por [29], en el año 2018 había 2 tipos más de mAbs. Esto dificulta la investigación e implementación de estos tratamientos, provocando un retroceso en materia de calidad de vida y tratamientos actuales en el país, impactando directamente a los pacientes de enfermedades oncológicas, donde la medicación apropiada y temprana es vital para la calidad y oportunidad de vida de los pacientes.
Conclusiones
En conclusión, la implementación de anticuerpos monoclonales para el tratamiento del cáncer (como el de mama) es una opción viable y efectiva en la que el cuerpo inhibe el desarrollo de más células cancerosas, activa genes relacionados a la detección de estas para ser fagocitadas de manera muy precisa, y permitiendo un tipo de terapia más exacta según el tipo de cáncer.
La elaboración de estos anticuerpos implica el uso de hibridomas quiméricos, diseñados para facilitar su integración en el organismo del paciente. Durante su desarrollo, se realizan diversas pruebas para confirmar que son funcionales y capaces de unirse específicamente a los antígenos objetivo. Además, el proceso de clonación asegura que todos los anticuerpos producidos provengan de una misma línea celular, garantizando uniformidad y especificidad en su acción.
No obstante, su implementación enfrenta desafíos desde distintos ámbitos. En la perspectiva farmacológica, es un tratamiento que no deja de tener efectos secundarios que impactan negativamente al paciente. Además, no es una terapia 100% infalible, por lo que pueden existir casos de resistencia o baja efectividad. Implementar combinaciones de técnicas es una buena alternativa para contrarrestar estos efectos, pero esto debe ser investigado más a fondo.
Otro desafío importante es la manera tan precaria en la que se maneja este tratamiento en el país, que actualmente resulta limitante para la investigación y el mejoramiento en tratamientos oncológicos.
Conflictos de intereses
Los autores declaran no tener algún conflicto de interés.
Declaración de la contribución de los autores
Todos los autores afirman que se leyó y aprobó la versión final de este artículo.
Los roles de los autores según CRediT fue: A.A.A.: Supervisión, Conceptualización, Redacción-Borrador Original, Redacción-Revisión y edición. N.R.C.: Supervisión, Conceptualización, Redacción-Borrador Original, Redacción-Revisión y edición. S.R.C.: Supervisión, Conceptualización, Redacción-Borrador Original, Redacción-Revisión y edición. M.V.S.: Supervisión, Conceptualización, Redacción-Borrador Original, Redacción-Revisión y edición. S.V.C.: Supervisión, Conceptualización, Redacción-Borrador Original, Redacción-Revisión y edición.
El porcentaje total de contribución de este artículo fue el siguiente: A.A.A. 20%, N.R.C. 20%, S.R.C. 20%, M.V.S. 20%, S.V.C. 20%.
Declaración de la disponibilidad de los datos
El intercambio de datos no es aplicable, ya que en este estudio no se crearon ni analizaron nuevos datos.
Referencias
[1] V. Bayer, “An Overview of Monoclonal Antibodies,” Seminars in Oncology Nursing, vol. 35, no. 5, p. 150927, Oct. 2019, doi: https://doi.org/10.1016/j.soncn.2019.08.006.
[2] D. Zahavi and L. Weiner, “Monoclonal Antibodies in Cancer Therapy,” Antibodies, vol. 9, no. 3, p. 34, Jul. 2020, doi: https://doi.org/10.3390/antib9030034.
[3] N. Harbeck et al., “Breast cancer,” Nature Reviews Disease Primers, vol. 5, no. 1, Sep. 2019, doi: https://doi.org/10.1038/s41572-019-0111-2.
[4] A. Astorga-Ramírez, J. Sánchez-Portuguez, and S. M. Solís-Barquero, “Revisión de los factores de riesgo y factores protectores para el cáncer de mama,” vol. 64, no. 4, pp. 1–11, Dec. 2022, doi: https://doi.org/10.51481/amc.v64i4.1177.
[5] A. Barquero-Solano, G. Guevara-Saborío, J. Montero-Rivera, L. Vargas-Sandoval, L. D. Velásquez-Alfaro, and J. J. Mora-Román, “Inmunoterapia activa con anticuerpos monoclonales como opción terapéutica para el tratamiento del cáncer de páncreas,” Revista Tecnología en Marcha, Jun. 2022, doi: https://doi.org/10.18845/tm.v35i3.5612.
[6] A. Waller-Pulido et al., “Production of monoclonal antibodies for therapeutic purposes: A review,” International Immunopharmacology, vol. 120, pp. 110376–110376, Jul. 2023, doi: https://doi.org/10.1016/j.intimp.2023.110376.
[7] P. A. Jones and S. B. Baylin, “The Epigenomics of Cancer,” Cell, vol. 128, no. 4, pp. 683–692, Feb. 2007, doi: https://doi.org/10.1016/j.cell.2007.01.029.
[8] S. M. Borgan, L. Romeus, S. Rahman, and A. Asmar, “Internal Medicine Residents and the Practice of Defensive Medicine: A Pilot Study Across Three Internal Medicine Residency Programs,” Cureus, Feb. 2020, doi: https://doi.org/10.7759/cureus.6876.
[9] A. Samuel-Eziokwu et al., “Real-world Outcomes of Cyclin-dependent Kinase Inhibitors Continued Beyond First Disease Progression in Hormone Receptor-positive Metastatic Breast Cancer,” Clinical Breast Cancer, vol. 21, no. 3, pp. 205–209, Jun. 2021, doi: https://doi.org/10.1016/j.clbc.2020.09.010.
[10] E. Quaquarini et al., “Prognostic and Predictive Roles of HER2 Status in Non-Breast and Non-Gastroesophageal Carcinomas,” Cancers, vol. 16, no. 18, pp. 3145–3145, Sep. 2024, doi: https://doi.org/10.3390/cancers16183145.
[11] Z. Li, G. Xue, and Y. Mei, “Applications of Electrochemical Analytical Techniques in HER2 Detection for Breast Cancer,” International Journal of Electrochemical Science, pp. 100813–100813, Sep. 2024, doi: https://doi.org/10.1016/j.ijoes.2024.100813.
[12] R. Ladak, B.A. Fifield, L. Porter, K. Hirmiz, and C. Hamm, “Long-Term Survival in Human Epidermal Growth Factor Receptor 2-Positive Bone-Only Metastatic Breast Cancer: Trastuzumab, Denosumab, and Potential Synergistic Effects,” Cureus, Sep. 2024, doi: https://doi.org/10.7759/cureus.68576.
[13] T. Dajsakdipon, W. Pipatsakulroj, and T. Dejthevaporn, “Incidence and Prognostic Values in Human Epidermal Growth Factor Receptor 2-Low Expression Metastatic Breast Cancer in Southeast Asian Population: A 10-Year Retrospective Study,” JCO Global Oncology, no. 10, Sep. 2024, doi: https://doi.org/10.1200/go.24.00132.
[14] V. Sankarapandian et al., “A review on tyrosine kinase inhibitors for targeted breast cancer therapy,” Pathology - Research and Practice, vol. 263, pp. 155607–155607, Sep. 2024, doi: https://doi.org/10.1016/j.prp.2024.155607.
[15] H. Yun, L. Jing, J. Zhou, Y. Liu, and J. Zhang, “Poncirin Impact on Human HER2 Breast Cancer Cells: Inhibiting Proliferation, Metastasis, and Tumor Growth in Mice Potentially through The PI3K/AKT Pathway.,” PubMed, vol. 26, no. 8, pp. 496–504, Oct. 2024, doi: https://doi.org/10.22074/cellj.2024.2014892.1441.
[16] D. G. Hicks and B. M. Turner, “Optimized biomarker evaluation and molecular testing in the era of breast cancer precision medicine,” Biotechnic & Histochemistry, pp. 1–13, Sep. 2024, doi: https://doi.org/10.1080/10520295.2024.2390179.
[17] S. M. Lee, B. S. Jang, J. H. Chang, K. Kim, and K. H. Shin, “Risk Factors of Radiation Pneumonitis in Breast Cancer with Internal Mammary Chain Irradiation,” International Journal of Radiation Oncology*Biology*Physics, vol. 120, no. 2, p. e319, Oct. 2024, doi: https://doi.org/10.1016/j.ijrobp.2024.07.704.
[18] J. Sánchez de Cos Escuín, “New Immunotherapy and Lung Cancer,” Archivos De Bronconeumologia, vol. 53, no. 12, pp. 682–687, Dec. 2017, doi: https://doi.org/10.1016/j.arbres.2017.06.016.
[19] D. J. Slamon et al., “Use of Chemotherapy plus a Monoclonal Antibody against HER2 for Metastatic Breast Cancer That Overexpresses HER2,” New England Journal of Medicine, vol. 344, no. 11, pp. 783–792, Mar. 2001, doi: https://doi.org/10.1056/nejm200103153441101.
[20] D. Cunningham et al., “Cetuximab Monotherapy and Cetuximab plus Irinotecan in Irinotecan-Refractory Metastatic Colorectal Cancer,” New England Journal of Medicine, vol. 351, no. 4, pp. 337–345, Jul. 2004, doi: https://doi.org/10.1056/nejmoa033025.
[21] E. Herrero-García. “GRADO EN ENFERMERÍA Trabajo Fin de Grado,” 2019. Accessed: Nov. 19, 2024. [Online]. Disponible en: https://uvadoc.uva.es/bitstream/handle/10324/40652/TFG-L2570.pdf?sequence=1&isAllowed=y
[22] M. D. Rombouts, E. L. Swart, A. J. M. van den Eertwegh, and M. Crul, “Systematic Review on Infusion Reactions to and Infusion Rate of Monoclonal Antibodies Used in Cancer Treatment,” Anticancer Research, vol. 40, no. 3, pp. 1201–1218, Mar. 2020, doi: https://doi.org/10.21873/anticanres.14062.
[23] J. Q. Wei et al., “Anti-PD-1 Monoclonal Antibodies (mAbs) Are Superior to Anti-PD-L1 mAbs When Combined with Chemotherapy in First-Line Treatment for Metastatic Non-Small Cell Lung Cancer (mNSCLC): A Network Meta-Analysis,” Biomedicines, vol. 11, no. 7, pp. 1827–1827, Jun. 2023, doi: https://doi.org/10.3390/biomedicines11071827.
[24] B. M. Bordeau and J. P. Balthasar, “Strategies to enhance monoclonal antibody uptake and distribution in solid tumors,” Cancer Biology and Medicine, vol. 18, no. 3, pp. 649–664, 2021, doi: https://doi.org/10.20892/j.issn.2095-3941.2020.0704.
[25] A. Vaisman-Mentesh, M. Gutierrez-Gonzalez, B. J. DeKosky, and Y. Wine, “The Molecular Mechanisms That Underlie the Immune Biology of Anti-drug Antibody Formation Following Treatment With Monoclonal Antibodies,” Frontiers in Immunology, vol. 11, p. 1951, 2020, doi: https://doi.org/10.3389/fimmu.2020.01951.
[26] A. Behl et al., “Monoclonal antibodies in breast cancer: A critical appraisal,” Critical Reviews in Oncology/Hematology, vol. 183, p. 103915, Mar. 2023, doi: https://doi.org/10.1016/j.critrevonc.2023.103915.
[27] G. F. Bomfim, S. B. A. Cau, A. S. Bruno, A. G. Fedoce, and F. S. Carneiro, “Hypertension: a new treatment for an old disease? Targeting the immune system,” British Journal of Pharmacology, vol. 176, no. 12, pp. 2028–2048, Jul. 2018, doi: https://doi.org/10.1111/bph.14436.
[28] A. O’Garra and P. Vieira, “Regulatory T cells and mechanisms of immune system control,” Nature Medicine, vol. 10, no. 8, pp. 801–805, Aug. 2004, doi: https://doi.org/10.1038/nm0804-801.
[29] K. Bermúdez-Carvajal, G. H. Carrillo, R. M. Mata, K. R. Mora, B. Y.-A. Sánchez, and J. J. M. Román, “Anticuerpos monoclonales biespecíficos: desarrollo, producción y uso como terapia a anticancerígena,” Revista Médica de la Universidad de Costa Rica, vol. 13, no. 1, pp. 19–19, Apr. 2019, doi: https://doi.org/10.15517/rmucr.v13i1.37573.
[30] A. San-Juan-Rodriguez, I. Hernandez, N. Parekh, and T. Newman, “Pricing of monoclonal antibodies in the United States,” Global Journal on Quality and Safety in Healthcare, vol. 1, no. 1, p. 4, 2018, doi: https://doi.org/10.4103/jqsh.jqsh_1_18.
[31] Caja Costarricense del Seguro Social, “Caja Costarricense de Seguro Social | Lista oficial medicamentos,” Nov. 2024, Recuperado de: https://www.ccss.sa.cr/lom.
Declaración sobre uso de Inteligencia Artificial (IA)
Los autores aquí firmantes declaramos que no se utilizó ninguna herramienta de IA para la conceptualización, traducción o redacción de este artículo.
1 Instituto Tecnológico de Costa Rica. Costa Rica.
 aldalvarado@estudiantec.cr
aldalvarado@estudiantec.cr https://orcid.org/0009-0003-9621-9460
https://orcid.org/0009-0003-9621-94602 Instituto Tecnológico de Costa Rica. Costa Rica.
 nrueda@estudiantec.cr
nrueda@estudiantec.cr https://orcid.org/0000-0001-8727-305X
https://orcid.org/0000-0001-8727-305X3 Instituto Tecnológico de Costa Rica. Costa Rica.
 sebramirez@estudiantec.cr
sebramirez@estudiantec.cr https://orcid.org/0009-0009-1593-4336
https://orcid.org/0009-0009-1593-43364 Instituto Tecnológico de Costa Rica. Costa Rica.
 movargas@estudiantec.cr
movargas@estudiantec.cr https://orcid.org/0009-0001-5182-0020
https://orcid.org/0009-0001-5182-00205 Instituto Tecnológico de Costa Rica. Costa Rica.
 stevargas@estudiantec.cr
stevargas@estudiantec.cr https://orcid.org/0009-0001-3746-9633
https://orcid.org/0009-0001-3746-9633