Evaluación de dos fuentes orgánicas (humus de lombriz y excretas de Zophobas morio) en la germinación de semillas de lechuga (Lactuca sativa L.)
Phytotoxicity assessment in lettuce (Lactuca sativa L.) using germination indexes in two organic fertilizers: worm humus and Zophobas morio excreta
Daniel Alejandro García-López1
Fecha de recepción: 18 de setiembre, 2024
Fecha de aprobación: 21 de enero, 2025
García-López, D.A. Evaluación de dos fuentes orgánicas (humus de lombriz y excretas de Zophobas morio) en la germinación de semillas de lechuga (Lactuca sativa L.). Tecnología en Marcha. Vol. 38, No 3. Julio-Setiembre, 2025. Pág. 45-53. https://doi.org/10.18845/tm.v38i3.7508
https://doi.org/10.18845/tm.v38i3.7508
Palabras clave
Abono; calidad compost; vermicompost; enmienda; fertilidad; tóxico; inhibitorio.
Resumen
Zophobas morio es una especie de escarabajo que puede ser fuente potencial para la producción de abono orgánico a partir de sus excretas. En el presente trabajo se evaluó la germinación de semillas de lechuga y, se evaluó la fitotoxicidad mediante índices de germinación para comparar el desempeño de dos abonos orgánicos, humus de lombriz y excretas de Zophobas morio. Se observó una mejor respuesta del humus de lombriz ya que reportó un alto índice de germinación (112.45 ± 29.72%) en comparación a la respuesta obtenida por Zophobas morio (25.74 ± 5.87%). De igual forma los índices de porcentaje de germinación residual normalizado (IGN) y de elongación radical residual normalizado (IERN) catalogaron el humus de lombriz como un compuesto no fitotóxico, mientras que el extracto de zophobas mostró un IGN catalogado como toxicidad moderada y un IERN catalogado como muy tóxico. Se concluyó que las diferencias observadas entre ambos abonos pueden deberse a un mayor valor de conductividad eléctrica por parte del extracto de zophobas. Se demostró la eficacia del método de fitotoxicidad para evaluar la calidad de abonos orgánicos de manera rápida y eficiente.
Keywords
Fertilizer; compost quality; vermicompost; amendment; fertility; toxic; inhibitory.
Abstract
Zophobas morio is a beetle specie that can be a potential source for organic fertilizer production from its excreta. In the present work, lettuce seeds were used to evaluate both germination and phytotoxicity through indexes to compare the performance of two organic fertilizers, red worm vermicompost and Zophobas morio excreta. The best response was observed from the red worm vermicompost since it reported a high germination rate (112.45 ± 29.72%) compared to the response obtained by Zophobas morio excreta (25.74 ± 5.87%). Similarly, the indixes of normalized residual germination (IGN) and normalized residual root elongation (IERN) classified the worm vermicompost as a non-phytotoxic compound, while the zophobas extract showed an IGN classified as moderate toxicity and an IERN classified as very toxic. It was concluded that the differences observed between both fertilizers may be due to a higher value of electrical conductivity by the zophobas excreta. The effectiveness of the phytotoxicity method was demonstrated to evaluate the quality of organic fertilizers quickly and efficiently.
Introducción
La agricultura es una actividad imprescindible para la humanidad, su desarrollo desde hace más de 10 000 años fue el motor para la fundación de las primeras ciudades y sociedades complejas. A medida que la población ha incrementado, la agricultura ha buscado satisfacer la demanda de alimento para sostener el crecimiento poblacional mundial. Sin embargo, debido al incremento exponencial de la población desde principios de siglo XX, la agricultura ha buscado producir alimentos a un ritmo acelerado nunca antes visto, esto mediante el uso de agroquímicos y pesticidas si lograr con esto satisfacer la demanda de alimentos global; un ejemplo claro es México donde más del 50% de la población encuentra vulnerada su seguridad alimentaria [1]. Desafortunadamente, con el trascurso del tiempo, se ha hecho evidente que esta agricultura ha generado impactos negativos en la salud humana, contaminación de ríos, deterioro del medio ambiente, perdida del suelo, y aumento del calentamiento global [2].
De manera reciente, existe un incremento en la tendencia de producir alimentos de una manera sostenible buscando alcanzar mediante el desarrollo de biofertilizantes y abonos orgánicos que promuevan el crecimiento vegetal para remplazar el uso de insumos químicos [3]. Los abonos orgánicos han mostrado múltiples [4]; por un lado, son una accesible comparado los altos costos en fertilizantes químicos, por otro lado, también poseen beneficios ambientales, ya que ayudan en la remediación de suelos al mejorar sus propiedades físico-químicas, aportan microorganismos benéficos y aportan al suelo materia orgánica como nitrógeno y fósforo [5].
No obstante, a pesar de sus ventajas, se deben tomar precauciones en el uso de abonos orgánicos. Se ha demostrado que algunos abonos orgánicos pueden producir efectos no deseados durante la germinación y crecimiento en plantas que presentan alto grado de sensibilidad a abonos orgánicos no estabilizados. Existen diferentes causas de estos efectos negativos, se puede destacar que se trate de abonos orgánicos donde el material de origen no tiene la calidad o grado de madurez adecuado; esto es muy común por malos manejos al momento de preparar o manipular abonos orgánicos, generando efectos fitotóxicos en el abono orgánico como altos contenidos de amonio, ácidos volátiles, sales y de metales pesados [5, 6]; es decir, presentan sustancias que inhiben la germinación de semillas o retardan el desarrollo de las raíces, por lo tanto, es necesario contar con métodos para detectar estos efectos no deseados.
Existen diferentes técnicas para probar la eficacia de una enmienda o abono orgánico, sin embargo, es necesario contar con métodos accesibles que aporten información relevante sobre el grado de toxicidad de un abono orgánico. Un método que detecta de manera indirecta la presencia de toxinas es el bioensayo de germinación. La prueba se basa en colocar semillas en contacto directo con el extracto acuoso del material a probar, el cual se compara contra datos de germinación que se obtienen de un testigo [5]. Este método propuesto por Zucconi et al. [7] destaca por la amplia versatilidad ya que fue empleado en ensayos que evalúan la calidad de compost, monitoreo ambiental y calidad de agua [8, 9, 10]. La prueba destaca por ser una prueba rápida, económica y que generan buenos resultados para identificar toxicidad durante la germinación de semillas.
En la producción de abonos orgánicos predominan varios procesos, siendo el compostaje el más conocido para el manejo de residuos orgánicos. No obstante, además del compostaje, existen procesos que involucran el uso de animales vivos para la transformación de la materia orgánica en abonos, destacando el uso de lombrices e insectos. El humus de lombriz es el resultado del tránsito de la materia orgánica a través del sistema digestivo de la lombriz, lo que produce una enmienda orgánica con altos beneficios para las plantas ya que contiene sustancias biológicamente activas que favorecen la regulación del crecimiento vegetal, y que por sus características físico-químicas mejora el suelo ya que facilita su drenaje y aireación, incrementando el rendimiento vegetal [11]. Además de las lombrices existe el potencial de emplear otros organismos para la producción de abonos orgánicos, un ejemplo son las larvas del género Zophobas. Zophobas morio es una especie de escarabajo que pertenece a la familia Tenebrionidae; estos organismos son conocidos por ser capaces de alimentarse de gran variedad de alimentos durante su etapa larval, generando gran cantidad de desechos. Debido a su composición en nutrientes y la presencia de microorganismos benéficos [12] existe el potencial de emplear desechos de Zophobas morio como abonos orgánicos dentro del enfoque de una agricultura sostenible. No obstante, es necesario demostrar su eficacia y su adecuado manejo para justificar su uso como potencial abono orgánico. De tal motivo, el presente proyecto buscó evaluar el uso de excretas de zophobas para comprobar su efecto como abono orgánico para estimular el desarrollo vegetal, para lo cual se aplicaron bioensayos de fitotoxicidad comparando el potencial uso de excretas de zophobas contra humus de lombriz que es un probado compost orgánico.
Materiales y métodos
Preparación de las muestras
El trabajo se desarrolló durante marzo y abril del 2024 dentro del TecNM: Instituto Tecnológico Superior de Libres, en la ciudad de Libres, Puebla, México (19º 27’ 52” N; 97º 41’ 52” W). Se utilizaron dos tipos de muestras para el ensayo de fitotoxicidad. El humus que se empleó como testigo se obtuvo de una cama de lombricompostaje dentro de las instalaciones del TecNM, las lombrices fueron alimentadas con excretas de borrego y al momento de la cosecha el humus fue recolectado y separado mediante una criba de 2 mm. Por su parte, las excretas de Zophobas morio fueron donadas por el Instituto de Ecología, A.C., los organismos fueron alimentados con una dieta de avena y los desechos de su alimentación fueron colectados y empleados para esta prueba.
Para desarrollar a prueba de fitotoxicidad se requiere de muestras en estado líquido, por lo cual se procedió a obtener el extracto líquido de cada muestra sólida antes mencionada. Para realizar este procedimiento, por separado se colocaron en bolsas de papel filtro (Whatman 1) las muestras sólidas de humus de lombriz y estiércol de zophobas. Cada bolsa con muestra sólida se colocó en su respectivo contenedor con agua destilada a razón de 1:10 (p/v) y se calentó a 50 °C por 30 minutos; esto con el fin de hacer una extracción en líquido de cada muestra sólida de sustrato. Al término del proceso se recuperó el extracto líquido para realizar las sucesivas pruebas de fitotoxicidad.
Caracterización Fisicoquímica
Se determinaron variables fisicoquímicas en ambas muestras para tener una referencia de su composición. El pH se determinó directamente de las muestras líquidas de ambos abonos orgánicos. Las muestras se mantuvieron en agitación mientras se tomó la medición de pH con un paramétrico de marca HANNA, previamente calibrado con soluciones de referencia a temperatura ambiente.
La conductividad eléctrica (CE) se obtuvo de las mismas muestras empleando el mismo paramétrico. Para ambas variables la medición se realizó por quintuplicado, y se presentaron las medias y desviaciones estándar de los valores. Estos procedimientos se realizaron con base a la NOM-FF-109-SCFI-2007, sobre especificaciones y metodologías para trabajar con lombricomposta.
Prueba de fitotoxicidad
Para realizar la prueba de fitotoxicidad se emplearon placas Petri plásticas (100x15 mm) donde se desarrolló la germinación de semillas de lechuga durante 5 días; se utilizaron 6 placas por cada tratamiento: extracto de humus, el extracto de Zophoba y un control con agua destilada. En cada placa Petri se colocó papel filtro (Whatman 1), el cual se humedeció con 5 ml de efluente de cada respectivo tratamiento. Al finalizar se colocaron 10 semillas de lechuga orejona (Lactuca sativa L.) en cada placa Petri, mismas que fueron selladas con papel Parafilm y se permitió su germinación durante 5 días en condiciones de oscuridad dentro del laboratorio sin control de condiciones de crecimiento.
Al término del periodo de germinación se realizó el análisis de fitotoxicidad con base a la prueba de Zucconi et al. [7] para calcular el índice de germinación (IG) (Fórmula 1).
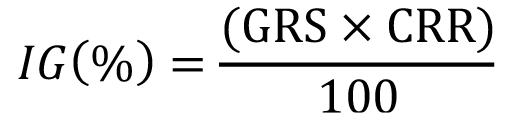 Fórmula 1
Fórmula 1
Donde:
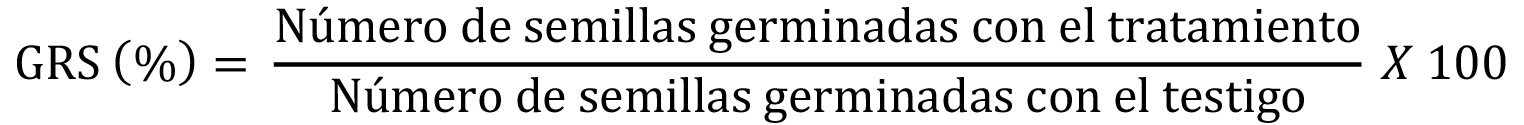
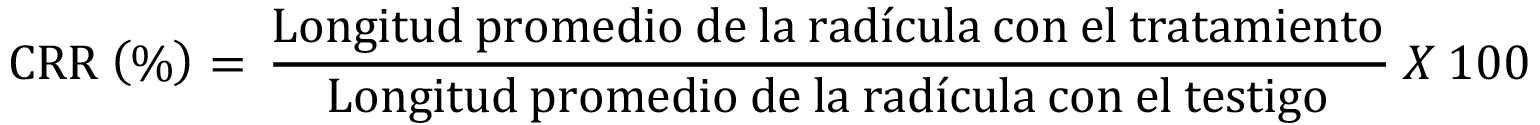
Adicionalmente, se calcularon los índices de porcentaje de germinación residual normalizado (IGN) y de elongación radical residual normalizado (IERN), de acuerdo con Bagur-González et al. [13] (Fórmulas 2 y 3, respectivamente).
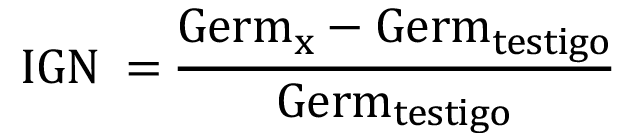 Fórmula 2
Fórmula 2
Donde Germx es el porcentaje promedio de semillas germinadas en el tratamiento y Germtestigo es el porcentaje promedio de semillas germinadas en el testigo.
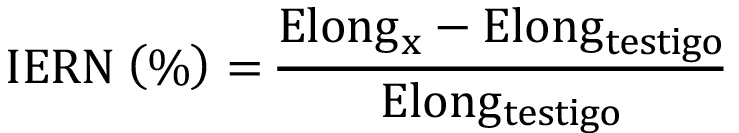 Fórmula 3
Fórmula 3
Donde Elongx es la longitud promedio de la radícula de semillas germinadas en el tratamiento y Elongx es la longitud promedio de la radícula de semillas germinadas en el testigo.
Análisis de los datos
Se implementó un diseño experimental completamente al azar con 60 semillas repartidos en 6 réplicas para cada tratamiento. En el caso de los datos de germinación, elongación y fisicoquímicos, se empleó la prueba de Análisis de varianzas (ANOVA) y una comparación de medias mediante la prueba de Tukey, se mantuvo un nivel de significancia de 5%. Los análisis fueron procesados mediante el software estadístico Minitab19.
Resultados y discusión
La valoración de los parámetros fisicoquímicos, pH y conductividad eléctrica (CE) se observan en el Cuadro 1. Al término de la prueba se observaron diferencias estadísticamente significativas (p < 0.05) en valores de pH, donde el humus presentó el mayor valor observado (8.81 ± 0.04), seguido del testigo (8.41 ± 0.06), y finalmente el extracto de zophobas presentó el menor valor de pH (8.034 ± 0.12). Por su parte, la CE de igual forma presentó diferencias estadísticamente significativas (p < 0.05), teniendo en este caso el mayor valor de CE para el extracto de zophobas (2.556 ± 0.63), seguido del humus (1.61 ± 0.01) y el menor valor lo presentó el testigo (0.776 ± 0.01).
Respecto a la prueba de germinación, al término de 5 días se observaron diferencias visuales entre las cajas de las semillas germinadas en extracto de excretas de zophobas y las semillas germinadas tanto en el control como con las que germinaron en el extracto de humus, siendo las primeras las que desarrollaron menor radícula comparadas con las últimas.
Cuadro 1. Valores de pH y conductividad eléctrica (CE) obtenidos del testigo y los extractos empleados.
|
Variable |
Testigo |
Humus |
Zophobas |
|---|---|---|---|
|
pH |
8.41 ± 0.06b |
8.81 ± 0.04a |
8.034 ± 0.12c |
|
CE (dS m-1) |
0.776 ± 0.01c |
1.61 ± 0.01b |
2.556 ± 0.63a |
Letras diferentes muestran diferencias significativas (p < 0.05) de acuerdo a prueba de Tukey.
La observación cualitativa anterior se corroboró cuantitativamente mediante los índices de germinación calculados. En el Cuadro 2 se comparan los índices calculados de los tratamientos con extracto de humus de lombriz y con zophobas, para todos los índices se observaron diferencias estadísticamente significativas (p < 0.05) entre los resultados observados en cajas con extracto de humus contra las cajas con extracto de zophobas. El índice de germinación (IG) permite comparar los tratamientos experimentales respecto al control, de esta forma los valores se comparan de acuerdo a recomendaciones de Zucconi et al. [] donde se establece que un IG mayor al 70% corresponde a un sustrato no fitotóxico; un IG entre 70-50% corresponde a un sustrato medianamente fitotóxico, y finalmente, un IG menor de 50% corresponde a un sustrato fitotóxico. De acuerdo a esta clasificación, los resultados del humus mostraron un IG de 112.45 ± 29.71%, este valor fue superior al 100% debido a que se calcula sobre los resultados del testigo y al superarlos demuestra que la presencia de este compuesto mejoró la germinación y elongación de semillas en comparación con el control. Por otro lado, el tratamiento con zophobas mostró un IG de 25.74 ± 5.87%, la interpretación de este resultado de IG a partir de la metodología de Zucconi sugiere que el contenido del extracto con zophobas contiene algún componente “toxico” que no permitió el desarrollo de lechuga e inhibió un crecimiento parecido a lo observado en el control y el tratamiento con humus de lombriz.
Cuadro 2. Valores calculados durante la germinación de semillas de lechuga con extractos de humus de lombriz y estiércol de zophobas.
|
Variable |
Humus |
Zophobas |
|---|---|---|
|
GRS |
100.63 ± 23.13ª |
71.45 ± 10.35b |
|
CRR |
111.45 ± 10.49ª |
35.72 ± 3.37 b |
|
IG |
112.45 ± 29.71ª |
25.74 ± 5.87 b |
|
IGN |
-0.01 ± 0.10ª |
-0.29 ± 0.10 b |
|
IERN |
-0.11 ± 0.10ª |
-0.64 ± 0.03 b |
Letras diferentes muestras diferencias significativas (p < 0.05) de acuerdo a prueba de Tukey.
Para evaluar el índice de porcentaje de germinación residual normalizado (IGN) y de elongación radical residual normalizado (IERN); se tomaron como referencia las recomendaciones de Bagur-González et al. [12], donde valores superiores a 0 corresponden a sustratos que permiten el crecimiento, valores de 0 a -0.25 presentan baja o nula toxicidad, valores entre -0.25 a -0.5 indican toxicidad moderada, valores entre -0.5 a -0.75 presentan efectos tóxicos, y finalmente, valores de -0.75 a -1.0 representan una toxicidad muy alta. De acuerdo a estas referencias, el humus de lombriz presentó un IGN de -0.01 ± 0.10 y un IERN de -0.11 ± 0.10, dichos valores se consideran dentro de baja o nula toxicidad, por lo cual ambos índices confirman que el humus de lombriz no genera efectos tóxicos ni inhibe el crecimiento en comparación con el grupo control. Por su parte, el extracto de zophobas presentó un IGN e IERN de -0.64 ± 0.03 y de -0.29 ± 0.10, respectivamente. Ambos índices muestran que el extracto de zophobas presentó efectos tóxicos para el crecimiento vegetal, siendo el IGN catalogado como toxicidad moderada y el valor del IERN como muy tóxico. Esta diferencia de índices que se observa en el extracto de zophobas es debido a que mientras el IGN considera únicamente valores de germinación de semillas, el IERN depende de la elongación de raíces. Por lo cual, el extracto de zophobas permitió la germinación, pero limito el crecimiento y desarrollo normal radicular en comparación de los grupos control y con extracto de humus de lombriz.
Estos resultados se pueden discutir a partir de algunos estudios previamente documentados. Huerta et al. [5] probaron tres abonos orgánicos (comercial, vacuno, conejo) bajo tres concentraciones y bajo condición de esterilizado o no esterilizado. En dicho estudio observaron que de 20 diferentes condiciones experimentales, 18 mostraron un IG > 80% y solo los tratamientos de abono comercial (1.5:5.0 v/v) y estiércol comercial (1.0:5.0) mostraron IG de 55.9% y 65.9%, respectivamente. Los autores concluyeron que el tipo de fertilizante influyó en la caída del IG más que la concentración del mismo; además, observaron que las diferencias de pH y CE no ejercían mayores efectos en esta disminución del IG entre los tratamientos. Sin embargo, en otros estudios a cargo de Ramírez et al. [14] se evaluó la fitotoxicidad de un abono líquido producido de la fermentación de heces de alpaca; en dicho estudio se observó que la dilución (v/v) del abono líquido era necesaria ya que al 1% se obtuvo un IG de 18.66%, y una dilución al 0.1% mostró una IG de 94.24%; sin embargo, diluciones mayores de 0.01% y 0.001% mostraron IG de 70.65% y 578.01%, respectivamente, mostrando que el uso de un abono líquido debe realizarse a una dosificación adecuada. De manera similar, Florez et al. [9] evaluaron un fertilizante líquido a partir de la fermentación de subproductos de trucha, en su estudio observaron que al reducir la dilución (v/v) de 1% al 0.1% el IG aumentó de 61.77% a 129.1%, respectivamente. De manera similar y más reciente, Urriola et al. [15] observaron, al evaluar abonos orgánicos, que pasar de su uso del 100% a una dilución del 25%, el IG se modificaba de 0 a >80%, respectivamente, mostrando que en algunos orgánicos es necesario reducir su concentración para su adecuado uso.
Es importante considerar que la fitotoxicidad proviene de compuestos inhibitorios o de una concentración elevada de algún compuesto que pueda limitar el desarrollo vegetal de especies sensibles como la lechuga que es un adecuado indicador de fitotoxicidad [10]. En el caso concreto del presente estudio, se puede sospechar que el tratamiento de excretas de zophobas presentó toxicidad debido a la concentración de sales que se observaron mediante la medición de la CE (2.556 ± 0.6 dS m-1). Se ha reportado que la CE para el riego de lechuga debe mantenerse en valores menores a 1.5 dS m-1 ya que por encima de este valor se pueden presentar menores rendimientos en su desarrollo y crecimiento [16]. Esto podría explicar por qué en todos los índices evaluados los extractos de excretas de zophobas mostraron índices catalogados como fitotóxicos.
Finalmente, la Figura 1 muestra la comparación estadística entre el porcentaje de germinación y la longitud de radícula que se observaron entre el testigo con agua, los extractos de humus y zophobas. No se observaron diferencias significativas entre el testigo y el extracto de humus; sin embargo, el uso de extracto de estiércol de zophobas presentó los valores más bajos para ambas variables, confirmando los resultados observados de los índices de germinación.
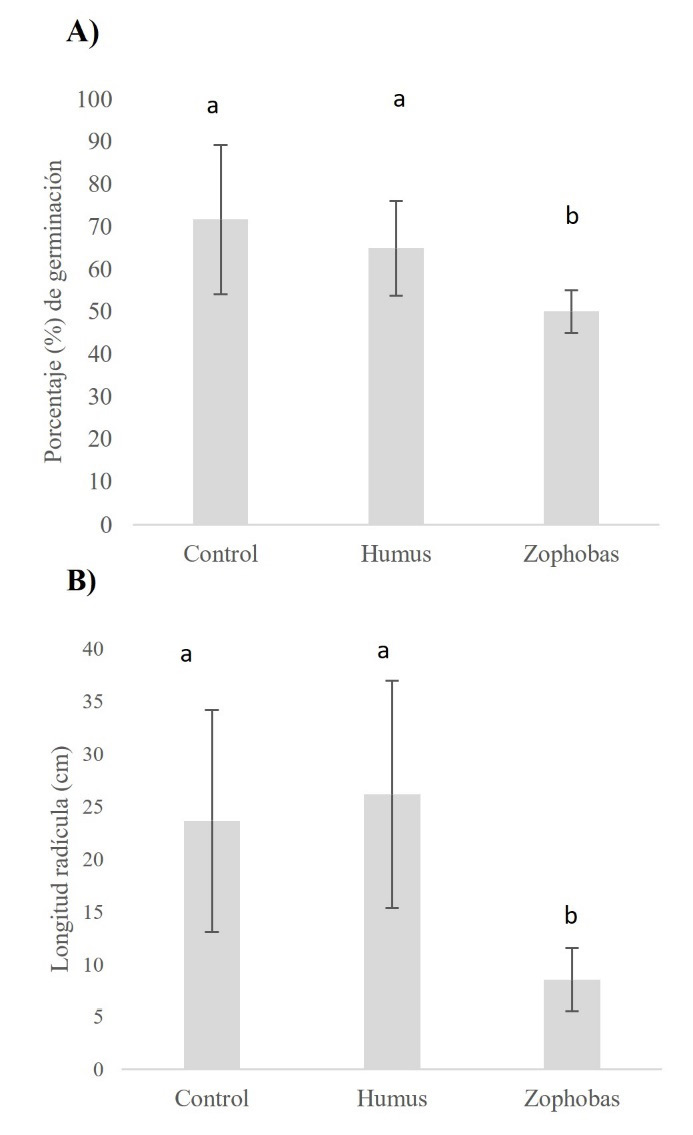
Figura 1. Efecto de los extractos de humus de lombriz y excretas Zophobas morio en el porcentaje de germinación (A) y longitud de la radícula (B) en lechuga orejona.
Conclusiones
La prueba de fitotoxicidad permitió comparar un abono orgánico probado como el humus de lombriz contra las excretas de Zophobas morio, siendo es estas últimas donde se observó un deficiente desarrollo vegetal durante la germinación de semillas de lechuga. Se considera que la alta conductividad eléctrica presente en las excretas de Zophobas morio pudo contribuir a los bajos índices durante las pruebas de fitotoxicidad. Por lo cual es necesario hacer modificaciones en abonos que presenten este tipo de características para no generar resultados negativos en la producción vegetal, se puede recomendar dosificar apropiadamente o explorar dietas en Zophobas que permitan obtener excretas con menores valores de CE.
Agradecimientos
Se agradece al TecNM: Instituto Tecnológico Superior de Libres por su apoyo mediante el proyecto DT-IIAS-0021-2023 “Tratamiento de residuos sólidos orgánicos mediante compostaje- lombricompostaje y su evaluación para mejorar suelos agrícolas”. También se agradece al Dr. Luis Arturo Ibarra por facilitar las muestras de excretas de Zophobas morio que se emplearon para el desarrollo del proyecto.
Referencias
[1] J. Zuñiga. “La seguridad alimentaria en México: Food security in Mexico. LATAM” Revista Latinoamericana de Ciencias Sociales y Humanidades. vol. 5, 2024. https://doi.org/10.56712/latam.v5i3.2135
[2] A. D. Bojórquez et al., “Biofertilizantes en el desarrollo agrícola de México”. Ra Ximhai: Revista Científica de Sociedad, Cultura y Desarrollo Sostenible, vol. 6, no. 1, pp. 51-56, 2010.
[3] R. Sánchez-Hernández & D. Palma. “Abonos orgánicos para la mejora de suelos y cultivos”. En: A. Cruz et al., (Eds.). La biodiversidad en Tabasco. Estudio de estado (Primera edición, 2019). Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. 2019
[4] A. Moreno-Reséndez et al., “Capítulo VI: Abonos orgánicos: una alternativa sustentable en la agricultura”. En: A. Moreno-Reséndez & J.L. Reyes C. (Eds) Tópicos selectos de sustentabilidad, un reto permanente para el nuevo milenio. AM Editores S. A. de C. V., 2020
[5] E. Huerta et al., “Toxicidad de fertilizantes orgánicos estimada con bioensayo de germinación de lechuga”. Terra Latinoamericana, vol. 33, no. 2, pp.179-185, 2015.
[6] J. Cruz-Hernández et al., “Fitotoxicidad de abonos orgánicos líquidos en especies hortícolas indicadoras un método de pre selección”. Revista Biológico Agropecuaria Tuxpan, vol. 3, no. 5, pp. 964-971, 2015.
[7] F. Zucconi et al., “Evaluating toxicity in immature compost”. Biocycle vol. 22, pp. 54-57, 1981.
[8] A.J. Rodríguez et al., “Índices de germinación y elongación radical de Lactuca sativa en el biomonitoreo de la calidad del agua del rio Chalma”. Revista Internacional de Contaminación Ambiental, vol. 30, no. 3, pp. 307-316, 2014.
[9] M. A. Florez et al., “Evaluación de fitotoxicidad y caracterización de un fertilizante líquido elaborado mediante fermentación láctica utilizando subproductos del procesamiento de trucha (Oncorhynchus mykiss)”. Ecología Aplicada, vol. 19, no. 2, pp. 121-131, 2020. https://dx.doi.org/10.21704/rea.v19i2.1563
[10] L. Urriola et al., “Evaluación de la fitotoxicidad de abonos orgánicos comerciales usando semillas de lechuga (Lactuca sativa L.) y pepino (Cucumis sativus)”. Revista Semilla del Este, vol. 1, no. 2, pp. 1-11, 2021.
[11] C.M. Acosta-Durán et al., “Sustrato de lombricomposta para el cultivo de Belén (Impatiens walleriana Hook. f.)”. Revista Bio ciencias, vol. 4, no. 5, pp. 1-14, 2017. http://dx.doi.org/10.15741/revbio.04.05.04
[12] J.P. Arias. “Nuevos abonos a partir de excrementos de insecto: El caso del gusano de la harina (Tenebrio molitor)”. Ingeniería y Región, vol. 19, pp. 1-10, 2018. https://doi.org/10.25054/22161325.1840
[13] M.G Bagur-González et al., “Toxicity assessment using Lactuca sativa L. bioassay of the metal(loid)s As, Cu, Mn, Pb and Zn in soluble-in-water saturated soil extracts from an abandoned mining site”. Journal of Soil and Sediments, vol. 11, pp. 281-289, 2011. https://doi.org/10.1007/s11368-010-0285-4
[14] H. Ramírez et al., “Evaluación de la calidad de un abono líquido producido vía fermentación homoláctica de heces de alpaca”. Ecología Aplicada, 2016. https://dx.doi.org/10.21704/rea.v15i2.753
[15] L. Urriola et al., “Efecto fitotóxico de extractos diluidos de abonos orgánicos en semillas de lechuga”. Revista Semilla del Este, vol. 3, no. 1, pp. 114–126, 2022.
[16] G. Araceli. “Aplicación de enmiendas en suelos salinizados y alcalinizados por efecto del riego con agua subterranea, en relación al rendimiento de lechuga bajo invernadero”. SEMIÁRIDA, vol. 4, no. 1, pp. 70-71, 2014.
Declaración sobre uso de Inteligencia Artificial (IA)
Los autores aquí firmantes declaramos que no se utilizó ninguna herramienta de IA para la conceptualización, traducción o redacción de este artículo.
1 TecNM: Instituto Tecnológico Superior de Libres, Departamento de Ingeniería en Innovación Agrícola Sustentable, Puebla. México.
 daniel.gl@libres.tecnm.mx.
daniel.gl@libres.tecnm.mx. https://orcid.org/0000-0001-8557-4895
https://orcid.org/0000-0001-8557-4895