Alergia al Ácido Acetilsalicílico (AAS) en el contexto de AINEs: navegando desde una perspectiva inmunitaria
Acetylsalicylic Acid (ASA) allergy in the context of NSAIDs: navigating from an immune perspective
Reychell Barrantes-Alvarado1, Julyana Coronado-Salazar2, Donalld Díaz-Méndez3, Andrés Monge-Brenes4, Alison Salas-Campos5
Fecha de recepción: 14 de noviembre, 2023
Fecha de aprobación: 26 de marzo, 2024
Barrantes Alvarado, R; Coronado Salazar, J; Díaz Méndez, D; Monge Brenes, A; Salas Campos, A. Alergia al Ácido Acetilsalicílico (AAS) en el contexto de AINEs: navegando desde una perspectiva inmunitaria. Tecnología en Marcha. Vol. 37, No 4. Octubre-Diciembre, 2024. Pág. 152-161. https://doi.org/10.18845/tm.v37i4.6943
https://doi.org/10.18845/tm.v37i4.6943
Palabras clave
Intolerancia a la aspirina; inflamatorio; ciclooxigenasa (COX); tromboxanos; prostaglandinas; prostaciclina; antinocicepción.
Resumen
Los antiinflamatorios no esteroideos (AINEs) se utilizan en todo el mundo para tratar el dolor y la inflamación; sin embargo, pueden desencadenar varios tipos de reacciones de hipersensibilidad a fármacos en todos los grupos de edad. Un número significativo de reacciones de hipersensibilidad a los AINEs se deben a mecanismos inmunológicos. Con el fin de proporcionar una base que permita una mejor comprensión y gestión médica a la alergia al ácido acetilsalicílico (AAS) en el contexto de antiinflamatorio no esteroide (AINEs), este articulo tiene el propósito de revisar los principales aspectos relativos a las causas, mecanismo inmunológico, síntomas, diagnóstico y opciones de tratamiento relacionados con esta alergia. Los AINEs se clasifican según su estructura química y su selectividad para inhibir las enzimas COX. Se resaltan las ventajas de los AINEs selectivos de COX-2 al minimizar los efectos secundarios gastrointestinales, y se destaca el AAS como un fármaco comúnmente recetado debido a su actividad multifuncional, incluida la prevención del accidente cerebrovascular y el infarto de miocardio.
Keywords
Aspirin intolerance; inflammatory; cyclooxygenase (COX); thromboxanes; prostaglandins; prostacyclin; antinociception.
Abstract
Nonsteroidal anti-inflammatory drugs (NSAIDs) are used worldwide to treat pain and inflammation; however, they can trigger various types of drug hypersensitivity reactions in all age groups. A significant number of hypersensitivity reactions to NSAIDs are due to immunological mechanisms. In order to provide a basis for better understanding and medical management of acetylsalicylic acid (ASA) allergy in the context of nonsteroidal anti-inflammatory drugs (NSAIDs), this article aims to review the main aspects regarding the causes, immunologic mechanism, symptoms, diagnosis, and treatment options related to this allergy. NSAIDs are classified according to their chemical structure and their selectivity to inhibit COX enzymes. The advantages of COX-2 selective NSAIDs in minimizing gastrointestinal side effects are highlighted, and ASA is highlighted as a commonly prescribed drug because of its multifunctional activity, including prevention of stroke and myocardial infarction.
Introducción
Los antiinflamatorios no esteroideos (AINEs) son un grupo de medicamentos ampliamente utilizados que tienen propiedades antiinflamatorias, analgésicas y antipirética, los cuales son los principales desencadenantes de reacciones de hipersensibilidad a medicamentos [1-2]. Con el fin de proporcionar una base que permita una mejor comprensión y gestión médica de la alergia al ácido acetilsalicílico (AAS) en el contexto de antiinflamatorio no esteroide (AINEs), este articulo busca revisar los principales aspectos relativos a las causas, mecanismo inmunológico, síntomas, diagnóstico y opciones de tratamiento relacionadas con esta alergia.
Mecanismo de acción
El principal mecanismo de acción de los AINEs es la inhibición de la enzima ciclooxigenasa (COX). La ciclooxigenasa participa en el metabolismo del ácido araquidónico para la síntesis de tromboxanos, prostaglandinas y prostaciclinas. Los efectos terapéuticos de los AINEs se atribuyen a la ausencia de estos eicosanoides. Principalmente, los tromboxanos desempeñan un papel en la adhesión plaquetaria, las prostaglandinas provocan vasodilatación, aumentan el punto de ajuste de temperatura en el hipotálamo y desempeñan un papel en la antinocicepción [1-2].
Existen dos isoformas principales de ciclooxigenasa, COX-1 y COX-2. La COX-1 se expresa constitutivamente y desempeña un papel en el mantenimiento del revestimiento de la mucosa gastrointestinal, la función renal y la agregación plaquetaria. La COX-2 no se expresa constitutivamente y en cambio, se expresa de manera inducible durante una respuesta inflamatoria. La mayoría de los AINEs no son selectivos e inhiben tanto la COX-1 como la COX-2, por lo tanto, los AINEs selectivos para la COX-2 tienen un perfil de efectos secundarios diferente. Es importante destacar que, debido a que la COX-1 es el principal mediador para garantizar la integridad de la mucosa gástrica y la COX-2 participa principalmente en la inflamación, los AINEs selectivos de la COX-2 deberían proporcionar un alivio antiinflamatorio sin comprometer la mucosa gástrica [1-2].
Clasificación de los AINEs
Los AINEs ácidos comprenden un grupo de sustancias estructuralmente diversas que albergan un grupo carboxilo en su estructura los cuales se clasifican como salicilatos, pertenecientes a la clase de ácido fenilacético, ácido antranílico, ácido acético indol, ácido indeno y ácido propiónico [3]. En el cuadro 1 se encuentran especificadas estas divisiones, junto con sus medicamentos correspondientes y la estructura química asociada, ofreciendo una perspectiva sistemática que caracteriza las distintas familias de agentes terapéuticos.
Primeramente, se puede mencionar que la clase proveniente del ácido salicílico pertenece a una gran categoría de fenólicos vegetales con un anillo aromático que incluye conjuntos hidroxilo o sus derivados funcionales, además, la parte procedente del ácido arilo o heteroarilo acético posee una estructura esquelética de Ar-CH(CH3)-COOH [4]. Por otro lado, para la tercera clasificación, las fórmulas químicas incluyen un ciclo de carbono sustituido en la posición α de –CH2–COOH. Seguidamente, los antranilatos se caracteriza por la presencia de pequeños sustituyentes alquilo y/o halógenos en la posición 2’, 3’ y/o 6’ de la fracción N-arilo. Por último, los derivados del ácido enólico, principalmente el meloxicam y la piroxicam, se caracterizan por poseer un heterociclo de 4-hidroxibenzotiazina [5].
Cuadro 1. Clasificación de los fármacos antiinflamatorios no esteroideos de acuerdo con su estructura química.
|
Fármaco |
Estructura química |
|
|
Derivados del ácido salicílico |
Sulfasalazina |
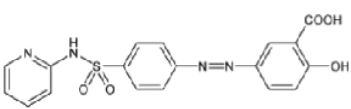
|
|
Ácido acetilsalicílico |
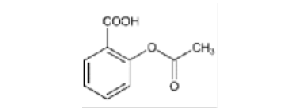
|
|
|
Salicilato de sodio |
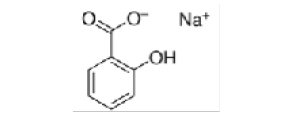
|
|
|
Diflunisal |
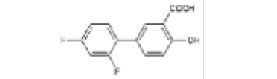
|
|
|
Derivados del ácido arilo o heteroarilo acético |
Ibuprofeno |
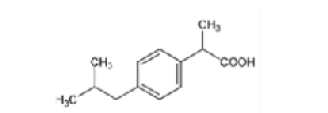
|
|
Fenoprofeno |
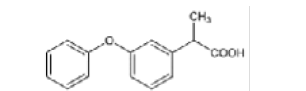
|
|
|
Naproxeno |
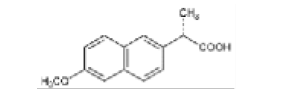
|
|
|
Oxaprozin |
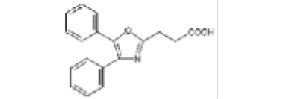
|
|
|
Derivados del indol e Indeno acético ácidos |
Indometacina |
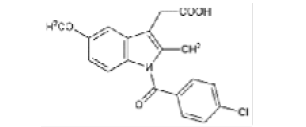
|
|
Sulindaco |
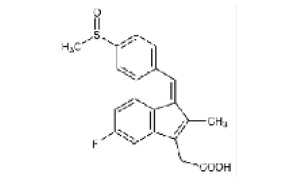
|
|
|
Etodolaco |
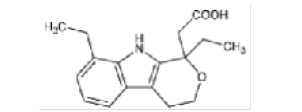
|
|
|
Derivados del ácido antranílico |
Diclofenaco |
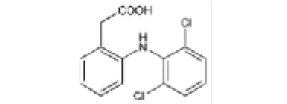
|
|
Ácido mefenámico |
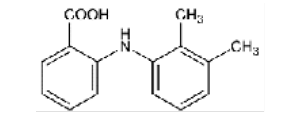
|
|
|
Ácido meclofenámico |
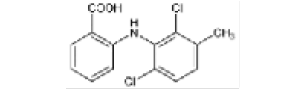
|
|
|
Derivados del ácido enólico |
Piroxicam |
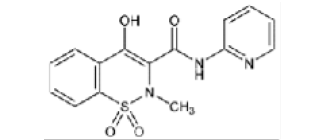
|
|
Meloxicam |
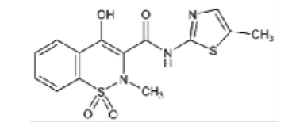
|
Nota: Se muestra la clasificación de los AINEs de acuerdo su estructura química dividida en cinco grupos que incluyen sus derivados [4].
Clasificación alternativa de los AINEs.
Dado que la función de los AINEs se manifiesta principalmente en el sistema enzimático ciclooxigenasa, ya sea la COX-1 o la COX-2, su clasificación depende de la selectividad con respecto a los dos tipos de enzimas mencionados anteriormente.
Existen inhibidores de COX no selectivos que bloquean tanto la COX-1 como la COX-2, reduciendo la inflamación, la fiebre y el dolor. Por otro lado, los inhibidores preferenciales de la COX-2 se enfocan principalmente en bloquear esta enzima en lugar de la COX-1, lo que disminuye la síntesis de prostaglandinas aminorando los efectos desfavorables producidos en el cuerpo, pero con menos efectos analgésicos. Por último, la inhibición selectiva de la COX-2 se desarrolló para reducir la toxicidad gastrointestinal y sigue siendo efectiva en el tratamiento de la inflamación [6]. Por ello, cabe recalcar que la elección adecuada de dichos inhibidores en función de las necesidades clínicas y terapéuticas de los pacientes es esencial para lograr resultados óptimos en el manejo de los malestares mencionados en un inicio. Asimismo, se pueden clasificar según su farmacodinamia, como los de acción corta (vida media plasmática inferior a 6 h) y de acción prolongada (vida media más de 10 h) [3].
Ventajas y desventajas de diferentes tipos de AINEs.
Se han identificado riesgos de infarto de miocardio y accidentes cerebrovasculares en los AINEs selectivos y no selectivos de la COX-2 (que se encuentra en la inflamación) y la COX-1 (la cual se localiza en el estómago, las plaquetas y los vasos sanguíneos) [7]. El uso crónico de la mayoría de los AINEs es desalentado debido a la amplia variedad de efectos adversos que incluyen problemas gastrointestinales y renales. Estas reacciones adversas se vuelven más pronunciadas en individuos con afecciones preexistentes relacionadas con el sistema cardiovascular, cerebrovascular, gastrointestinal o renal. Se ha propuesto que la selectividad relativa de los diferentes agentes en la inhibición de los dos isómeros de la COX está relacionada con el riesgo de complicaciones gastrointestinales y cardiovasculares, aunque esta afirmación carece de respaldo con evidencia sólida [8].
Por el contrario, una de las ventajas de los AINEs es su actividad en el control de la inflamación y el dolor que se ha mostrado en diversas afecciones como la artritis reumatoide, la osteoporosis, dolor dental y dolores de cabeza. Estos agentes ejercen sus efectos antiinflamatorios, antipiréticos y analgésicos bloqueando la actividad de las enzimas COX, en diversos grados inhibiendo así la biosíntesis de prostaglandinas y prostanoides derivados del ácido araquidónico [8].
Catabolismo del ácido acetilsalicílico (AAS)
Gran parte de los AINEs se metabolizan a través de la oxidación y conjugación por medio de metabolitos inactivos, lo cual permite excretarlos a través de la orina. Este proceso ocurre en el hígado y los riñones, donde diversas enzimas descomponen estos medicamentos. Sin embargo, ciertas enzimas se destacan por contar con mayor afinidad hacia el metabolismo del ácido acetilsalicílico (AAS) [9].
Este tipo de fármacos presenta una buena biodisponibilidad en animales de una sola cavidad estomacal, sin embargo, su excreción en la orina es baja debido a su alta unión a proteínas plasmáticas. En este proceso, las enzimas microsomales del citocromo P450 con oxidasas de función mixta son fundamentales, ya que se encargan principalmente del metabolismo de estos medicamentos [9].
La N-acetiltransferasa 2 es una enzima esencial dentro del metabolismo y la desintoxicación de fármacos como la Aspirina. Actúa por medio de la O-acetilación de N-hidroxiarilaminas, los cuales son productos resultantes de la oxidación por enzimas pertenecientes al citocromo P450 [10].
La UDP-glucuronosiltransferasa (UGT) se encarga de facilitar la eliminación de compuestos formando enlaces covalentes entre el ácido glucurónico y fármacos o compuestos lipofílicos, tanto endógenos como exógenos. Esto aumenta la solubilidad del ácido acetilsalicílico en la orina y permite su eliminación del cuerpo de manera efectiva [11].
Intolerancia al ácido acetilsalicílico (AAS)
La alergia a un medicamento se fundamenta en una respuesta de hipersensibilidad y reacción corporal al entrar en contacto con el alérgeno, desencadenando respuestas inmunológicas que impactan tanto en la condición del paciente como en la eficacia del tratamiento [12]. En el caso del AAS, su acción antipirética al inhibir el proceso en el hipotálamo implica la participación de leucocitos polimorfonucleares en las áreas inflamadas. La inhibición de la ciclooxigenasa-1 (COX-1), responsable de la síntesis del tromboxano A2 (TXA2), precursores clave en la hemostasia y regulación de las hemorragias, interactúa con las células del estroma, generando así una inflamación crónica en la región afectada [13-14].
De igual forma, la principal causa de alergia ante la aspirina es debido a la inhibición de inmunoglobulinas (IgE), lo que activa COX-2 y genera respuestas inmunológicas contra este antialergénico [15-16]. Se reporta que de cada millón de personas que consumen AINEs fallecen cerca de 25 debido a efectos adversos ocasionados por la inhibición de COX, entre cuyas causas se podría encontrar la alergia a estos productos y más específicamente al AAS [13-14].
Existe una gran cantidad de inmunoglubinas E (IgE) específicas que reconocen los diferentes tipos de AINEs presentes, mediando la respuesta alérgica [14]. Dado que los AINEs poseen un peso molecular muy bajo, para iniciar su efecto farmacológico requieren unirse o conjugarse a una proteína que lo reconozca, lo que implica la presencia anterior del AINE en el cuerpo para la generación de los antígenos [17-18].
Durante el proceso de conjugación, células dendríticas, clave en la respuesta inmunológica, procesan los linfocitos Th2 adultos, que promueven la producción de IgEs específicas para el AINE procesado por cuerpo [14]. Estos anticuerpos, se unen posteriormente a receptores muy específicos de basófilos y mastocitos, células del sistema circulatorio que liberan sustancias proinflamatorias y compuestos como histamina, que promueven la regulación por vasos y otras estructuras, para minimizar el movimiento del AINE por el torrente sanguíneo, reduciendo su distribución [19-20]. La alergia se genera entonces como una respuesta inmunitaria en la que están implicadas células (e.g. los mastocitos), anticuerpos y compuestos proinflamatorios y quimiotáxicos que generan todos los síntomas de la reacción [19-20].
La inhibicón del COX se genera al ser aplicado un silenciamiento en una de las cadenas laterales de la serina presente en los isómeros COX, que catalizan ácido araquidónico, generando prostaglandina G2, que luego se convierte en prostaglandina H2 [20]. Esta última es un precursor en la formación de varias prostaglandinas, como E2, que está relacionada con la inflamación y el aumento de la temperatura corporal.
Factores de riesgo
Existe una serie de síntomas ante una posible alergia a los AINEs, principalmente cutáneos y respiratorios. En la piel, pueden incluir enrojecimiento, comezón, inflamación en áreas sensibles, enrojecimiento de los ojos, entre otras complicaciones [21]. En la vía respiratoria, los síntomas pueden abarcar dificultad para respirar, asma y congestión nasal, generalmente apareciendo alrededor de 1 hora después de su ingesta. Las posibilidades de presentar alergia son del 1% en personas sanas, pero aumentan al 30% en aquellos con urticaria, pólipos nasales o asma preexistentes [22].
Una de las más severas que se puede presentar es la reacción anafiláctica, en la cual una hipersensibilidad inmediata ocasiona la activación e interconexión de varios IgE. Esta reacción ocurre cuando los IgE se unen a mastocitos y basófilos y se cruzan con el alérgeno, liberando moléculas como histamina y triptasa que producen enrojecimiento, hipotensión, broncoespasmos, taquicardia u otras respuestas fisiológicas [23].
Pruebas clínicas
En la actualidad no se cuenta con una prueba específica y sensible para detectar de previo alergias a los AINEs, por lo que su diagnóstico se da por identificación de los síntomas una vez que ocurren. Los alergólogos suelen revisar el historial médico, pero esto no es muy preciso, y si el paciente no ha sido expuesto previamente a estos fármacos tampoco habrá información disponible. En caso de sospecha, se realizan pruebas cómo las cutáneas, en las que se aplica una pequeña cantidad del medicamento en forma de una pequeña herida o punzada en la piel y se trata de identificar la presencia de reacción alérgica, para evitar riesgos potenciales asociados con medicamentos inadecuados [2].
Se piensa que la reacción alérgica ante los AINEs se debe a la presencia previa de IgE en el cuerpo, generadas como consecuencia de la exposición previa a AINEs relacionados. La anafilaxia es una reacción alérgica grave que requiere de atención inmediata y no debe confundirse con la reacción anafilactoide, que, es clínicamente similar, pero ocurre sin la participación de IgE y se considera una intolerancia, no una alergia [23].
Para quienes padecen una alergia al AAS, la mejor recomendación es evitar su consumo. Por otro lado, para personas que deben consumirlo para tratar condiciones crónicas o cardiovasculares, se creó un tratamiento de “desensibilización”, que consiste en la administración muy regulada de dosis progresivas de aspirina hasta generar cierta resistencia, mostrando resultados muy positivos en cuanto a reducción de afecciones y hospitalizaciones [17-24].
Consumo y alternativas a los AINEs
Si bien los AINEs comprenden una variedad de medicamentos para el tratamiento del dolor, la fiebre y otras condiciones inflamatorias [1], existen alternativas viables que resultan muy beneficiosas debido a su baja incidencia de efectos secundarios. El ejemplo más destacado y ampliamente utilizado es el Paracetamol, que ofrece un efecto similar al de los AINEs en términos de eficacia terapéutica para el control de dolores agudos y crónicos [25].
Otras alternativas eficaces son los opioides recetados como la codeína, oxicodona, morfina, fentanilo entre otros, que debido a su estructura química presentan propiedades que inducen relajación y alivian el dolor [20]. Sin embargo, esta alternativa presenta como contraindicación relacionada a su alto riesgo de adicción, debido a posibles implicaciones psicológicas y emocionales, generando una dependencia hacia ellos [26].
Los analgésicos tópicos son una alternativa a los AINEs que pueden propiciar alivio en condiciones de dolor agudo o crónico en afecciones musculoesqueléticas [27]. Por ejemplo, la capsaicina es un compuesto proveniente de los chiles que genera una modulación neuronal del dolor por medio de apoptosis ya que induce a la fragmentación del ADN y reducción del núcleo generando la modulación de las neuronas sensoriales y que es más prolongada en condiciones inflamatorias [28].
Se debe considerar el tipo de afección la edad del paciente, la duración del tratamiento, y los efectos secundarios que pueda generar, con el fin de minimizar el riesgo de complicaciones en pacientes con enfermedades cardiovasculares, o renales, ya que los AINEs pueden incrementar el riesgo de ataques cardiacos y fallos renales, y se ha determinado que pacientes con edad avanzada presentan mayor tendencia a desarrollar este tipo de complicaciones renales y cardiacos [28-29].
Conclusiones
Los antiinflamatorios no esteroides (AINEs) constituyen una variedad de compuestos químicos. Estas sustancias se categorizan según su estructura química, y la clasificación está vinculada a su habilidad para inhibir las enzimas ciclooxigenasas.
La alergia al AAS se basa en una respuesta inmunológica mediada por IgE, que se desencadena cuando el AAS inhibe la COX-2, activando así a las inmunoglobulinas. Esto puede desencadenar síntomas en la piel y vías respiratorias, con riesgo de anafilaxia. En la actualidad no se cuenta con una prueba específica y sensible para detectar de previo alergias a los AINES, por lo que el estudio del historial médico se vuelve una herramienta útil capaz de detectar la posible presencia de alergia por un paciente. La desensibilización es una opción para quienes, siendo alérgicos, requieren tratamiento con AAS, mostrando buenos resultados en la reducción de complicaciones.
Finalmente, los AINEs ofrecen alta efectividad, sin embargo, pueden presentar efectos adversos que se deben considerar durante la elección del tratamiento, así como el tipo y duración de la afección, y la edad, especialmente en pacientes con condiciones de salud preexistentes. A su vez los AINEs pueden aumentar el riesgo de problemas cardiovasculares y renales, por lo que se debe evaluar cuidadosamente su uso para posibles estudios posteriores.
Referencias
[1] I. Ghlichloo y V. Gerriets, «Nonsteroidal Anti-Inflammatory Drugs (NSAIDs)», en StatPearls [Internet], StatPearls Publishing, 2023. Accedido: 2 de septiembre de 2023. [En línea]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK547742/
[2] S. Wöhrl, «NSAID hypersensitivity – recommendations for diagnostic work up and patient management», Allergo J Int, vol. 27, n.o 4, pp. 114-121, 2018. 10.1007/s40629-018-0064-0
[3] H. Itoh, N. Yamashita, S. Kamijo, K. Masuda, H. Kato, y S. Yamaori, «Effects of acidic non-steroidal anti-inflammatory drugs on human cytochrome P450 4A11 activity: Roles of carboxylic acid and a sulfur atom in potent inhibition by sulindac sulfide», Chemico-Biological Interactions, vol. 382, p. 110644, sep. 2023, doi: 10.1016/j.cbi.2023.110644
[4] N. C. Huynh, T. T. T. Nguyen, D. T. C. Nguyen, y T. V. Tran, «Occurrence, toxicity, impact and removal of selected non-steroidal anti-inflammatory drugs (NSAIDs): A review», Science of The Total Environment, vol. 898, p. 165317, nov. 2023, doi: https://doi.org/10.1016/j.scitotenv.2023.165317
[5] L. Meunier y D. Larrey, «Recent Advances in Hepatotoxicity of Non-Steroidal Anti-inflammatory Drugs», Annals of Hepatology, vol. 17, n.o 2, pp. 187-191, mar. 2018, doi: https://doi.org/10.5604/01.3001.0010.8633
[6] K. A. Ali, A. Maity, S. D. Roy, S. Das Pramanik, P. Pratim Das, y Md. A. Shaharyar, «Chapter 4 - Insight into the mechanism of steroidal and non-steroidal anti-inflammatory drugs», en How Synthetic Drugs Work, I. Kazmi, S. Karmakar, Md. A. Shaharyar, M. Afzal, y F. A. Al-Abbasi, Eds., Academic Press, 2023, pp. 61-94. doi: https://doi.org/10.1016/B978-0-323-99855-0.00004-X
[7] N. F. Athow, P. M. Morgan, y G. A. Brown, «Hip and Knee Osteoarthritis, Not Nonsteroidal Anti-Inflammatory Drugs, are Linked to Cardiac Disease», The Journal of Arthroplasty, May 2023, doi: 10.1016/j.arth.2023.05.026.
[8] H. Al-Lawati, Z. Binkhathlan, y A. Lavasanifar, «Nanomedicine for the effective and safe delivery of non-steroidal anti-inflammatory drugs: A review of preclinical research», European Journal of Pharmaceutics and Biopharmaceutics, vol. 142, pp. 179-194, sep. 2019, doi: 10.1016/j.ejpb.2019.06.025.
[9] M. J. van Dijk, J. de Wilde, M. Bartels, et al., «Activation of pyruvate kinase as therapeutic option for rare hemolytic anemias: Shedding new light on an old enzyme», Blood Reviews, vol. 61, p. 101103, sep. 2023, doi: 10.1016/j.blre.2023.101103.
[10] D. W. Hein y L. M. Millner, «Arylamine N-acetyltransferase acetylation polymorphisms: paradigm for pharmacogenomic-guided therapy- a focused review», Expert Opin Drug Metab Toxicol, vol. 17, n.o 1, pp. 9-21, ene. 2021, doi: 10.1080/17425255.2021.1840551.
[11] Y. Jarrar y S.-J. Lee, «The Functionality of UDP-Glucuronosyltransferase Genetic Variants and their Association with Drug Responses and Human Diseases», J Pers Med, vol. 11, n.o 6, p. 554, jun. 2021, doi: 10.3390/jpm11060554.
[12] R. Warrington, F. Silviu-Dan, y T. Wong, «Drug allergy», Allergy, Asthma & Clinical Immunology, vol. 14, n.o 2, p. 60, sep. 2018, doi: 10.1186/s13223-018-0289-y.
[13]. A. Qureshi y M. A. Fischer «Topical Calcineurin Inhibitors Revisited», Archives of Dermatology, vol. 143, n.o 4, pp. 543-551, abr. 2007, doi: 10.1001/archderm.143.4.545.
[14] S. Bindu, S. Mazumder, y U. Bandyopadhyay, «Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective», Biochemical Pharmacology, vol. 180, p. 114147, oct. 2020, doi: 10.1016/j.bcp.2020.114147.
[15] A. Bruno, A. Contursi, S. Tacconelli, et al., «The specific deletion of cyclooxygenase-1 in megakaryocytes/platelets reduces intestinal polyposis in ApcMin/+ mice», Pharmacological Research, vol. 185, p. 106506, nov. 2022, doi: 10.1016/j.phrs.2022.106506.
[16] National Library of Medicine, “Acetylsalicylic Acid Action Pathway”. Pubchm. PthBnk, 2023. [En línea]. Disponible en: https://pubchem.ncbi.nlm.nih.gov/pathway/PathBank:SMP0000083
[17] G. Cortellini, A. Raiteri, M. Galli, M. Lotrionte, F. Piscaglia, y A. Romano, «Acetylsalicylic acid challenge or desensitization in sensitive patients with cardiovascular disease», J Thromb Thrombolysis, vol. 55, n.o 4, pp. 762-769, may 2023, doi: 10.1007/s11239-023-02782-1.
[18] I. Doña, N. Pérez-Sánchez, I. Eguiluz-Gracia, R. Muñoz-Cano, J. Bartra, M. Torres, J. Cornejo-García., «Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs», Allergy, vol. 75, n.o 3, pp. 561-575, 2020, doi: 10.1111/all.14032.
[19] N. Zhang, Z. Zhang, X. Wang. «The roles of basophils in mediating the immune responses», European Journal of Inflammation. 2021;19. doi: https://doi.org/10.1177/205873922110476
[20] National Institute on Drug Abuse, «Prescription Opioids Drug Facts». Presc. Op. DrgFac, 2021. [En línea]. Disponible: https://nida.nih.gov/publications/drugfacts/prescription-opioids
[21] E. Mulkiewicz, D. Wolecki, K. Świacka, J. Kumirska, P. Stepnowski, y M. Caban, «Metabolism of non-steroidal anti-inflammatory drugs by non-target wild-living organisms», Science of The Total Environment, vol. 791, p. 148251, oct. 2021, doi: 10.1016/j.scitotenv.2021.148251.
[22] «ASCIA Guide for Milk Substitutes in Cow’s Milk Allergy - Australasian Society of Clinical Immunology and Allergy (ASCIA). “Allergic reactions to aspirin and other pain killers”». Last update 2023 [En línea]. Disponible en: https://www.allergy.org.au/hp/papers/guide-for-milk-substitutes-cows-milk-allergy
[23] D. Fischer, T. Vander-Leek, A. Ellis, H. Kim., «Anaphylaxis», Allergy, asthma, and clinical immunology: official journal of the Canadian Society of Allergy and Clinical Immunology, 14(Suppl 2), 54, 2018, doi: https://doi.org/10.1186/s13223-018-0283-4
[24] U. Freo, C. Ruocco, A. Valerio, I. Scagnol, y E. Nisoli, «Paracetamol: A Review of Guideline Recommendations», Journal of Clinical Medicine, vol. 10, n.o 15, Art. n.o 15, ene. 2021, doi: 10.3390/jcm10153420.
[25] B. Cohen, L. J. Ruth, y C. V. Preuss, «Opioid Analgesics», en StatPearls, Treasure Island (FL): StatPearls Publishing, 2023. Accedido: 1 de octubre de 2023. [En línea]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK459161/
[26] J. Maloney, S. Pew, C. Wie, R. Gupta, J. Freeman, y N. Strand, «Comprehensive Review of Topical Analgesics for Chronic Pain», Curr. Pain Headache Rep., vol. 25, n.o 2, p. 7, feb. 2021, doi: 10.1007/s11916-020-00923-2.
[27] V. Arora, J. N. Campbell, y M.-K. Chung, «Fight fire with fire: Neurobiology of capsaicin-induced analgesia for chronic pain», Pharmacol. Ther., vol. 220, p. 107743, abr. 2021, doi: 10.1016/j.pharmthera.2020.107743.
[28] A. Olry de Labry Lima, E. Salamanca-Fernández, E. J. Alegre del Rey, A. Matas Hoces, M. Á. González Vera, y C. Bermúdez Tamayo, «Safety considerations during prescription of non-steroidal anti-inflammatory drugs (NSAIDs), through a review of systematic reviews», An Sist Sanit Navar, vol. 44, n.o 2, pp. 261-273, ago. 2021, doi: 10.23938/ASSN.0965.
[29] A. Al-Azayzih et al., «Nonsteroidal Anti-inflammatory Drugs Utilization Patterns and Risk of Adverse Events due to Drug-Drug Interactions among Elderly Patients: A Study from Jordan», Saudi Pharmaceutical Journal, vol. 28, n.o 4, pp. 504-508, abr. 2020, doi: 10.1016/j.jsps.2020.03.001.
Declaración sobre uso de Inteligencia Artificial (IA)
Los autores declaramos que hemos utilizado una herramienta de Inteligencia Artificial (IA) ChatGPT para asistirnos en la redacción de este artículo. Esta herramienta nos ayudó a mejorar la estructura y la claridad del texto. Los contenidos generados por la IA fueron revisados minuciosamente por nosotros para asegurar su precisión y coherencia con el objetivo del estudio.
Además, utilizamos la mismas herramienta de IA para traducir partes de este artículo. La herramienta nos ayudó a agilizar el proceso de traducción, pero realizamos una revisión exhaustiva para asegurar la calidad y precisión de las traducciones.
1 Ingeniería en Biotecnología, Bioquímica. Instituto Tecnológico de Costa Rica. Costa Rica.
 reybarrantes@estudiantec.cr
reybarrantes@estudiantec.cr https://orcid.org/0009-0009-3542-0594
https://orcid.org/0009-0009-3542-0594 2 Ingeniería en Biotecnología, Bioquímica. Instituto Tecnológico de Costa Rica. Costa Rica.
 jucoronado@estudiantec.cr
jucoronado@estudiantec.cr https://orcid.org/0009-0005-4565-7721
https://orcid.org/0009-0005-4565-7721 3 Ingeniería en Biotecnología, Bioquímica. Instituto Tecnológico de Costa Rica. Costa Rica.
 dondiaz@estudiantec.cr
dondiaz@estudiantec.cr https://orcid.org/0009-0006-1226-4355
https://orcid.org/0009-0006-1226-43554 Ingeniería en Biotecnología, Bioquímica. Instituto Tecnológico de Costa Rica. Costa Rica.
 andres.mb@estudiantec.cr
andres.mb@estudiantec.cr https://orcid.org/0009-0007-0738-5125
https://orcid.org/0009-0007-0738-51255 Ingeniería en Biotecnología, Bioquímica. Instituto Tecnológico de Costa Rica. Costa Rica.
 alisonsalas@estudiantec.cr
alisonsalas@estudiantec.cr https://orcid.org/0009-0001-5596-4486
https://orcid.org/0009-0001-5596-4486