Contenido de metales pesados en sedimentos de varios ríos de Costa Rica
Heavy metals content in sediments of several rivers in Costa Rica
Guillermo Calvo-Brenes1, Noemi Quirós-Bustos2, Diana Robles-Chaves3, Andrey Caballero-Chavarría4
Fecha de recepción: 13 de noviembre, 2023
Fecha de aprobación: 9 de marzo, 2024
Calvo-Brenes, G; Quirós-Bustos, N; Robles-Chaves, D; Caballero-Chavarría, A. Contenido de metales pesados en sedimentos de varios ríos de Costa Rica. Tecnología en Marcha. Vol. 37, No 4. Octubre-Diciembre, 2024. Pág. 141-151. https://doi.org/10.18845/tm.v37i4.6940
https://doi.org/10.18845/tm.v37i4.6940
Palabras clave
Metales pesados; calidad de ríos; contaminación.
Resumen
Costa Rica posee una abundancia de recursos hídricos, sin embargo, enfrenta un alto nivel de contaminación. Los metales pesados (MPs) destacan debido a sus efectos perjudiciales en la salud de personas, animales y plantas, así como por su falta de biodegradabilidad y su propensión a acumularse en los organismos. Esta contaminación proviene tanto de descargas directas de aguas residuales domésticas e industriales en los ríos, como de la contaminación difusa originada en actividades agrícolas y la contaminación atmosférica. Un estudio reciente realizado en los ríos de Costa Rica reveló la presencia de MPs, tales como plomo, cromo, cobre, arsénico, níquel y mercurio. El objetivo de esta investigación fue evaluar la concentración de estos metales en los sedimentos de los ríos. Se muestrearon 26 sitios distribuidos en diversas zonas del país, abarcando el período comprendido entre 2017 y 2019. Los niveles de toxicidad para el cadmio fueron clasificados como no probable, al igual que la mayoría de los lugares muestreados para arsénico, plomo, cromo y mercurio. En cuanto al cobre y níquel, se observaron niveles que oscilaron entre toxicidad no probable e indefinida. Sin embargo, algunos datos relacionados con níquel, cobre y cromo se ubicaron en la zona de toxicidad probable.
Keywords
Heavy metals; river quality; contamination.
Abstract
Costa Rica has an abundance of water resources, however, it faces a high level of pollution. Heavy metals (PMs) stand out due to their harmful effects on the health of people, animals and plants, as well as their lack of biodegradability and their propensity to accumulate in organisms. This pollution comes from both direct discharges of domestic and industrial wastewater into rivers, as well as diffuse pollution originating from agricultural activities and atmospheric pollution. A recent study carried out in the rivers of Costa Rica revealed the presence of MPs, such as lead, chromium, copper, arsenic, nickel and mercury. The objective of this research was to evaluate the concentration of these metals in river sediments through 26 sampling sites distributed in various areas of the country, covering the period between 2017 and 2019. The toxicity levels for cadmium were classified as not probable, as were the majority of the places sampled for arsenic, lead, chromium and mercury. Regarding copper and nickel, levels ranged from unlikely to undefined toxicity were observed. However, some data related to nickel, copper and chromium were in the zone of probable toxicity.
Introducción
Costa Rica posee una riqueza hídrica importante; sin embargo, varios de los ríos presentan niveles de contaminación altos [1]. Parte de esta contaminación proviene de descargas directas a los ríos de aguas residuales domésticas e industriales; mientras que otras corresponden a contaminación difusa cuyos principales contaminantes tienen su origen en actividades agrícolas y la contaminación atmosférica [2], [3]. Diferentes contaminantes que se mantienen suspendidos en el aire en forma de partículas [4], [5], eventualmente se depositan en el suelo y estos, a su vez junto con los contaminantes existentes en los suelos, pueden ser acarreados hasta los ríos y zonas costeras a través de procesos erosivos y las escorrentías que se producen durante períodos de precipitaciones pluviales [6]–[8].
Un tipo importante de contaminantes son los metales pesados (MPs) pues tienen un impacto adverso en la salud, tanto en personas como en animales y en plantas, cuando su concentración sobrepasa ciertos límites en el agua, el aire, en el suelo o en sedimentos [8], [9]. Estos metales se encuentran en la naturaleza y forman parte de los procesos metabólicos en la flora y fauna [10], [11]. Sin embargo, cuando estos sobrepasan ciertos niveles, se convierten en contaminantes de alta peligrosidad [6], [9]. Los MPs provienen tanto de fuentes naturales como antropogénicas; las naturales incluyen a las rocas, minerales e incluso la actividad volcánica; mientras que las fuentes antropogénicas incluyen las actividades agrícolas, industriales, domésticas, la minería, la generación de energía y el transporte [2], [12].
Dentro de los seres vivos, estos metales se pueden bioacumular ya que el organismo, en ocasiones, no tiene mecanismos para reducir su concentración a un ritmo adecuado. Dentro del organismo estos pueden alcanzar concentraciones más elevadas que las que se encuentran en el medio ambiente o en los alimentos [9], [11].
El hecho de que los MPs sean bioacumulables y que su biodegradabilidad sea prácticamente nula, ocasionan efectos tóxicos duraderos [9], [11]. Niveles altos de metales en plantas causan un efecto fitotóxico que se puede manifestar en una disminución de su crecimiento, alteran el consumo o retención de agua dentro de la planta, afectan la permeabilidad de las raíces, inhiben los procesos fotosintéticos, la respiración o la afectación de la actividad enzimática [11].
La contaminación por MPs en el ambiente se da por 5 posibles vías: retención en suelos, absorción en plantas (cadena trófica) [2], en material particulado en aire (PM10 y PM2.5) donde usualmente se encuentra retenido y el cual, a su vez, está en suspensión [7]; retención en polvos urbanos, así como la movilización en aguas superficiales y subterráneas [2].
En humanos, la exposición a estos elementos está relacionada con problemas de salud como retrasos en el desarrollo, varios tipos de cáncer, daños en el riñón, e incluso, con casos de muerte [9]. La Organización Mundial de la Salud (OMS) estima que la exposición de las personas a zonas urbanas contaminadas produce la muerte de 7 millones de personas por año [13]. Su efecto dañino en el caso del ser humano proviene por la ingesta de agua contaminada con MPs, pero también en flora y fauna contaminada con metales y que sean parte de la cadena alimentaria del hombre [14].
Un estudio reciente en 26 sitios de muestreo en los ríos Arenal, Caño Negro, Temquisque, Pital, Toro, Tigre, Rincón, Sierpe, Torres, Poás, Segundo, Pacuare, Penshurt y Birrís, que se ubican en las regiones de San Carlos, Guanacaste, el Atlántico, el Gran Área Metropolitana y Osa, mostraron la presencia de cobre, cromo, níquel y mercurio. También se detectó plomo y arsénico aunque solamente en algunos de los sitios muestreados. En el caso del arsénico y el mercurio, su contenido se encontró en niveles de toxicidad probable [15].
Materiales y métodos
Selección de los puntos de muestreo
Se seleccionaron 26 puntos de muestreo ubicados en diferentes regiones del país: San Carlos, Guanacaste, el Atlántico, el Gran Área Metropolitana y Osa. Los sitios de muestreo se ubicaron en los ríos Arenal, Caño Negro, Tempisque, Pital, Toro, Tigre, Rincón, Sierpe, Torres, Poás, Segundo, Pacuare, Penshurt y Birrís.
Los sitios específicos (figura 2) se muestrearon por un espacio de 2 años en forma bimensual y los metales pesados (MPs) analizados fueron: plomo (Pb), cobre (Cu), cadmio (Cd), arsenico (As), cromo (Cr), niquel (Ni), y mercurio (Hg).
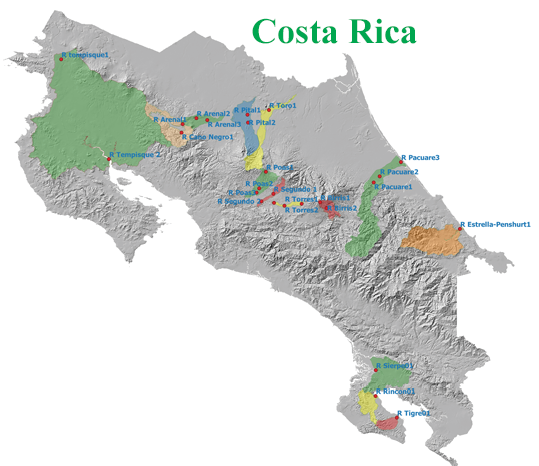
Figura 1. Sitios de muestreo en cada una de las cuencas, subcuencas o microcuencas del país.
Recolección de muestras de sedimentos
Las muestras de sedimentos se recolectaron durante las giras de recolección de las muestras de agua, durante el mismo período y frecuencia. El muestreo se realizó por duplicado de manera compuesta recolectando dos bolsas de sedimento superficial en las orillas del cauce, utilizando una espátula plástica y se guardaron en bolsas plásticas de polietileno herméticamente cerradas, se transportaron y almacenaron a temperatura ambiente.
Análisis de metales pesados en sedimentos
Las muestras se secaron en una incubadora Thermo Scientific a 45°C por 48 horas. Posteriormente se pulverizaron para su homogenización [16] y luego se realizó un tamizado de < 2 mm de diámetro [17] y se almacenaron para su posterior proceso de digestión.
La digestión se realizó utilizando el método SW-846 3051A de la U.S. EPA [18] y cada muestra de sedimento consistió en 0.5 g, aproximadamente. Se añadieron 9 mL de ácido nítrico (HNO3) y 1 mL de ácido clorhídrico (HCl) concentrados [17], a los tubos de digestión del horno microondas marca CEM modelo Mars 6. Este horno trabaja con una potencia de 1800 W a una temperatura de 175 ºC durante un intervalo de 5 min. Una vez terminada la digestión las muestras fueron trasvasadas y aforadas con una disolución ácida de HNO3 al 2% en balones de 50 mL utilizando un papel filtro para análisis cuantitativo marca Fisherbrand para su posterior medición.
Las disoluciones ácidas resultantes de las digestiones fueron analizadas por medio de espectrometría de absorción atómica, utilizando el espectrómetro de absorción atómica marca Perkin-Elmer modelo AAnalyst-800.
El Hg fue medido mediante la técnica de generación de hidruros y los metales restantes (As, Cd, Cr, Cu, Ni y Pb) fueron analizados por medio de horno de grafito para la determinación de concentraciones a nivel de trazas, lo anterior siguiendo las metodologías establecidas en el “Standard Methods for the Examination of Water and Wastewater” [19].
Validación de metodologías
La validación de la metodología se llevó a cabo a través del análisis de materiales de referencia certificados. Se evaluaron los parámetros de desempeño de veracidad, precisión, límite de detección y cuantificación, rango de trabajo y linealidad. Además, se utilizaron los criterios de aceptación establecidos en la norma de referencia.
Graficación de resultados
La graficación de los resultados se llevó a cabo utilizando el programa Statystical Package for Social Science (SPSS versión 25) y el tipo de gráfico fue el de cajas-bigotes.
El diagrama incluye la mediana, los percentiles 25 y 75 por lo que el rango de valores dentro de la caja representa la distribución del 50% de los valores. Los bigotes corresponden al valor más pequeño y el valor más grande reportados, siempre y cuando no se trate de valores atípicos. El uso del símbolo “°” y “*” son utilizados para mostrar valores atípicos y que, por lo tanto, son valores influyentes y que el programa SPSS los grafica por aparte.
Calidad de los sedimentos
Nuestro país cuenta con un reglamento para la evaluación y clasificación de la calidad de aguas superficiales, que clasifica la calidad de los ríos en 5 clases y para cada una de ellas también se indican los diferentes posibles usos. En el caso de las aguas, se cuenta con información para los metales pesados, pero para los sedimentos no existe información.
Lineamientos de calidad de sedimentos (SQG)
Existen varios lineamientos a nivel mundial reportados para valorar el contenido de MPs en sedimentos. Los SQG fueron desarrollados en Estados Unidos utilizando diferentes enfoques con el fin de proteger los ecosistemas bentónicos, la pesca y la calidad del agua superficial; además, su confiabilidad ha sido validada por medio de paneles con la participación de expertos, con el objetivo de llegar a consensos, tomando en consideración aspectos químicos en los sedimentos y datos de toxicidad en campo en estudios llevados a cabo a lo largo de los Estados Unidos [20]. A cada contaminante se le determinaron sus respectivas concentraciones de efecto umbral (TEC) y concentraciones de efecto probable (PEC). Valores por debajo del TEC corresponden a aquellos casos en lo que no se espera alguna toxicidad, por encima del valor PEC está asociado a una probable toxicidad, y entre ambos valores no se puede predecir si son tóxicos o no tóxicos por lo que se requieren mayores estudios particulares.
En esta investigación se decidió clasificar aquellos valores de contenido de MPs inferiores al TEC como “Toxicidad no probable” y se representó con el color verde; valores superiores al PEC se clasificó como “Toxicidad probable” y se asoció con el color rojo. En el caso de que los valores que se encuentren entre ambos valores, se clasificó como “Toxicidad indefinida” y se identificará con el color amarillo. Estas directrices para sedimentos evalúan el grado en que el contaminante podría afectar negativamente a organismos acuáticos y están diseñadas para ayudar en la interpretación de la calidad de los sedimentos (cuadro 1).
Cuadro 1. Niveles de permisibilidad de MPs para agua y sedimentos.
|
MP |
Agua (Clase I, mg/L) |
Sedimentos |
|
|
TEC (mg/Kg DW) |
PEC (mg/Kg DW) |
||
|
Pb |
<0.03 |
35.8 |
128 |
|
Cr |
<0.05 |
43.4 |
111 |
|
Cd |
<0.005 |
0.99 |
4.98 |
|
Hg |
<0.001 |
0.15 |
1.00 |
|
Cu |
<0.5 |
31.6 |
149 |
|
As |
<0.01 |
9.79 |
33.6 |
|
Ni |
<0.05 |
22.7 |
48.6 |
Nota: El Hg se tomó de la normativa Australiana [21].
Por debajo del TEC es verde (toxicidad no probable), entre TEC y PEC es amarillo (toxicidad indefinida), sobre PEC es rojo (toxicidad probable).
|
Color |
Clasificación |
|
Toxicidad no probable |
|
|
Toxicidad indefinida |
|
|
Toxicidad probable |
Resultados y discusión
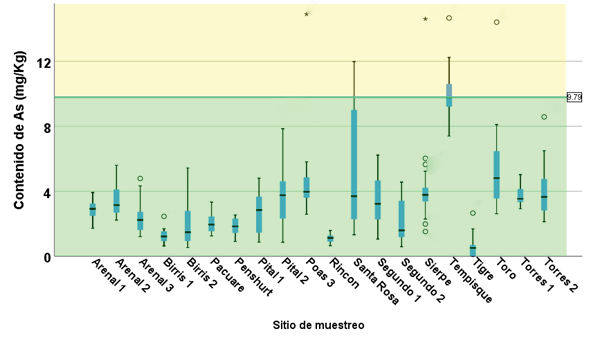
Figura 2. Contenido de As en sedimentos en los sitios muestreados.
La presencia de As en sedimentos se presentó en todos los puntos de muestreo (figura 2). En la mayoría de los casos se encuentre en el rango de “toxicidad no probable”.
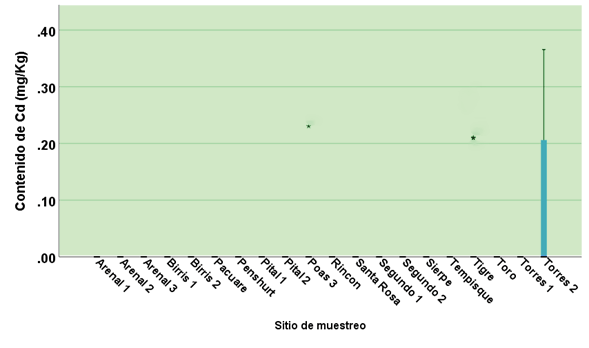
Figura 3. Contenido de Cd en sedimentos en los sitios muestreados.
En general, el contenido de Cd no se encontró en ninguno de los puntos de muestreo en agua; sin embargo, está presente consistentemente durante los muestreos efectuados en el sitio Torres 2. También se detectó su presencia en una ocasión en el sitio Poás 3 y en Tigre. Aún así, estos casos corresponden a el tipo de “toxicidad no probable” (figura 3).
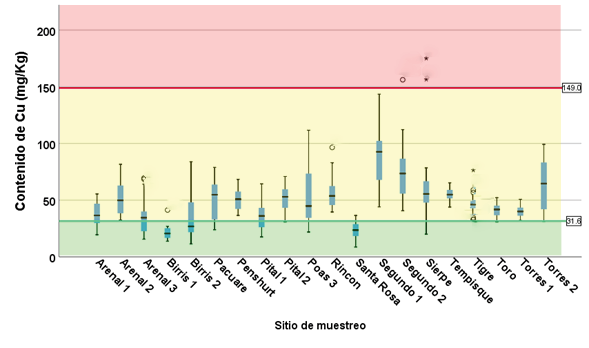
Figura 4. Contenido de Cu en sedimentos en los sitios muestreados.
La presencia de Cu estuvo presente en todos los sitios de muestreo, tal como se observa en la figura 4. En general, los contenidos corresponden a una “toxicidad indefinida”, excepto en algunos casos.
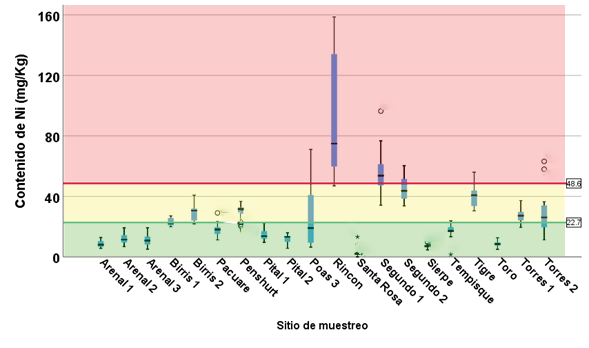
Figura 5. Contenido de Ni en sedimentos en los sitios muestreados.
La presencia de Ni se detectó en todos los puntos de muestreo. El contenido de Ni osciló entre el rango de “toxicidad no probable” y “toxicidad indefinida”, excepto en el caso de los sitios Rincón, Segundo 1, parte de los muestreos en Segundo 2 y algunos muestreos en el Torres 2, Tigre y Poas 3, cuyos valores corresponden a “toxicidad probable” (figura 5).
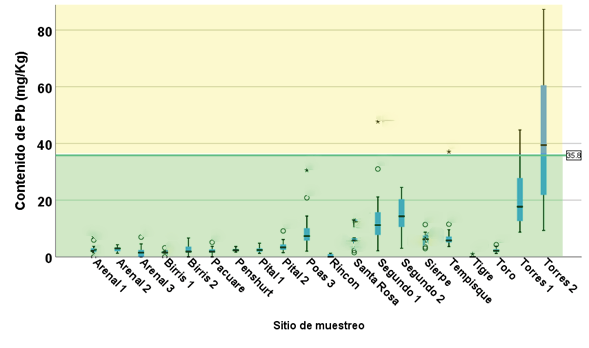
Figura 6. Contenido de Pb en sedimentos en los sitios muestreados.
El Pb estuvo presente en todos los sitios de muestreo, los datos se ubican en el rango de “toxicidad no probable”, excepto en algunos muestreos en el sitio Segundo 1, Tempisque, Torres 1 y 2, lo cuales corresponden al rango de “toxicidad indefinida” (figura 6).
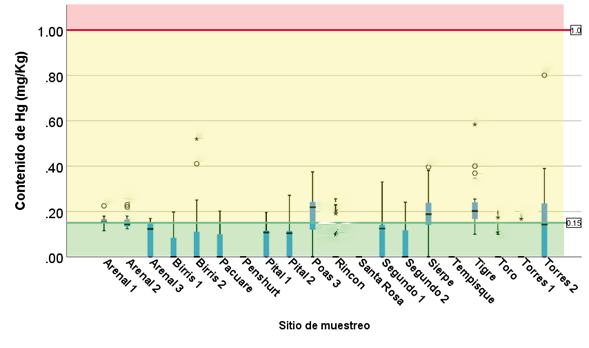
Figura 7. Contenido de Hg en sedimentos en los sitios muestreados.
La presencia de Hg se detectó en todos los sitios de muestreo, excepto Penshurt, Santa Rosa y Tempisque. En su mayoría se ubican en el rango de “toxicidad no probable” y en algunos puntos y fechas del muestreo, el rango correspondió a “toxicidad indefinida” (figura 7).
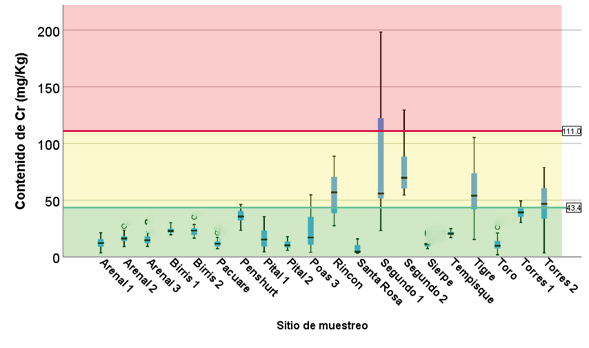
Figura 8. Contenido de Cr en sedimentos en los sitios muestreados.
El Cr se detectó en todos los sitios de muestreos y en la mayoría de los casos, se encuentran en el rango de “toxicidad no probable”, excepto el sitio Segundo 2, que se ubica en el rango de “toxicidad indefinida” y “toxicidad probable”. Además, los sitios Poas 3, Tigre, Torres 1 y 2 oscilan sus contenidos entre “toxicidad no probable” y “toxicidad indefinida”. El caso del sitio Segundo 1 muestra una oscilación en su contenido en los 3 rangos de toxicidad (figura 8).
Conclusiones
Todos los MPs, excepto el Cd, se encontraron en casi todos los ríos en concentraciones que, en algunos casos, se encuentran en el rango de “Toxicidad Probable”. Tal es el caso del As y el Ni en la cuenca del Tempisque y el Hg en la mayoría de los sitios muestreados.
En el caso de los sedimentos, el contenido de MPs es más frecuente y aparece en sitios que en el caso de su contenido en ríos, no aparecía. En la mayoría de los casos, el contenido está en el nivel de “Toxicidad No Probable” y en algunos, en el rango de “Toxicidad Indefinida”.
En general, se observó una variación en la concentración de los MP en los puntos de muestreo cuyos valores pueden oscilar desde 0 mg/L hasta valores altos. No se observó una variación pequeña con valores relativamente constantes a lo largo del tiempo para los puntos de muestreo con cada metal. Por el contrario, se reportan importantes variaciones en los resultados obtenidos para cada metal en cada sitio entre un muestreo y otro.
Agradecimientos
Los autores agradecen al Instituto Tecnológico de Costa Rica por su apoyo financiero y administrativo. Además, el Centro de Investigación en Protección Ambiental (CIPA) y el Centro de Investigación y Servicios Químicos y Microbiológicos (CEQIATEC), por su apoyo al proyecto.
Referencias
[1] G. Calvo-Brenes, Indices e indicadores sobre la calidad del agua, First. Cartago, Costa Rica: Editorial Tecnológica, 2018.
[2] H. Ali, E. Khan, and I. Ilahi, “Environmental Chemistry and Ecotoxicology of Hazardous Heavy Metals: Environmental Persistence, Toxicity, and Bioaccumulation,” Journal of Chemistry, vol. 2019, pp. 1–14, Mar. 2019, doi: 10.1155/2019/6730305.
[3] A. Mora, M. García-Gamboa, M. S. Sánchez-Luna, L. Gloria-García, P. Cervantes-Avilés, and J. Mahlknecht, “A review of the current environmental status and human health implications of one of the most polluted rivers of Mexico: The Atoyac River, Puebla,” Science of The Total Environment, vol. 782, p. 146788, Aug. 2021, doi: 10.1016/j.scitotenv.2021.146788.
[4] L. T. Popoola, S. A. Adebanjo, and B. K. Adeoye, “Assessment of atmospheric particulate matter and heavy metals: a critical review,” Int. J. Environ. Sci. Technol., vol. 15, no. 5, pp. 935–948, May 2018, doi: 10.1007/s13762-017-1454-4.
[5] T. Salazar-Rojas, F. R. Cejudo-Ruiz, and G. Calvo-Brenes, “Assessing magnetic properties of biomonitors and road dust as a screening method for air pollution monitoring,” Chemosphere, vol. 310, p. 136795, Jan. 2023, doi: 10.1016/j.chemosphere.2022.136795.
[6] G. Calvo-Brenes, Ríos: Fundamentos sobre su calidad y su relación con el entorno socioambiental, First. Cartago, Costa Rica: Editorial Tecnológica, 2015.
[7] X. Leng et al., “Prediction of size-fractionated airborne particle-bound metals using MLR, BP-ANN and SVM analyses,” Chemosphere, vol. 180, pp. 513–522, Aug. 2017, doi: 10.1016/j.chemosphere.2017.04.015.
[8] H. Li, J. Wang, Q. Wang, C. Tian, X. Qian, and X. Leng, “Magnetic Properties as a Proxy for Predicting Fine-Particle-Bound Heavy Metals in a Support Vector Machine Approach,” Environ. Sci. Technol., vol. 51, no. 12, pp. 6927–6935, Jun. 2017, doi: 10.1021/acs.est.7b00729.
[9] Y. Hong et al., “Progress in the Research of the Toxicity Effect Mechanisms of Heavy Metals on Freshwater Organisms and Their Water Quality Criteria in China,” Journal of Chemistry, vol. 2020, pp. 1–12, May 2020, doi: 10.1155/2020/9010348.
[10] T. Salazar-Rojas, F. R. Cejudo-Ruiz, and G. Calvo-Brenes, “Comparison between machine linear regression (MLR) and support vector machine (SVM) as model generators for heavy metal assessment captured in biomonitors and road dust,” Environmental Pollution, vol. 314, p. 120227, Dec. 2022, doi: 10.1016/j.envpol.2022.120227.
[11] S. Stankovic, P. Kalaba, and A. R. Stankovic, “Biota as toxic metal indicators,” Environ Chem Lett, vol. 12, no. 1, pp. 63–84, Mar. 2014, doi: 10.1007/s10311-013-0430-6.
[12] U. C. Nkwunonwo, P. O. Odika, and N. I. Onyia, “A Review of the Health Implications of Heavy Metals in Food Chain in Nigeria,” The Scientific World Journal, vol. 2020, pp. 1–11, Apr. 2020, doi: 10.1155/2020/6594109.
[13] WHO, “What are the WHO Air quality guidelines?: Improving health by reducing air pollution.” 2021. [Online]. Available: https://www.who.int/news-room/feature-stories/detail/what-are-the-who-air-quality-guidelines
[14] I. W. Delince, “Riesgo agroambiental por metales pesados en suelos con Cultivares de Oryza sativa L y Solanum tuberosum L Heavy metals agroenvironmental risk in soils with cultivate Oryza sativa L. and Solanum tuberosum L,” vol. 24, no. 1, p. 7, 2015.
[15] N. Quirós-Bustos, D. Robles-Chaves, A. Caballero-Chavarría, and G. Calvo-Brenes, “Contenido de metales pesados en varios ríos de Costa Rica,” TM, Mar. 2022, doi: 10.18845/tm.v35i2.5532.
[16] C. Montalvo et al., “Metal Contents in Sediments (Cd, Cu, Mg, Fe, Mn) as Indicators of Pollution of Palizada River, Mexico,” Environment and Pollution, vol. 3, no. 4, pp. 89–98, 2014, doi: 10.5539/ep.v3n4p89.
[17] N. P. Castro-González, F. Calderón-Sánchez, R. Moreno-Rojas, J. V. Tamariz-Flores, and E. Reyes-Cervantes, “Heavy metals pollution level in wastewater and soils in the alto balsas sub-basin in tlaxcala and puebla, Mexico,” Revista Internacional de Contaminacion Ambiental, vol. 35, no. 2, pp. 335–348, 2019, doi: 10.20937/RICA.2019.35.02.06.
[18] EPA, “U.S. EPA Method 3051A: Microwave Assisted Acid Digestion of Sediments, Sludges, and Oils.” 2007.
[19] APHA, AWWA and AEF, Standard Methods for the Examination of Water and Wastewater, 23rd ed. WA, DC, USA, 2017.
[20] D. D. MacDonald, C. G. Ingersoll, and T. A. Berger, “Development and Evaluation of Consensus-Based Sediment Quality Guidelines for Freshwater Ecosystems,” Archives of Environmental Contamination and Toxicology, vol. 39, no. 1, pp. 20–31, Jun. 2000, doi: 10.1007/s002440010075.
[21] DEC, “Assessment levels for soil, sediment and water.” 2010. [Online]. Available: https://www.der.wa.gov.au/images/documents/your-environment/contaminated-sites/guidelines/2009641_-_assessment_levels_for_soil_sediment_and_water_-_web.pdf
Declaración sobre uso de Inteligencia Artificial (IA)
Los autores aquí firmantes declaramos que no se utilizó ninguna herramienta de IA para la conceptualización, traducción o redacción de este artículo.
1 Centro de Investigación en Protección Ambiental, Escuela de Química, Instituto Tecnológico de Costa Rica. Costa Rica.
 calvogmo@yahoo.com
calvogmo@yahoo.com https://orcid.org/0000-0002-7021-3509
https://orcid.org/0000-0002-7021-35092 Centro de Investigación y de Servicios Químicos y Microbiológicos, Escuela de Química, Instituto Tecnológico de Costa Rica. Costa Rica.
 nquiros@itcr.ac.cr
nquiros@itcr.ac.cr https://orcid.org/0000-0002-2064-4300
https://orcid.org/0000-0002-2064-43003 Centro de Investigación y de Servicios Químicos y Microbiológicos, Escuela de Química, Instituto Tecnológico de Costa Rica. Costa Rica.
 drobles@itcr.ac.cr
drobles@itcr.ac.cr https://orcid.org/0000-0002-8173-9610
https://orcid.org/0000-0002-8173-96104 Centro de Investigación y de Servicios Químicos y Microbiológicos, Escuela de Química, Instituto Tecnológico de Costa Rica. Costa Rica.
 acaballero@itcr.ac.cr
acaballero@itcr.ac.cr https://orcid.org/0000-0002-5584-8821
https://orcid.org/0000-0002-5584-8821