Efectos del cromo en el consumo de oxígeno y excreción de amonio en tilapia (Oreochromis niloticus) de agua dulce
Effects of chromium on oxygen consumption and ammonium excretion in freshwater tilapia (Oreochromis niloticus)
Bessie Evelyn Oliva-Hernández1, Edison Barbieri2, Juan Francisco Pérez-Sabino3, Rooel Campos-Rodríguez4
Fecha de recepción: 6 de septiembre, 2023
Fecha de aprobación: 25 de enero, 2024
Oliva-Hernández, B. E; Barbieri, E; Pérez-Sabino, J. F; Campos-Rodríguez, R. Efectos del cromo en el consumo de oxígeno y excreción de amonio en tilapia (Oreochromis niloticus) de agua dulce. Tecnología en Marcha. Vol. 37, No 4. Octubre-Diciembre, 2024. Pág. 48-60. https://doi.org/10.18845/tm.v37i4.6883
https://doi.org/10.18845/tm.v37i4.6883
Palabras clave
Cromo; tilapia; biomarcadores; consumo de oxígeno; excreción de amonio; agua dulce.
Resumen
La contaminación por cromo (VI) en cuerpos de agua ha ocurrido por la descarga de aguas residuales industriales, que pueden provenir de industria de curtiembre, minera, o galvanoplastía causando serios problemas a la fauna acuática, principalmente en peces, los cuales pueden sufrir alteraciones histopatológicas en branquias, riñones e intestinos. Este estudio tuvo como objetivo evaluar el efecto de diferentes concentraciones de cromo (0.0 (control), 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L) en el consumo de oxígeno y excreción de amonio en tilapia del Nilo (Oreochromis niloticus) de agua dulce, ya que esta especie tiene un interés alimenticio y económico en diferentes comunidades del país. Este estudio se realizó utilizando 42 peces juveniles de tilapia de un peso entre 1.0 y 3.0 gramos, los cuales fueron colocados en seis peceras con diferentes concentraciones de cromo. Después de 4 horas de exposición, se trasladaron a un sistema con recirculación de agua y en respirómetros individuales. Para cada concentración se utilizó un grupo de 7 peces, a los que se determinó el consumo de oxígeno y la excreción de amoníaco en cada respirómetro. Los resultados mostraron que al aumentar la concentración de cromo en el agua (p < 0.05), disminuyó el consumo de oxígeno hasta un 62.8% de 0.4168 mL/g/L en el grupo control a 0.1550 mL/g/h en la concentración de 30.0 mg/L de cromo. La excreción de amonio fue mayor (p < 0.05), después de haber sido expuestos los peces a una concentración de 1 mg/L de Cr6+.
Keywords
Chromium; tilapia; biomarkers; oxygen consumption; ammonium excretion; freshwater.
Abstract
Chromium VI contamination in bodies of water has occurred due to the discharge of industrial wastewater, which may come from the tanning, mining, or electroplating industry, causing serious problems for aquatic fauna, mainly fish, which may suffer histopathological alterations in gills, kidneys and intestines. This study aimed to evaluate the effect of different chromium concentrations (0.0 (control), 1.0, 5.0, 10.0, 15.0 and 30.0 mg/L) on oxygen consumption and ammonium excretion in freshwater tilapia (Oreochromis niloticus), since this species has a nutritional and economic interest in different communities of the country. This study was carried out using 42 juvenile tilapia fish weighing between 1 and 3 grams, which were placed in six tanks with different chromium concentrations. After 4 hours of exposure, they were transferred to a system with recirculating water and individual respirometers. For each concentration, a battery of 7 fish was used, to which the oxygen consumption and ammonia excretion of each respirometer were determined. The results showed that by increasing the concentration of chromium in the water (p < 0.05), oxygen consumption decreased up to 62.8% from
0.4168 mL/g/L in the control group to 0.1550 mL/g/h in the concentration of 30.0 mg/L of chromium (VI). The ammonium excretion showed the highest concentration (p < 0.05), after the fish were exósed to having been exposed to a concentration of 1 mg/L of Cr6+.
Introducción
En la actualidad, la contaminación del agua representa una grave amenaza ambiental, lo que provoca un impacto en la fauna, la flora y en la salud humana [1]. Los metales pesados son potencialmente tóxicos y se distribuyen a través de diferentes vías [2], ingresando a los organismos acuáticos al llegar a los cuerpos de agua provenientes de la erosión del suelo, escorrentías urbanas, así como de desechos de curtidurías, productos farmacéuticos, de teñido, de minería, cerámica, galvanoplastía de acabado de metales, así como de la descarga de aguas residuales, industrias textiles y de impresión y muchas otras [3], debido a la mala gestión en la eliminación de desechos. Estas actividades han contribuido a aumentar la contaminación ambiental por metales traza tóxicos [4].
Los metales traza son elementos que normalmente se encuentran en niveles muy bajos en el medio ambiente [5]. En los ecosistemas, algunos tienen funciones esenciales para la supervivencia de los organismos acuáticos [5] [6], pero en altas concentraciones pueden inducir cambios genéticos, bioquímicos y fisiológicos en las especies de estos ecosistemas comprometiendo su adaptabilidad y supervivencia [7].
El cromo es un metal muy estable, que se presenta en diferentes formas en la naturaleza, como formas divalentes (Cr(II)), trivalentes (Cr(III)), y hexavalentes (Cr(VI)) [8], encontrándose en el agua en estado de oxidación Cr(III) o Cr(VI). El Cr(VI) es la forma más tóxica y presenta severos impactos en los ecosistemas acuáticos [9], es carcinogénico para los animales y humanos [8] [10], pudiendo causar daño en branquias, hígado y riñones provocando estrés oxidativo, daño en el ADN y efectos hepatotóxicos y nefrotóxicos en los peces [12] debido a que el cromo puede difundirse fácilmente a través de las branquias para concentrarse en varios tejidos y provocar una acción tóxica Wepener et al [13]. La contaminación por cromo de fuentes industriales puede afectar la vida acuática, el ecosistema y la salud humana, directamente o a través de la cadena alimentaria. Yilmaz et al [10] realizó un estudio con tilapia (Oreochomis aureus) expuesta a cromo hexavalente en cinco concentraciones diferentes (10, 15, 20, 25 y 30 mg/L). Estas concentraciones son consideradas subletales para los juveniles de tilapia representativas de la exposición ambiental, reportando que el cromo se concentró mayormente en branquias, piel y en tejidos musculares en menor cantidad, y que los peces perdieron progresivamente su capacidad de responder a este aumento durante el periodo de la exposición.
Por otra parte, se considera a los peces como excelentes bioindicadores, y son ampliamente utilizados para describir características naturales de sistemas acuáticos y para evaluar alteraciones en el ambiente [4] [14] [15] [16]. En un estudio realizado por Oliveira et al en 2012 [17] evaluaron los efectos metabólicos causados por el uso de nanopartículas de óxido de cobre utilizando la técnica de respirometría cerrada y la excreción de amoníaco como biomarcador del metabolismo (efectos fisiológicos) sobre Danio rerio (pez cebra). En el estudio, los peces se expusieron a concentraciones de 0, 50, 100 y 200 µg/L de nanopartículas de óxido de cobre, presentando una disminución en la excreción específica de amoníaco en un 34 % y un 83 % cuando los peces se exponen a concentraciones de 100 y 200 µg/L, respectivamente, por 24 horas en comparación con el control.
En otro estudio realizado en 2022 [18] sobre la exposición de peces Danio rerio (pez cebra) a nanopartículas de plata, se encontró que las nanopartículas de plata (AgNP) microsintetizadas provocaron un aumento significativo (p < 0.05) del consumo de oxígeno a la concentración más alta estudiada (75 µg/L) y un aumento en la excreción de amoníaco a las concentraciones más bajas, seguido de una reducción a las concentraciones más altas. Los autores encontraron hallazgos similares a estudios realizados con AgNO3 en los que aumentó el consumo de oxígeno a bajas concentraciones de exposición, seguido de una disminución en las altas concentraciones probadas, y al mismo tiempo perjudicó la excreción de amoníaco en todas las concentraciones probadas lo que indica que la exposición indujo a cambios fisiológicos.
En un estudio realizado en Lambari Deuterodon iguape (Eigenmann 1907) que es una especie nativa de Brasil, Barbosa et al. En 2021 [15] expusieron los peces a una concentración de
0.1 µg/L de propiconazol, observandose una reducción en la excrección de amoníaco del 68.7 % con una diferencia significativa (p < 0.05) con relación al control. Para el consumo específico de oxígeno, se presentó una diferencia estadísticamente significativa aumentando su consumo a una concentración de 0.01 µg/L y luego disminuyendo a medida que aumenta la concentración de propiconazol.
La tilapia del Nilo (O niloticus) (Linnaeus, 1758) [19], es producida comúnmente para el consumo humano en todo el mundo [20], siendo el cultivo de tilapia el segundo más importante dentro del cultivo de peces [21]. China es el mayor productor de tilapia del Nilo cultivada con una producción de 806 000 toneladas en 2003. Las especies de Oreochromis son peces comúnmente utilizados en estudios de ecotoxicología, ya que se reproducen fácilmente, son resistentes a enfermedades y no presentan problemas graves de alimentación [22].
La tilapia del Nilo (O. niloticus) es una especie altamente consumida en Guatemala y en otros países. Esta se puede utilizar como un excelente indicador para evaluar la calidad del agua y la contaminación por metales pesados en ambientes acuáticos [18]. La importancia del estudio de cromo en tilapia es porque el cromo hexavalente se bioacumula y la ingesta de pescado contaminado pone en riesgo de contraer cáncer a las personas que lo consumen [23]. Ghosh y Saha [24] determinaron la concentración letal LC50 de cromo hexavalente en tilapia del Nilo (O. niloticus) reportando valores de LC50 a 121.06, 108.30, 99.31 y 93.49 mg/L de cromo hexavalente para exposiciones por 24, 48, 72 y 96 horas respectivamente, concluyendo que con el aumento de la concentración del metal, la respuesta de la mortalidad de los peces aumentó gradualmente y que es directamente proporcional a la concentración de cromo hexavalente.
El metabolismo es un proceso fisiológico, que refleja el gasto energético que tienen los organismos vivos, que en animales heterótrofos se mide por las exigencias alimentarias [25]. La tasa metabólica que en los peces se refiere generalmente a la tasa de respiración, se mide como la tasa de consumo de oxígeno [26] [27], y en un entorno de laboratorio, el consumo de oxígeno se mide en un respirómetro, como la pendiente de la disminución del contenido de oxígeno en el agua a lo largo del tiempo [28]. Durante la excreción los peces generan productos de desecho que consisten en dióxido de carbono y amoníaco, los cuales se expulsan a través de las branquias por difusión [29] [30]. Estas herramientas fisiológicas son valiosas y se utilizan para realizar predicciones de cómo responden las poblaciones de peces cuando se enfrentan a condiciones nuevas [25] [31] [32] [33] ayudando a entender el metabolismo de rutina y la condición física de los peces [28].
La tilapia del Nilo es un pez teleósteo, de la familia Cichlidae, amoniotélico para el cual gran parte del amoníaco producido proviene del grupo de aminoácidos α-amino que se catabolizan, al que afectan los factores del medio ambiente y los factores bióticos en la excreción de nitrógeno amoniacal, el cual es el mayor producto final del catabolismo representado entre el 70 y 95% del nitrógeno total que excretan a través del epitelio branquial [29] Kaushik [34].
Por tal motivo, el objetivo de este estudio fue investigar si se afecta el metabolismo de la tilapia del Nilo (O. niloticus) por exposición a diferentes concentraciones de cromo hexavalente en el agua, evaluando dos biomarcadores fisiológicos, el consumo de oxígeno y la excreción de amoníaco, al ser la tilapia una especie que se encuentra y se cultiva para el consumo, en cuerpos de agua en Guatemala, que reciben aguas residuales de industria de curtiembre y otros orígenes.
Metodología
El efecto del cromo sobre el consumo de oxígeno y excreción de amonio en tilapia (Oreocrhomis niloticus) se evaluó mediante la exposición de peces juveniles en agua con diferentes concentraciones de cromo hexavalente, por un periodo de cuatro horas. Luego, los peces se colocaron por una hora en respirómetros de 500 mL (frascos de vidrio) con flujo continuo de agua en el interior de peceras. Posteriormente, con el pez en su interior, se tapó cada respirómetro y se midieron las concentraciones de oxígeno y amonio, antes de taparse y una hora después de taparse el respirómetro, para evaluar el oxígeno consumido y el amoníaco excretado por el pez luego de haberse expuesto al agua contaminada con cromo.
Exposición de peces a cromo VI
La exposición a cromo de los peces se realizó de manera según [35] y [36]. Un total de 42 peces juveniles cultivados de 1.00 a 3.00 g fueron utilizados para el experimento, los cuales previo al mismo, se dejaron de alimentar por un periodo de 24 horas. Se colocaron grupos de 7 peces en peceras de 5.00 L que contenían diferentes concentraciones de cromo (K2Cr2O7). Los peces de cada grupo fueron expuestos separadamente a una de las siguientes concentraciones de cromo: 0.0 (control), 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L, por un periodo de 4 horas. La temperatura del agua dentro de las peceras se mantuvo a 22 oC.
Determinación de oxígeno
La determinación de oxígeno fue realizada según [37]. Después de corrido el experimento, los peces se colocaron en respirómetros individualmente, los cuales se colocaron en un tanque de 30 L con circulación continua de agua. Se trasladó y mantuvo cada pez de cada grupo en el respirómetro sin tapar, con circulación continua de agua por 60 minutos, para atenuar el estrés del manejo. A continuación, se suspendió la circulación de agua y el respirómetro se cerró, para que el pez consumiera el oxígeno presente en el agua por un periodo de una hora. Los respirómetros fueron protegidos al colocarlos en un tanque opaco para aislar a los peces del posible movimiento en el laboratorio y no afectarlos por estrés.
La diferencia entre las concentraciones de oxígeno determinadas al inicio y al final del confinamiento se utilizó para calcular el consumo de este durante el periodo en que permanece en el respirómetro cerrado, luego de la exposición al agua contaminada con cromo (VI). El oxígeno disuelto se determinó utilizando el método de Winkler modificado. Se tomaron las muestras de agua en botellas para DBO de 60 mL de color ámbar. Se hace un sifón con una manguera de hule, se colocó un extremo en el respirómetro que tiene el pez y el otro extremo de la manguera en el fondo de la botella para DBO; para no generar turbulencia y entrada de oxígeno, se debe escurrir lentamente. Antes de tomar la muestra se dejó correr unos 2 mL de agua para asegurar que la muestra de agua fuera del respirómetro. La botella se lava 2 veces con el agua de la muestra, luego se tapa sin dejar burbujas. Todos los reactivos utilizados son grado reactivo. Después se agregaron 0.500 mL de una disolución de cloruro de manganeso (II) (MnSO4.H2O) 2M, 0.500 mL de yoduro alcalino (KI 3.6 M y KOH 5.4 M preparado con 60 g de KI y 30 g de KOH, disueltos separadamente en la menor cantidad de agua, y luego mezclados y diluidos a 100 mL) y se tapó sin dejar burbujas de aire. Se agitó el frasco y se dejó reposar por 30 minutos. Pasado este tiempo, se agregó 1 mL de ácido sulfúrico (H2SO4) (preparado 1:1 en agua destilada) y se agitó. Luego en un matraz erlenmeyer de 150 mL se tomaron 40 mL de muestra y se titularon con tiosulfato de sodio (Na2S2O3) 0.02 N M hasta una coloración amarillo pajizo. Posteriormente se agregó 1 mL de disolución de almidón (1 g/100 mL) y se tituló hasta la desaparición del color azul. El volumen de la titulación sirvió para determinar el oxígeno presente y el consumo de oxígeno en mL/L restando el oxígeno inicial menos el presente en la muestra final. Finalmente se calcula el consumo específico en mL/L/g/h.
Determinación de nitrógeno de amonio
La excreción de amonio se determinó según [38] [39]. Las muestras para la determinación de nitrógeno de amonio se colectaron después de haber tomado las muestras de oxígeno en cada respirómetro, por medio de un sifón directamente hacia el frasco de muestreo. Se midieron 25 mL de muestra en un Erlenmeyer y se adicionó 1 mL de reactivo de Nessler; después de 10 minutos se hizo la lectura en un espectrofotómetro a 410 nm. El reactivo de Nessler se preparó disolviendo 25 g yoduro de mercurio (HgI2) y 20 g de yoduro de potasio (KI) en 500 mL de agua destilada libre de amonio; a esta disolución se le agrega una disolución preparada con 100 g de hidróxido de sodio (NaOH) en 500 mL de agua destilada libre de amonio. Esta disolución puede conservarse en un frasco de vidrio en refrigeración, por un año. El cálculo de resultados se hizo a partir de una curva patrón de nitrógeno de amonio, que se prepara a partir de la disolución de 3.819 g de cloruro de amonio (NH4Cl) en 1000 mL de agua destilada (1 mL = 1.0 mg N) para la disolución madre. A partir de esta se prepara la curva patrón con concentraciones de 0.10; 0.20; 0.30; 0.40; 0.50; 0.60; 0.70; 0.80 y 0.90 mg/L tomando de 1.00 a 9.00 mL de la disolución madre y diluyendo a 100 mL cada una de las disoluciones.
Análisis estadístico
Las medias de consumo específico de oxígeno y excreción de amoníaco de los peces se sometieron a la prueba de normalidad de Shapiro-Wilk, con un 95 % de confiabilidad, y a la prueba de homocedasticidad de Levene. Posteriormente, se aplicó la prueba de ANOVA para comparar los tratamientos y la prueba de comparaciones múltiples de Tukey (p < 0.05).
Resultados y duscusión
Tasa metabólica (consumo de oxígeno)
Se midió el consumo específico de oxígeno de juveniles de tilapia del Nilo (Oreochromis niloticus) que fueron aclimatados en peceras a una temperatura de 22 ºC para 5 diferentes concentraciones de cromo (VI). Los valores obtenidos representan una disminución en el consumo de oxígeno de 6.62, 6.41, 40.60, 40.14 y 62.81 % de la medición del grupo control. El cuadro 1 muestra la determinación del consumo de oxígeno en mL/g/h de tilapia del Nilo (Orechromis niloticus) expuesta a concentraciones de cromo (VI) de 0.0 (control), 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L, en respirómetros a una temperatura de 22 oC por un tiempo de 4 horas.
Cuadro 1. Media del consumo de oxígeno específico (mLO2/g/L) de los grupos en 4 horas de exposición a diferentes concentraciones de Cr6+ (n = 7, para cada concentración)
|
Parámetro |
Control |
1.0 mg/L |
5.0 mg/L |
10.0 mg/L |
15.0 mg/L |
30.0 mg/L |
|
Media |
0.4168 |
0.3892 |
0.3901 |
0.2476 |
0.2495 |
0.1550 |
|
Dest |
0.0543 |
0.0726 |
0.0419 |
0.0462 |
0.0769 |
0.0435 |
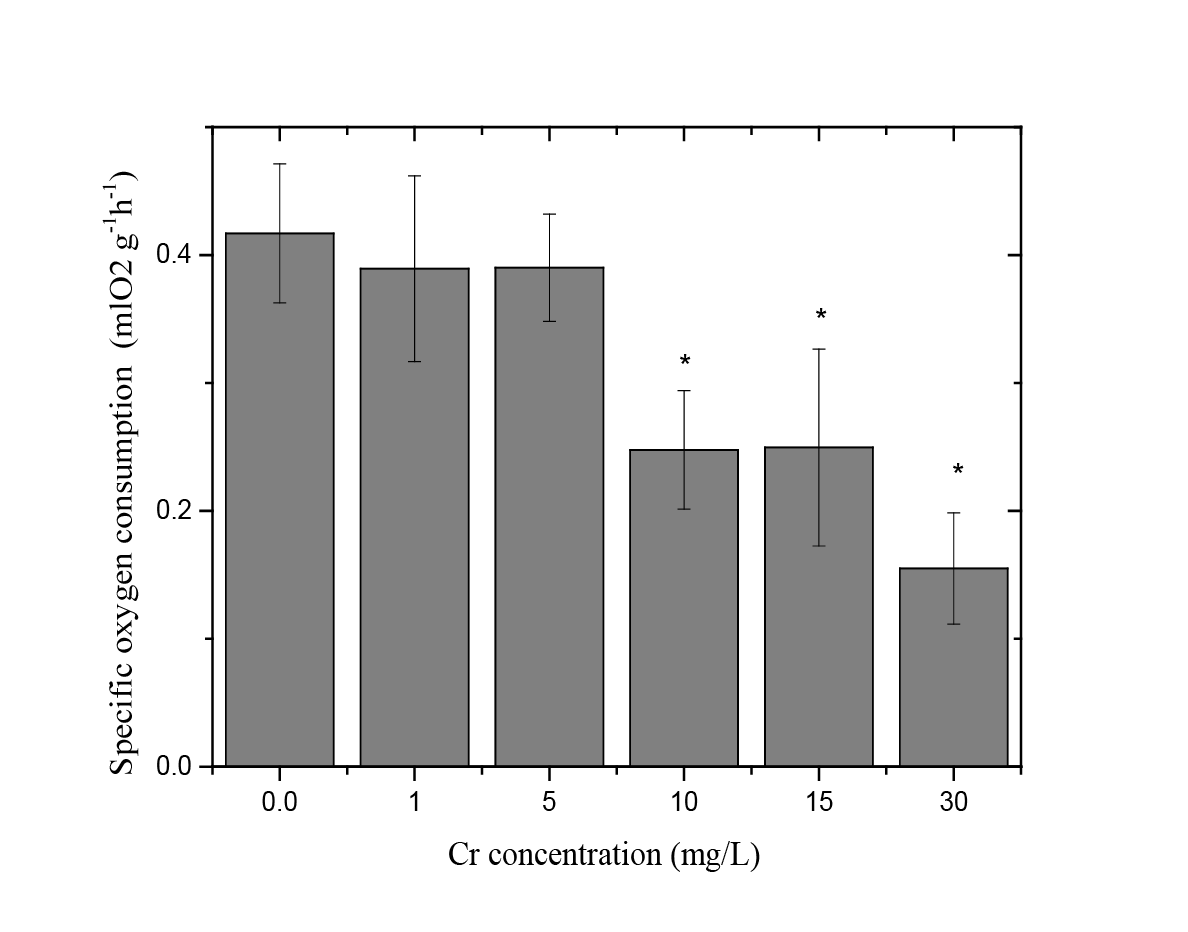
Figura 1. Consumo específico de oxígeno en mLO2/g/h en juveniles de tilapia del Nilo (Oreochromis niloticus) expuestos a diferentes concentraciones de cromo (VI). Las columnas representan los promedios (n = 7) y las barras la respectiva desviación estándar. *Diferencia estadística en comparación con el control
En la figura 1 se puede observar que los individuos de tilapia expuestos a cromo (VI) mostraron una disminución significativa en la tasa metabólica en comparación con el grupo control en concentraciones iguales o superiores a 10 mg/L. Se registró una reducción del 62.81 % de la tasa metabólica para la concentración más alta estudiada (30 mg/L), en comparación con el grupo control. Los valores de tasa metabólica para los peces expuestos a concentraciones de 10, 15 y 30 mg/L de cromo son estadísticamente diferentes, comparados con el grupo control (Figura 1), al realizarse la prueba de ANOVA de una vía (P<0.05) y de Tukey (P<0.05). Para las concentraciones de 1 y 5 mg/L hay un leve descenso en la tasa metabólica, pero no es significativamente diferente.
Los peces expuestos a dosis de cromo (VI) mostraron una reducción en la tasa metabólica. En estudios realizados por Yilmaz et al [10] con concentraciones de 30 mg/L, tilapias de la especie Oreochromis aureus presentaron trastorno respiratorio bastante alto dañando las branquias que son los órganos respiratorios y osmoreguladores vitales, reduciendo el área de superficie respiratoria, lo que también se refleja en este estudio al disminuir considerablemente su tasa metabólica con una diferencia significativa (ρ < 0.05). Vutukuru [11] obtuvo resultados que mostraron que la actividad respiratoria normal de peces de la especie Labero rohita expuestos a Cr(VI) se vio significativamente afectada y los peces presentaron una depresión en la tasa metabólica, reflejando el alcance de los efectos tóxicos del cromo (VI) a una concentración de 39.40 mg/L.
Resultados similares fueron obtenidos en un estudio realizado por Elsaeidy el al [40], al exponer tilapia (O. niloticus) a concentraciones de 15.00 y 30.00 mg/L de Cr6+ como agente generador de estrés provocando alteraciones y disfunción en su capacidad de sobrevivencia. En otro estudio realizado por Yu el al [41] al exponer peces a cromo hexavalente, el cual tiene una capacidad de oxidación fuerte y es 100 veces más tóxico que el Cr3+ provocó efectos negativos reflejándose en la dificultad en los procesos metabólicos, como la respiración celular. Esto se comprueba en este estudio al observarse una disminución en la reducción metabólica.
Excreción de amoníaco
Se midió la excreción de amoníaco de tilapia del Nilo (Oreochromis niloticus) de peces que fueron expuestos en peceras con cromo (VI) (cuadro 2), en concentraciones de 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L. Los resultados obtenidos para la excreción de amoniaco con diferentes concentraciones de Cr6+ mostraron un aumento en la excreción cuando los especímenes se expusieron a 1.0 mg/L de cromo, en comparación con el grupo control. El aumento en la excreción de amoníaco fue de 3.56 veces mayor que el grupo control (cuadro 2). Para las concentraciones de 5.0, 10.0 y 15.0 mg/L de cromo (VI) la diferencia en la excreción de amoníaco fue de 2.47, 1.79 y 1.69 veces mayor, respectivamente; mientras que para la exposición a 30 mg/L fue de 1.51 veces mayor comparada con el grupo control.
En el cuadro 2 se puede observar la determinación de la excreción de amoníaco en mg/g/h en tilapia del Nilo (O. niloticus) expuesta a diferentes concentraciones de cromo (VI) de 0.0 (control), 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L, en respirómetros a una temperatura de 22 oC por un tiempo de 4 horas.
Cuadro 2. Media de la excreción de amoníaco (mg/g/h) de los individuos de tilapia en 4 horas de exposición a diferentes concentraciones de Cr6+ (n = 7, para cada concentración).
|
Parámetro |
Control |
1.0 mg/L |
5.0 mg/L |
10.0 mg/L |
15.0 mg/L |
30.0 mg/L |
|
Media |
0.0140 |
0.0499 |
0.0346 |
0.0250 |
0.0237 |
0.0212 |
|
Dest |
0.0021 |
0.0248 |
0.0198 |
0.0113 |
0.0089 |
0.0163 |
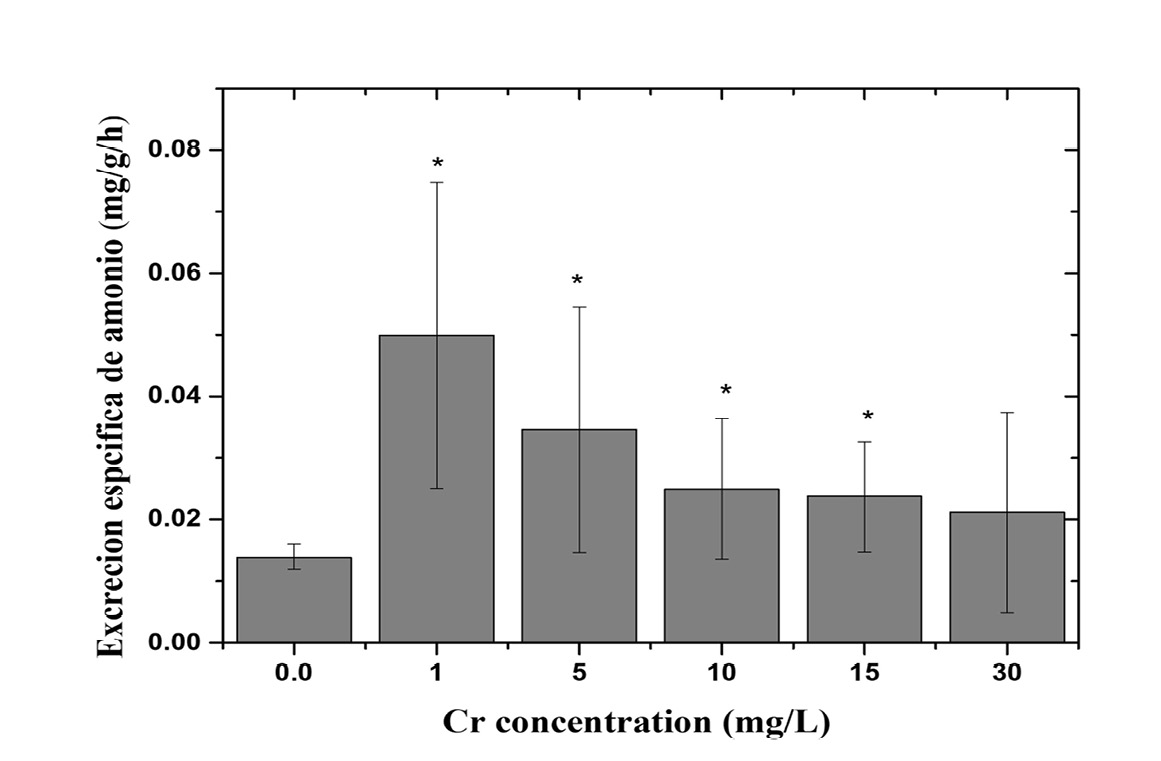
Figura 2. Excreción de amoníaco en mg/g/h en tilapia del Nilo (O. niloticus) a diferentes concentraciones de cromo (VI). Las columnas representan los promedios (n = 7) y las barras la respectiva desviación estándar. *Diferencia estadística en comparación con el control.
Las tasas de excreción de amoníaco presentan un aumento con una diferencia significativa para las concentraciones de 1.0, 5.0, 10.0 y 15.0 mg/L de cromo (VI), al realizar la prueba de ANOVA de una vía (P<0.05) y de Tukey (P<0.05), exhibiendo una propensión a disminuir la excreción de amoníaco con el aumento en la concentración del cromo, hasta la concentración de 30 mg/L que ya no presenta una diferencia significativa con el grupo control (figura 2).
En condiciones ambientales adversas, en las que se reduce la excreción de amoníaco, algunos peces pueden reducir la tasa de producción de amoníaco a partir del catabolismo de aminoácidos para ralentizar la acumulación interna de amoniaco (Yuen, 2010). Esto se comprueba en este estudio, en el cual se ve disminuida la excreción de amoníaco, para ralentizar el metabolismo. La excreción de amoníaco ocurre principalmente a través de las branquias de los peces [29], pero la exposición al cromo en animales acuáticos afecta el metabolismo y provoca hiperplasia branquial [42], observándose en este estudio que a mayor concentración de cromo hexavalente, la excreción de amonio disminuye.
Lorenzo-Márquez (2016) indica que la especie Oreochromis niloticus se alimenta de fauna bentónica, que se encuentra en los sedimentos [43], en donde se acumulan fracciones de metales pesados como cromo, que unidas a carbonatos se consideran biodisponibles y bioacumulables en sus tejidos [44] principalmente en branquias, intestinos [45], hígado y riñones [46], [47], y muy baja tendencia a la acumulación en los tejidos musculares [48]. Esto puede causar citotoxicidad y un impacto perjudicial o anormal en el comportamiento de los peces [46], como hipertrofía y paraplegia del epitelio branquial, natación desigual y suspensión de la alimentación, además de que disminuye el tiempo de coagulación de la sangre [48].
En otros estudios, se evidenció que la exposición de peces a cromo evidencia hipoxia con una menor utilización de oxígeno [48], lo que quedó demostrado en este estudio, ya que, al aumentar la concentración de cromo, aumentó el consumo de oxígeno mostrando un incremento en la actividad respiratoria (branquias), causada por el estrés al estar en un ambiente con mayor concentración de cromo.
El amoníaco, un producto final del catabolismo proteico [49], representa entre el 60 y el 80% de la excreción nitrogenada de los peces [50] por lo que se considera el principal producto de desecho de los peces [51] y un metabolito tóxico [52]. En los peces la producción de amoniaco ocurre principalmente en el hígado a partir de la transaminación y la posterior desaminación del exceso de un aminoácido; y también puede originarse en el músculo debido a la desaminación de adenilatos por el ejercicio de los peces que provoca una disminución en las concentraciones de oxígeno disuelto [47]. Las branquias son un órgano crítico para los peces, ya que representan el sitio principal para el intercambio de gases, la regulación de iones y la excreción de productos de desecho metabólicos [53] como el amonio. La disminución significativa en el consumo de oxígeno es probablemente el resultado de alteraciones del metabolismo energético y es un criterio de valoración que proporciona un índice para el estrés subletal y para el biomonitoreo de los efectos tóxicos de productos químicos tóxicos, así como el aumento en la excreción de amonio, refleja un aumento en el catabolismo de los aminoácidos [54].
En este estudio se muestra que a bajas concentraciones de cromo los peces aumentan su consumo de oxígeno y también aumenta su tasa metabólica (mayor producción de amoniaco), pero a medida que aumenta la concentración de cromo, se inicia el daño en las branquias, se consume mayor cantidad de oxígeno, pero la tasa metabólica disminuye para gastar la menor cantidad de energía, mostrando una tolerancia hacia el cromo, ya que no hubo mortandad en los peces.
Los resultados de este estudio demuestran que el cromo es tóxico para la tilapia del Nilo (O. niloticus) la cual es una especie importante para el consumo como alimento en Guatemala y que la contaminación por cromo puede afectar la cadena alimenticia, ya que esta especie es comúnmente capturada para el consumo humano, lo que representa un riesgo para la población.
Conclusiones
La exposición al cromo hexavalente demostró ser altamente tóxica para la tilapia del Nilo (Oreochromis niloticus) a niveles subletales e indujo a efectos nocivos tanto en el consumo de oxígeno como en la excreción de amoníaco en dos de sus funciones vitales.
Los resultados muestran que el metabolismo de la tilapia del Nilo (O. niloticus) fue afectado por la presencia de cromo hexavalente en agua a diferentes concentraciones. La disminución en la actividad respiratoria se evidencia con la disminución en el consumo de oxígeno a medida que aumenta la concentración de cromo hexavalente en el agua. La tasa metabólica disminuyó con el aumento en la concentración de cromo hexavalente en 6.62, 6.41, 40.60, 40.14 y 62.81 % para las concentraciones de 1.0, 5.0, 10.0, 15.0 y 30.0 mg/L respectivamente con relación al control.
Se observó un aumento en la excreción de amoníaco promedio del 257.69, 147.69, 79.21, 69.99 y 51.77% en la exposición a cromo (VI) en relación con el control, en concentraciones de 1.0, 5.0, 10.0 15.0 y 30.0 mg/L, disminuyendo la excreción de amoníaco a partir del máximo observado a 1.0 mg/L de cromo (VI) a medida que aumenta la concentración del cromo (VI), respecto al control. De esta forma puede considerarse que el consumo de oxígeno y la excreción de amoniaco se pueden utilizar como biomarcadores fisiológicos de tilapia del Nilo para aguas contaminadas con cromo (VI).
Los resultados de este estudio muestran que la tilapia (Oreochromis niloticus) es un organismo útil para el estudio de los efectos causados por el cromo hexavalente. Las tilapias presentaron un esfuerzo metabólico, bajo el efecto del cromo hexavalente, para adaptarse a un ambiente más contaminado, disminuyendo su metabolismo reflejado en la disminución en el consumo de oxígeno y la excreción de amonio, probablemente por el daño ocasionado en las branquias y el hígado.
Agradecimientos
Se agradece la colaboración prestada por Instituto de Pesca – APTA SAA/SP, Governo do Estado de São Paulo, 11990-000 Cananéia, SP, Brasil, donde fue realizado el experimento.
Referencias
[1] W. M. Warren-Vega, A. Campos-Rodríguez, A. I. Zárate-Guzmán, and L. A. Romero-Cano, “A Current Review of Water Pollutants in American Continent: Trends and Perspectives in Detection, Health Risks, and Treatment Technologies,” in “International Journal of Environmental Research and Public Health,”, Mar. 2023, vol. 20, no. 5, p. 4499, doi: 10.3390/ijerph20054499.
[2] Singh et al., “Heavy Metal Contamination of Water and Their Toxic Effect on Living Organisms”, The Toxicity of Environmental Pollutants. IntechOpen, Nov. 30, 2022. doi: 10.5772/intechopen.105075.
[3] Chaudhary et al., “Study on histo-chemical biomarkers of chromium induced toxicity in Labeo rohita,” Emerging Contaminants. Sept. 2023. https://doi.org/10.1016/j.emcon.2023.100204
[4] C. Lau., C. Le. Cadmium, chromium, copper, iron, lead, mercury, nickel, and zinc in freshwater fish: Assessing trophic transfer using stable isotope ratios of δ15N and δ13C. in “Journal of Environmental Sciences”. Jan. 2023. vol 128 pp 250-257.
[5] A. A. Ibrahim-Alsaid, et al. Determination of trace metal levels in the sea and fresh water in Oman by using inductively coupled plasma-optical emission spectroscopy. Arab J Geosci 16, 122, 2023, https://doi.org/10.1007/s12517-023-11210-w
[6] A. Y. Karim. Distribution of 26 metals in the waters of the aquatic ecosystems of the Cotonou Channel and Lake Nokoué, Benin. Journal of Materials Science and Chemical Engineering, Feb. 2023 11, 13-28. doi:10.4236/msce.2023.112002.
[7] J. G. Silva et al. “Genotoxic effect of heavy metals on Nile tilapia (Oreochromis niloticus) species in a urban river in northeastern Brazil” in “Research Square”. doi.org/10.21203/rs.3.rs-2778213/v1
[8] H.H. Abbas and F.K. Ali. “Study the effect of hexavalent chromium on some biochemical, citotoxicological and histopatologycal aspects of the Oreochromis spp. fish”, in “Pakistan Journal of Biological Sciences”: PJBS. 2007 Nov 10 (22) 3973-3982. DOI: 10.3923/pjbs.2007.3973.3982. PMID: 19090268.
[9] J. Sturla-Lompré., et al. “Effects of carbon nanoparticles and chromium combined exposure in native (Ruditapes decussatus) and invasive (Ruditapes philippinarum) Clams. Nanomaterials. 2023, 13, 690. https://doi.org/10.3390/ nano13040690
[10] A.B. Yilmaz et. Al. “Uptake and distribution of hexavalent chromium in tissues (gill, skin and muscle) of a freshwater fish, Tilapia, Oreochromis aureus” in “Journal of Environmental Chemistry and Ecotoxicology”, vol 2(3), pp 2-33 April 2010. ISSN2141 – 226X © 2010 Academic Journals.
[11] S.S. Vutukuru. “Acute effects of hexavalent chromium on survival, oxygel consumption, hematological parameters and some biochemical profiles of the Indian Mayor Carp, Labeo rohita”, in “Environmental Research and Public Health”. 2002, 2(3). 456-462. ISSN 1660-4601.
[12] A.A.R. Mohamed, et al. “Effect of hexavalent chromium exposure on the liver and kidney tissues related to the expression of CYP450 and GCT genes of Oreochromis niloticus fish: Role of curcumin supplement diet” in Exotoxicology and Environmental Safety, vol 188, Jan 2020. doi.org/10.1016/j.ecoenv.2019.109890
[13] V. Wepener et al. “The effect of hexavalent chromium at different pH values on the jaematology of Tilapia sparrmanii (Cichlidae)”, in “Comparative Biochemistry and Physiology Part C: Comparative Pharmacology”, vol 101 (2) Feb 1992, 375-381.
[14] E. Barbieri., et al. “Bagre estuarino Cathorops spixii como bioindicador de matais pesados: um estudo de caso”, en Engenharia de Pesca: aspectos teóricos e práticos. Cananéia, Brasil. 2022 Ch 6. Vol 3. pp 106-116. Doi 10.37885/211206960
[15] M. Barbosa-Henriques et al., “Sublethal of propiconazole on the metabolism of lambari Deuterodon iguape (Eigenmann 1907), a native species from Brazil”, in Fish Physiology and Biochemistry. Springer. Jun. 2021. Vol 47 pp. 1165-1177. doi.org/10.1007/s10695-021-00968-z
[16] R. C. Mendes et al. “Carbofuran affects behavior and metabolism of the Atlantic Forest lambari Seuterodon iguape a native species from Brazil” in “Environmental Science and Pollution Reseacrh” 2021. vol 28. 61128-61136. doi.org/10.1007/s11356-021-15071-2
[17] M. I. de Oliveira-Eiras., et al. “Cooper II oxide nanoparticles (CuONPs) alter metabolic markers and swimming activity in zebra-fish (Danio rerio)”. “Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology. vol. 257, July 2022, 109343. https://doi.org/10.1016/j.cbpc.2022.109343
[18] C. A. Da Silva et al., “Effects of mycogenic nanoparticles on organisms of different trophic levels”, in “Chemosphere” Elsevier. Dec. 2022. Vol 308, Part 3. doi.org/10.1016/j.chemosphere.2022.136540
[19] FAO. “Oreochromis niloticus”, in “Cultured aquatic species fact sheets”. Text by J.E. Rakocy. Edited and compiled by Valerio Crespi and Michael New. Fao.org.
[20] W. El-Houseiny et al. “Renal Damage, and Pseudomonas aeruginosa susceptibility in Oreaochromis niloticus”. “Antioxidants 2022 Vol 11, (6), 1185; doi.org/10.3390/antiox11061185
[21] F. Barreto-Curiel et al. Crecimiento, excreción de amonio y consume de oxígeno de la tilapia hibrida roja (Oreochromis mossambicus x Oreochromis aureaus) cultivada en agua de mar y en agua dulce” en “Ciencias Marinas”, vol 41 No.3. Ensenada sep. 2015. Versión impresa ISSN 0185-3880
[22] S. Özçelik and M. Canli. “Combined effects of metals (Cr6+, Hg2+, Ni2+, Zn2+) and calcium on the serum biochemistry and food quality of the Nile fish (Oreochromis niloticus)”. “Journal of Food Composition and Analysis”. Vol. 115: 104968. doi.org/10.1016/j.jfca.2022.104968
[23] D. Roy et al., “Bioaccumulation of heavy metal in urban pond reared Oreochomis niloticus, water, sediment, and handmade feed in Bangladesh and human health risk implications. “Arabian Journal of Geosciences”. May. 2022. Vol. 15: 959. doi.org/10.1007/s12517-022-10260-w
[24] D. Ghosh and S.K. Saha. “Determination of the lethal concentration 50% (LC50) of hexavalent Chromium in Nile Tilapia (Oreochromis niloticus), “Advances in Zoology and Botany, Vol. 10, No. 4, 99 123-131. Sept. 2022. Doi: 10.13189/azb.2022.100406.
[25] N.B. Metcalfe et al. “Does individual variation in metabolic phenotype predict fish behavior and performance?” in “Journal of Fish Biology”, vol 88, 298-321. 2016. https://doi.org/10.1111/jfb.12699
[26] D. Chabot et al (a). “Metabolic rate in fishes: definitions, methods and significance for conservation physiology” in “Journal of Fish Biology”, vol 88, 1-9. 2016. Ddoi:10.1111/jfb.12873.
[27] T. Norin, T.D. Clark. “Measurement and relevance of maximum metabolic rate in fishes”, in “Journal of Fish Biology”, vol 88, 122-151. 2016. https://doi.org/10.1111/jfb.12796
[28] E.J. Eliason, A.P. Farrell. “Oxygen uptake in Pacific salmon Oncorhynchus spp.: when ecology and physiology meet”, in “Journal of Fish Biology”, vol 88, 359-388. doi:10.1111/jfb.12790
[29] K, Yuen and S.F. Chew. “Ammonia production, excretion, toxicity, and defense in fish: a review” in “Frontiers in Physiology”. Oct 2010. doi: 10.3389/fphys.2010.00134
[30] M.N. Kutty. “Respiratory quotient and ammonia excretion in Tilapia mossambica” in “Marine Biology”. Vol 16, 126-133 (1972).
[31] D. Chabot et al (b). “The determination of standard metabolic rate in fishes”, in “Journal of Fish Biology”, vol 88, 81-121. 2016. https://doi.org/10.1111/jfb.12845
[32] Fishbio. Heart-Stopping Science: The importance of fish physiology. Aug. 2015. Available: https://fishbio.com/heart-stopping-science-the-importance-of-fish-physiology/
[33] C. Jorgensen, et al. “Modelling and interpreting fish bioenergetics: a role for behaviour, life-history traits and survival trade-offs”, in “Journal of Fish Biology”, vol 88, 389-402. doi:10.1111/jfb.12834
[34] S.J. Kaushik. “Factores que afectan la excreción nitrogenada en teleósteos y crustáceos”, en “ACU, nov. 2019
[35] Barbieri, E. (2007). Use of Oxygen Consumption and Ammonium Excretion to Evaluate the Sublethal Toxicity of Cadmium and Zinc on Litopenaeus schmitti (Burkenroad, 1936, Crustacea). Water environment research. Vol. 79, 6.
[36] Barbieri E. Branco, J.; Santos, M.; Hidalgo, K. (2013). Effects of cadmium and zinc on oxygen consumption and ammonia excretion of the Sea-Bob shrimp, according to the temperature. Boletin instituto de Pesca, Sao Paulo. 39(3): 299-309.
[37] Santos, D.; Barbieri, E.; Bolondi, A.; Melo, C. (2014). Effects of lead in white shrimp (Litopenaeus schmitti) metabolism regarding salinity. O Mundo da Saúde, Sao Paulo. Vol 38 (1): 16-23.
[38] Barbieri, E.; Oliveira, K.; Schultz, J.; Barbosa, M. (2019). Metabolic and histological alterations after exposing Deuterodon iguape to different salinities. Boletim do Instituto de Pesca. Instituto de Pesca. ISSN 1678-2305 inline version.
[39] Barbieri E.; Tavares, E. (2011). The use of oxygen consumption and ammonium excretion to evaluate the toxicity of cadmium on Farfantepenaus paulensis with respect to salinity. Chemosphere. Vol. 84, 9-16
[40] I.M. Elsaeidy, et al. “Multiple biomarkers response in Nile tilapia, Oreochromis niloticus (L.) exposed to sublethal concentrations of hexavalent chromium”, in “Egypt. J. Aquat. Biol. & Fish”. Vol 20, No. 2:37-49 (2016). ISSN 1110-6131
[41] Z. Yu, et al. Toxic effects of hexavalent chromium (Cr6+) on bioaccumulation. Apoptosis, oxidative damage and inflammatory response in Channa asiatica”, in “Environmental Toxicology and Pharmacology. Vol 87, oct 2021. doi.org/10.1016/j.etap.2021.103725
[42] J.H. Kim and J.C. Kang. “The toxic effects in the stress and immune responses in juvenile rockfish, Sebastes schlegelii exposed to hexavalent chromium” in “Environmental Toxicology and Pharmacology”, vol 43 april 2016 128-133.
[43] H.Lorenzo-Márquez. (2016). “Estimación de riesgo de exposición a metales pesados por consumo de plecos (Pterygoplichthys spp.) en infantes de comunidades ribereñas de los ríos Grijalva y Usumacinta, México”.
[44] S. Dhanakumar et all. (2014). “Heavy metal partitioning in sediments and bioaccumulation in commercial fish species of three major reservoirs of river Cauvery delta region, India”. Ecotoxicol Environ Saf. 2015 Mar;113:145-51. doi: 10.1016/j.ecoenv.2014.11.032. Epub 2014 Dec 10. PMID: 25497770.
[45] E. Baysoy et al. (2012). “The effects of salinity and salinity + metal (Chromium and Lead) exposure on ATPase activity in the gill and intestine of Tilapia Oreochromis niloticus” in Archives of Environmental Contamination and Toxicology, 64(2), 291-300. Doi:10.1007/s00244-012-9825-9.
[46 ]Z. Hossain et al. (2021). Heavy metal toxicity in Buriganga river alters the immunology of Nile tilapia (Oreochromis niloticus L) in “Heliyon 7 e08285.
[47] P.J. Pradeep et al. (2011) Trend in ammonia excretion during acclimatizarion of adult freshwater red hybrid Tilapia Oreochromis mossambicus (Peters, 1852) C Oreochromis niloticus (Linnaeus, 1758) in different salinities in “Our Nature. 9:34-40.
[48] S. Aslam & A.M. Yousafzai. (2017). “Chromium toxicity in fish: A review article”. Journal of Entomologuy and Zoology Studies. 5(3): 1483-1488.
[49] E. Barbieri & L.A. Alves Ferreira. (2011). Effects of the organophosphate pesticide Folidol 600® en the freshwater fish, Nile Tilapia (Oreochromis niloticus) in “Pesticide Biochemistry and Physiology. 99: 209-214. https://doi.org/10.1016/j.pestbp.2010.09.002
[50] A.C.K. Benli et al. (2008). Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L): Effects on gill, liver and kidney histology in “Chemosphere” 72:1355-1358. https://doi.org/10.1016/j.chemosphere.2008.04.037
[51] E. Sherif et al. (2008). Effect of ammonia on Nile Tilapia (O niloticus) performance and some hematological and histological measures. International Symposium on Tilapia in Aquaculture. 513-531.
[52] C.S. Carvalho et al. (2012). Biomarker responses as indication of contaninant effects in Oreochromis niloticus, in “Chemosphere” 89:60-69. https://doi.org/10.1016/j.chemosphere.2012.04.013
[53] Z. Birungi et al. (2007). Active biomonitoring of trace heavy metals using fish (Oreochromis niloticus) as bioindicator species. The case of Nakivubo wetland along Lake Victoria in “Physics and Chemistry of the Earth 32: 1350-1358. https://doi.org/10.1016/j.pce.2007.07.034
[54] E. Barbieri. Effect of 2,4-D herbicide (2,4-dichlorophenoxyacetic acid on oxygen consumption and ammonium excretion of juveniles of Geophagus brasiliensis (Quo Y Gaimard, 1824) (Osteichthyes, cichlidae) in “Ecotoxicology”. DOI 10.1007/s10646-008-0256-3
Declaración sobre uso de Inteligencia Artificial (IA)
Los autores aquí firmantes declaramos que no se utilizó ninguna herramienta de IA para la conceptualización, traducción o redacción de este artículo.
1 Escuela de Química, Facultad de Ciencias Químicas y Farmacia, Universidad de San Carlos de Guatemala, Guatemala. Doctorado en Ciencias Naturales para el Desarrollo -DOCINADE.
 bessieoliva@yahoo.com
bessieoliva@yahoo.com https://orcid.org/0000-0002-4427-5888
https://orcid.org/0000-0002-4427-58882 Instituto de Pesca, Universidad de São Paulo (USP). Brasil.
 edisonbarbieri@yahoo.com.br
edisonbarbieri@yahoo.com.br https://orcid.org/0000-0002-7423-3726
https://orcid.org/0000-0002-7423-37263 Escuela de Química, Facultad de Ciencias Químicas y Farmacia, Universidad de San Carlos de Guatemala, Guatemala.
 fpsabino@yahoo.com
fpsabino@yahoo.com https://orcid.org/0000-0001-5736-0371
https://orcid.org/0000-0001-5736-03714 Escuela de Agronegocios, DOCINADE, Instituto Tecnológico de Costa Rica. Costa Rica.
 rocampos@tec.ac.cr
rocampos@tec.ac.cr https://orcid.org/0000-0003-4460-2313
https://orcid.org/0000-0003-4460-2313