Nanomateriales en aplicaciones agrícolas. Recientes avances en la agroindustria bananera
Nanomaterials in agricultural applications. Recent advances in the banana industry
Jorge Araya-Mattey1, Jorge Sandoval2, Oscar Rojas-Carrillo3
Fecha de recepción: 26 de julio, 2023
Fecha de aprobación: 30 de noviembre, 2023
Araya-Mattey, J; Sandoval, J; Rojas-Carrillo, O. Nanomateriales en aplicaciones agrícolas. Recientes avances en la agroindustria bananera. Tecnología en Marcha. Vol. 37, No 3. Julio-Setiembre, 2024. Pág. 100-113. https://doi.org/10.18845/tm.v37i2.6800
https://doi.org/10.18845/tm.v37i2.6800
Palabras clave
Agricultura; biotecnología; control biológico; cultivos; nanotecnología.
Resumen
La aplicación de la nanotecnología en la agricultura se ha visto reflejada en un considerable número de contribuciones científicas que demuestran un potencial interés en el desarrollo de nuevos productos que incluye desde cuidados del suelo, frutos y cultivos, hasta la mejora en las formulaciones de fertilizantes, pesticidas, estimuladores y reguladores de crecimiento de las plantas. Producto de una revisión bibliográfica exhaustiva, se describen conceptos, propiedades y ventajas de sistemas nanoestructurados aplicados en sistemas de producción agrícolas en diferentes países de América, Asia y África. Se exploran los avances en sistemas de liberación de compuestos bioactivos empleando matrices naturales y sintéticas en sistemas vegetales. Además, se discute el efecto de la adición de nanomateriales y los efectos positivos y adversos sobre plantas y en el medio ambiente. Finalmente, se expone el uso de estrategias basadas en aplicaciones de la nanotecnología y los desafíos para el control de enfermedades en el cultivo de banano.
Keywords
Agriculture; biologic control; biotechnology; crops; nanotechnology.
Abstract
The application of nanotechnology in agriculture has been reflected in a considerable number of scientific contributions that show a potential interest in the development of new products that includes soil care, fruits and crops, to the improvement in the formulations of fertilizers, stimulating pesticides and plant growth regulators. Product of an exhaustive bibliographic revision, concepts, properties and advantage of nanostructured systems applied in agricultural production systems in different countries of America, Asia and Africa is described. It is explore, the recent development in release profile of natural and synthetic bioactive compounds, with an adequate and programmed specificity of the encapsulated compounds by using natural and synthetic matrices on plants. Moreover, it is discussed the effects and of addition of nanomaterials on plants and the environment. Finally, the use and challenges about nanotechnology strategies on banana crops is presented.
Introducción
Las nanopartículas (NPs) se definen como partículas sólidas o dispersiones con un tamaño en el rango de 1 a 1000 nanómetros [1]. Diferentes materiales se destacan para la elaboración de NPs, por ejemplo, los de carácter inorgánico como los metales nobles; plata (Ag), oro (Au), y metales de transición; hierro (Fe) y titanio (Ti), zinc (Zn), cobre (Cu) y metaloides como el silicio (Si), entre otros [2], [3].
Entre los materiales de tipo orgánico, se pueden enumerar los obtenidos a base de carbono como nanotubos de carbono y grafeno y otros de naturaleza polimérica o lipídica. [4] [5].
Un polímero está constituido por moléculas de alto peso molecular formados por unidades repetitivas que se adicionan a la cadena a partir de la reacción de sus monómeros de partida. Se pueden distinguir polímeros de origen sintético como óxido de poli(etileno), poli(etilenglicol), poli(vinilpiridina), poli(ácido láctico), así como polímeros naturales y derivados como celulosa, almidón, gelatina, albumina, quitina, quitosano, y de origen bacteriano como polialcanoatos; poli(caprolactona), entre los más comunes [6].
Estos materiales de naturaleza inorgánica y orgánica se pueden combinar o acomplejar para generar diferentes nanoestructuras según la metodología y la técnica que se utilice [7], [8]. Entre las nanoestructuras se pueden mencionar: micelas, liposomas, nanogeles, nanoestructuras híbridas, sílices huecas y porosas, nanocápsulas poliméricas y nanoestructura inorgánicas, tal como se muestra en ver Figura 1.
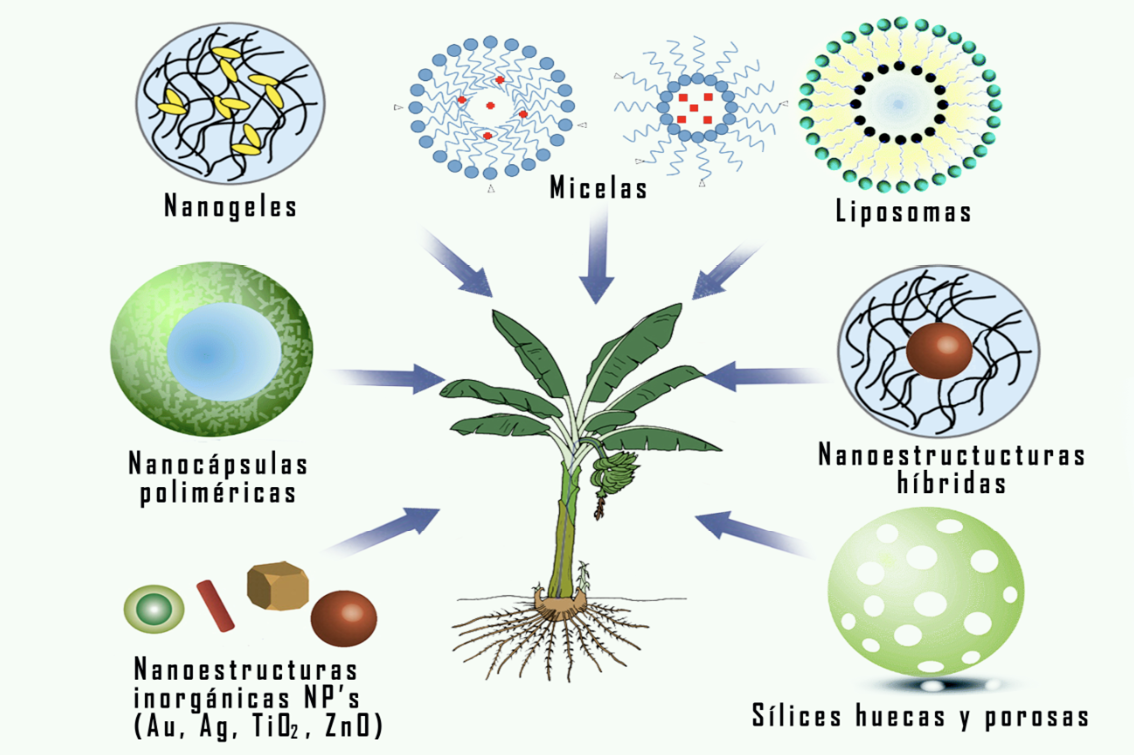
Figura 1. Diferentes nanoestructuras con aplicaciones en las plantaciones de banano.
La aplicación de estos sistemas nanoestructurados, han sido reportados en formulaciones para favorecer el crecimiento de la planta [9], en la identificación de enfermedades de estas [10], y en algunos casos se menciona la capacidad antibacteriana de algunas nanopartículas inorgánicas [11]. En las secciones siguientes se discutirán los principales logros de diferentes nanoestructuras aplicados a sistemas vegetales.
Nanoestructuras inorgánicas como transportadores de compuestos activos en sistemas vegetales
Las Nanopartículas tienen diferentes aplicaciones y beneficios en las plantas, en los últimos años se ha dado un aumento en las investigaciones reportando sobre este tema [12], los usos en la agricultura permiten mayor disposición de nutrientes o moléculas para el control y detección de enfermedades. La capacidad de encapsular los compuestos y de liberarlos en los sitios deseados es de las principales ventajas que se observan en estos sistemas y tienen como uno de sus beneficios la disminución principalmente de fertilizantes y plaguicidas generando sistemas más eficientes y una agricultura más tecnificada [13].
Los principios de encapsulamiento y mecanismos de liberación de las NPs han sido ampliamente referidas en estudios médicos mediante la dosificación de proteínas, anticuerpos antígenos, como estrategias terapéuticas y de diagnóstico de enfermedades [14], [15]. Sin embargo, estos conceptos y principios han sido adaptados sobre sistemas vegetales. De tal manera, en los últimos 10 años, se han reportado investigaciones que tienen como objetivo el desarrollo de sistemas de liberación controlada o sostenida de pesticidas y fertilizantes [6], así como nanomateriales que favorecen la geminación, nutrición, crecimiento y protección de las plantas [16],[17].
La estrategia de liberación de compuestos bioactivos mediante el uso de nanopartículas es utilizada en sistemas agrícolas, con el propósito de reducir los efectos tóxicos de los pesticidas y a la vez proveer una prolongada protección a los compuestos de las condiciones medioambientales [17]. En este contexto, nanopartículas de sílices huecas y porosas preparadas mediante la técnica sol-gel, han sido usadas para el encapsulamiento del insecticida Avermectina. Mediante el uso de líquidos supercríticos, se ha permitido el encapsulamiento del compuesto con una alta capacidad de carga estimada en 625 g/kg. Los resultados demostraron que el compuesto encapsulado presenta una adecuada fotoestabilidad y alcanza una eficiente liberación sostenida [18].
Asimismo, el efecto sobre el crecimiento y la germinación de semillas de espinaca fue reportada usando nanopartículas de óxido de titanio (NPsTiO2). De acuerdo a los autores, las nanopartículas de titanio promueven la activación de la enzima Rubisco Activasa (ribulosa-1,5-bisfosfato carboxilasa/oxigenasa), la cual activa el metabolismo del nitrógeno convirtiéndolo de su estado inorgánico al orgánico y como consecuencia, incrementado el desarrollo de la planta [19]. Paralelamente, resultados obtenidos por Linglan y colaboradores, demuestran que el tratamiento con nanopartículas de titanio promueve un aceleramiento en la biosíntesis de clorofila lo que favorece el proceso fotosintético [19]. Estudios similares han demostraron efectos positivos en la geminación de semillas de perejil donde la adición de dosis de 30 mg/ml de NPsTiO2 permite un aumento en el porcentaje de germinación del 92 %, promoviendo además un aumento en el desarrollo de la raíz y el brote [20]. Cabe mencionar, que los resultados son comparables con los obtenidos por otros autores [16],[21]. Sin embargo, estudios sistemáticos sobre el mecanismo de cómo estas nanopartículas son internalizadas y distribuidas en los tejidos de las plantas aún son escasos.
Las nanopartículas de plata (NPsAg) son quizás las NP`s metálicas más reconocidas por sus propiedades antimicrobianas y antifúngicas, principalmente usadas para el manejo de enfermedades de plantas causadas por esporas de hongos patógenos [22]. Se ha observado que los iones de plata inhiben los niveles de crecimiento de hongos como Bipolaris sorokiniana y Magnaporthe grisea en las plantas. Los estudios demuestran que con concentraciones de 500 ppm de NPsAg resulta en una disminución del 91 % de estos hongos seis horas después de su aplicación, disminuyendo su efectividad con el tiempo [23]. De manera similar, (otros autores) han demostrado que las NPsAg presentan efectos inhibitorios contra hongos patógenos como Sclerotinia sclerotiorum, S. minor y Rhizoctonia solani a una concentración entre 3 a 7 ppm [24].
Las infecciones bacterianas debido a la presencia del hongo Xanthomonas spp es una de las enfermedades que afecta mayoritariamente las plantaciones de tomate. Aunque se ha combatido esta enfermedad utilizando formulaciones con cobre, el patógeno tiende a crear resistencia aún a altas concentraciones. Recientemente, la combinación de NPsAg y óxido de grafeno demostraron tener una eficiente actividad antibacterial eliminando la totalidad de las células X. perforans. Los resultados son comparables a los obtenidos por Strayer y colaboradores, realizados en invernaderos, en el cual la enfermedad es reducida empleando concentraciones bajas equivalentes a 16 µg/ml de Ag [25].
La actividad de los iones plata y el mecanismo bactericida de estos ha sido un tema de intenso debate. Una de las afirmaciones expone que los cationes Ag+ interaccionan con diferentes grupos funcionales (fosfato, amino, carboxilos, hidroxilos, etc) presentes en las proteínas y enzimas de la bactería provocando una deformación estructural de la membrana. La penetración de los iones plata a través de la membrana induce a una inactivación de las enzimas lo que genera una sofocación e inhibición de la replicación celular [26], [25].
Estudios realizados por Bello-Bello mostraron que adicionar 50 ppm de NPsAg durante el cultivo in vitro de caña de azúcar (Saccharum spp.) favoreció el número de brotes en las plantas, sumado a una función microbicida, mientras que cuando se aplicaron concentraciones mayores a 200 ppm se obtuvieron un efecto inhibitorio en la brotación [27].
La adición de NPsAg al medio de cultivo para la germinación de semillas de Pitahaya (Hylocereus undatus) generó un aumento en el crecimiento de la planta, al emplearse una concentración de 0.385 mg/L [28]. El aumento en la germinación de las plantas cuando se les adiciona NPsAg se debe a una hormesis, es decir un fenómeno caracterizado por una estimulación del crecimiento a bajas concentraciones y una inhibición a altas dosis, siendo la dosis correcta la que favorece el crecimiento, la brotación o el enraizamiento de las mismas [29].
Así como los anteriores reportes, existe un número considerable de estudios de formulaciones para suprimir enfermedades en plantas como; Fusarium oxysporium, Xanthomonas spp [30], [31], [32], las cuales tienen en su formulación nanopartículas metálicas a base de Al, Au, B, Ce, Fe, Mg, Mn, Cu, Mo, Ni y S. Los sistemas que presentas mejores resultados son aquellas nanopartículas formadas por CuO y CeO2 [33] [34], [35]. Otras sin embargo, son usadas para lograr una mayor germinación y un efecto positivo en el crecimiento de la planta [36], [37] tal como materiales a base Zn [38], el cual se ve potenciado cuando se reduce su tamaño de partícula. [39].
Por otro lado, la incorporación de nanopartículas inorgánicas puede inducir la degradación de ciertos pesticidas sintéticos. Por ejemplo, la adición de nanopartículas inorgánicas a base de TiO2, y Ag/TiO2 puede acelerar el proceso de fotodegradación del insecticida Imidacloprid (IMI) encapsulado en una matriz polimérica. De acuerdo a los autores, el mecanismo de fotodegradación del compuesto se basa en la capacidad de las NPsTiO2 de absorber radiación a longitudes de onda menores a 350 nm y generar especies radicales que inducen reacciones redox con las moléculas de IMI adsorbidas en la superficie de las partículas. De acuerdo con los autores el insecticida fotodegradable empleado para el control de Martianus dermestoides mostró una alta actividad biológica denotado por su bajo LD50 en comparación con la formulación de cristales de IMI puros [40].
Algunas ventajas de estos nanomateriales en los sistemas agrícolas, están relacionadas por ser buenos transportadores de sustancias, que benefician a la planta, eliminando plagas que atacan los cultivos. Sin embargo, las NP`s inorgánicas tiene consecuencias negativas las cuales se asocian principalmente a la toxicidad, afectando el crecimiento y funcionamiento de la planta debido al estrés que pueden generar la adición de los materiales. La toxicidad se ve afectada por parámetros que deben ser bien estudiados como lo es la concentración, la forma y el tamaño de las nanopartículas [41].
Estudios recientes han determinado que, a diferentes concentraciones, las nanopartículas disminuyeron el crecimiento y generaron un aumento en la acumulación de otros metales tóxicos para la planta. Por ejemplo, las nanopartículas de hierro metálico a concentraciones de 100, 500, 1000 mg/kg disminuyeron el crecimiento de las plantas de Ramio u ortiga blanca (Boehmeria nivea) pero aumenta la concentración de Cd y Fe a 500 y 1000 mg/Kg, generando toxicidad por estrés oxidativo [42]. De manera similar nanopartículas de TiO2 en concentraciones de 50, 100 y 500 mg/Kg, con tamaños entre 20 y 40 nm, disminuyeron el estrés oxidativo en plantas de arroz, pero incrementaron la concentraciones de Cd en 100 y 500 mg/Kg [43].
Nanoestructuras poliméricas como transportadores de compuestos activos en sistemas vegetales
La actividad agroindustrial es una de las actividades económicas más importantes a nivel mundial y sobre todo en países latinoamericanos, a nivel global se espera que para el 2023 se alcance aproximadamente unos 130 700 millones de dólares equivalente en consumo en pesticidas [44]. Sin embargo, la aplicación de agroquímicos (actualmente de 4 millones de toneladas) [44] juega un papel determinante en la maximización de la producción y su uso controlado representa uno de los principales retos para el ambiente. El uso de materiales poliméricos es de particular interés por su potencial para convertir los sistemas de producción agrícola en procesos económicamente y ambientalmente amigables.
El desarrollo de nanoestructuras para el encapsulamiento de agentes bioactivos y posterior liberación controlada o sostenida, han demostrado incrementar la eficiencia, la solubilidad y la estabilidad de los compuestos empleados. Adicionalmente, una de las ventajas de estos sistemas es que permite reducir la concentración de la dosis y el número de aplicaciones de los agentes bioactivos, reduciendo en cierta medida los riesgos de contaminación del ambiente, así como la toxicidad en humanos y demás organismos. [45], [46], [47].
Diferentes tipos de polímeros sintéticos y naturales han sido usados para transportar una serie de agroquímicos entre los que se pueden citar fungicidas, herbicidas, insecticidas, reguladores de crecimiento y fertilizantes. Basados en las características biodegradables, biocompatibles y baja toxicidad de los nanomateriales poliméricos empleados, los convierten en potenciales candidatos para contribuir en las aplicaciones agrícolas sostenibles [48], [49].
Boehm y colaboradores reportan el uso de nanoesferas de 125 nm de diámetro basados en el poliester biodegradable, poli(-ε-caprolactona), para el encapsulamiento del insecticida ethiprole mediante la técnica de nanoprecipitación. Los autores demostraron que la matriz polimérica incrementa la penetración del ingrediente activo en la planta en comparación con el sistema clásico de suspensión. [50].
Complementariamente, los polímeros poli(vinilpirrolidona) y poli(vinil alcohol) han sido empleados como agentes estabilizadores en la formulación de emulsiones de aceite en agua, en la cual es posible la incorporación de bifentrina en la fase oleosa. La capacidad de encapsulamiento de la emulsión varió entre el 50-90 % de agente activo sin afectar significativamente el tamaño de la emulsión y la estabilidad de la misma. Sin embargo, las formulaciones pudieron ser optimizadas utilizando poli(ácido acrílico) y poli(butilacrilato), los cuales inducen a una mayor estabilidad de la formulación [51].
Los copolímeros son materiales poliméricos de naturaleza sintética obtenidos por la reacción de dos o más monómeros. Copolímeros de poli(vinilpiridina) y poli(vinilpyridina-co-estireno), dado a sus características anfifilicas pueden autoensamblarse para formar NPs en dispersión acuosa. La capacidad de formar estructuras esféricas de tamaños entre 100 y 250 nm y con un núcleo hidrofóbico, ha sido aprovechada para encapsular fungicidas como tebuconazol y clorotalonil para el tratamiento sobre madera de pino. El estudio reveló que existe una relación inversamente proporcional entre la rapidez del proceso de liberación de ambos biocidas y el contenido de estireno en el copolímero. Lo anterior se explicó en términos de un incremento en la hidrofobicidad de la matriz polimérica que induce a una mayor interacción con la molécula orgánica biocida. Aunque la introducción de los pesticidas en la matriz polimérica mejoró la solubilidad del compuesto activo, la interacción polímero-biocida induce a un mayor tamaño de partícula y como consecuencia a una menor estabilidad de la suspensión en el tiempo [52].
Los polímeros biodegradables y no tóxicos representan una alterativa sostenible en el desarrollo de sistemas de liberación de moléculas bioactivas sobre sistemas vegetales. Por ejemplo, la poli(caprolactona) (PCL) ha demostrado tener cierta eficiencia en el encapsulamiento y posterior liberación de carbendazima y tebuconazol. [53]. En este estudio, los dos sistemas presentaron resultados similares en cuanto al encapsulamiento evidenciado la afinidad del material con el agente activo, a la vez, induciendo una liberación lenta del compuesto. Adicionalmente, los ensayos de viabilidad celular sobre células 3T3 y MC3T3, mostraron una menor toxicidad de los conjugados polímeros/fungicidas comparado con la formulación comercial del producto.
De manera similar, Grillo y colaboradores han preparado y caracterizado nano cápsulas de poli(caprolactona) para encapsular diferentes herbicidas como: ametrina, atrazina y simazina, con una eficiente capacidad de incorporación superior al 84 % de compuesto activo. Los experimentos in vitro de la liberación sugieren que el mecanismo de dosificación del compuesto es gobernado por la relajación de las cadenas poliméricas, mientras que los análisis de toxicidad sobre células humanas (linfocitos y células de las cepas Allium), muestran que las formulaciones de nanocápsulas conteniendo el herbicida son menos tóxicas que las formulaciones de herbicida libre [48].
Además, los resultados demostraron que la naturaleza del polímero no altera la actividad del herbicida, sino que potencia su efectividad sobre los organismos Brassica sp y Zea mays estudiados, mediante la encapsulación de atrazina usando nanopartículas de PCL [54]. Sin embargo, los resultados sugieren que las características morfológicas de las nanopartículas podrían afectar la germinación y el desarrollo de las semillas por medio de la disrupción de la superficie de estas.
Recientemente, el mismo sistema ha sido evaluado sobre plantas modelo de mostaza (Brassica juncea). De acuerdo a los autores, el herbicida puede ser aplicado a menores concentraciones en comparación a la formulación no encapsulada, sin comprometer la eficiencia. Adicionalmente, la incorporación del pesticida dentro de la matriz polimérica, sugiere la reducción de su movilidad en el suelo, reduciendo la probabilidad de contaminación de fuentes de agua y reduciendo la citotoxidad y genotoxicidad [55]. Complementariamente, estudios realizados sobre maíz, indican que el conjugado de PCL-antrazina no produce efectos secundarios persistentes sobre la especie evaluada, proveyendo una herramienta segura sin afectar el crecimiento de planta [55].
Otro tipo de estructura que puede obtenerse utilizando polímeros sintéticos son materiales llamados hidrogeles. Los hidrogeles son sistemas entrecruzados que pueden almacenar agua en su interior. El uso de este tipo de estructuras pueden ser obtenidos mediante la copolimerización del ácido itacónico y acrilamida en presencia de diferentes porcentajes de N,N-metilenbisacrilamida (MBA). En el estudio reportado por Rojas y colaboradores se empleó como molécula modelo el bromacil, el cual es un herbicida ampliamente utilizado en plantaciones de piña. El estudio de la liberación de esta sustancia se llevó a cabo a nivel de laboratorio en medio acuoso y se determinó su perfil de liberación mediante la técnica de cromatografía líquida de alta eficiencia (HPLC) [56]. Dada la naturaleza química de la matriz polimérica y la estructura porosa del material los autores sugieren un mecanismo de liberación de la sustancia gobernado por difusión y por las interacciones que tienen lugar entre el principio activo y las cadenas poliméricas.
Recientemente, el uso de bioplaguicidas para el control de plagas es un campo de potencial interés, sin embargo, una de las grandes desventajas de estos sistemas es la susceptibilidad de los compuestos activos a degradarse cuando son expuestos a la radiación UV y al calor. La eficiencia de extractos de neem (Azadirachta indica) contra Plutella xylostella, ha sido evaluado usando nanopartículas de PCL preparadas a partir de una suspensión coloidal y luego secadas mediante aspersión. Los autores indican que por medio del hinchamiento, relajación y erosión de la matriz polimérica, se logra liberar la totalidad del biopesticida encapsulado, causando la muerte de la totalidad de las larvas expuestas [57].
Otros sistemas similares incluyen polímeros a base de polietilenglicol como vehículo de aceite de ajo contra Tribolium castaneum [58], azometina para el control de Sclerotium rolfsii, Rhizoctonia bataticola y Rhizoctonia solani [59] y del insecticida acefato para tratar Plutella xylostella [60].
Por otro lado, la contribución de algunos polímeros de origen natural y derivados son de gran importancia, por su bajo costo, biocompatibilidad y biodegradabilidad. Particularmente, el quitosano es uno de los polímeros reportados en la literatura usados en aplicaciones agrícolas. El quitosano es un polisacárido lineal constituido de β-(1-4) D-glucosamina y N-acetil-D-glucosamina. Mediante la estrategia de gelación iónica, nanocápsulas de quitosano y pectina han sido formuladas para encapsular carbendazima. La nanaformulación empleando estos polímeros permitió la incorporación de una menor concentración del fungicida, y una mayor eficiencia contra Fusarium oxisporum y Aspergillus parasitivus, en comparación con la formulación comercial [61].
El alginato de sodio es otro polímero de origen natural que se estudia en la formulación de microparticulas mediante gelación ionica con cloruro de calcio. Las micropartículas obtenidas en un amplio rango de tamaños desde 400 hasta de 3000 µm permiten encapsular el hongo Trichoderma harzianum, el cual es conocido como sistema de biocontrol. Además, de proporcionar protección a T. harzianum contra la radiación UV, este sistema muestra actividad antagonista contra fitopatógenos como el moho blanco [62].
Nanocápsulas de carboximetil quitosano entrecruzado con 4-azido bencilideno fueron reportadas por Sun y colaboradores para encapsular moléculas de metomilo. De acuerdo a los autores la alta eficiencia de encapsulamiento del sistema es atribuida a la interacción de puentes de hidrógeno entre el polímero y el agente activo; mientras que el perfil de liberación pudo ser explicado en términos de difusión del compuesto a través de la red polimérica, la cual depende del grado de entrecruzamiento del polímero [63].
De manera similar, nanopartículas de quitosano con aceite esencial de neem encapsulado resultó efectivo contra H. armígera, registrando una mortalidad de las larvas del 90 % [64]. En otro estudio reciente, la combinación de goma arábica y quitosano ha sido usado para emulsificar aceite esencial de geraniol, con actividad in vitro inhibitoria contra la mosca blanca, Bemisia tabaco [65]. La actividad fue significativamente incrementada por la nanoencapsulación con goma arábica y quitosano, adicionalmente, se evaluó la dependencia del perfil de liberación, donde se evaluaron tres temperaturas (20 ºC, 25 ºC y 30 ºC) en la liberación del aceite esencial. Se observó que conforme aumenta la temperatura la liberación aumenta en el tiempo, alcanzando un 81% de liberación a 30 ºC a las 7 horas [65].
Estos estudios demuestran que la temperatura es un factor a tomar en cuenta en el desarrollo de sistemas de liberación controlada con aplicaciones agrícolas, además, los resultados de estas investigaciones muestran que las formulaciones empleando polímeros como vehículo de moléculas bioactivas, contribuyen en el desarrollo de futuros pesticidas, los cuales podrían traer beneficios desde el punto de vista económico, social y ambiental.
Recientes avances de la aplicación de nanoestructuras en la agroindustria bananera
Las aplicaciones de sistemas de liberación de moléculas activas en materia de producción, mejora y cuido del banano son escasas; debido a que su uso es muy incipiente en este cultivo. En los últimos cinco años, la investigación en este campo ha generado los primeros artículos científicos entre otras comunicaciones [66].
Entre ellos es el reportado por Majumder, donde se emplearon nanopartículas de oro conjugadas con anticuerpos (NPsAU) para la construcción de un biosensor para la detección del virus Banana bunchy top virus (BBTV). La eficacia del método se determinó mediante la expresión del virus (BBTV) de manera recombinante y cargado en proteínas para la infección de las plantas de la especie Grand Naine. Las muestras infectadas fueron analizadas utilizando NPsAu conjugadas y mediante el ensayo de inmovilización (DIBA), se logró determinar la presencia del virus. [67].
Recientemente, un estudio ha demostrado una posible forma de tratamiento contra BBTV empleando NPsAg. Majumder y colaboradores, reportan que una concentración de 50 ppm con tres aplicaciones durante el tratamiento resultó en una mayor efectividad en la eliminación del BBTV. Interesante notar que los conteos de clorofila; alfa y beta, carotenoides, fenoles y prolina, también se vieron beneficiados con la aplicación de este tratamiento en comparación con los tratamientos en ausencia de NPsAg.
Los autores han relacionado el tamaño de las nanopartículas y su capacidad inhibitoria sobre la replicación del virus. De tal manera, se ha propuesto que las NPsAg entran en las células de las plantas causando una activación antiviral, bloqueando los vectores que ayudan a la replicación del virus [68], [69].
El uso de matrices poliméricas biodegradables a base de quitosano, ha sido evaluado para mejorar los procesos poscosecha de banano. La especie utilizada en el estudio fue Cavendish banana (Musa acuminata AAA grupo), bajo concentraciones de quitosano entre 1,15 % y 1,25 % entrecruzadas con tripolifosfato. [70]. Los bananos recubiertos con películas de polímero fueron evaluados en términos de características como: vida útil, pérdida de peso, conversión de almidón a azúcar, relación pulpa cáscara y valores de solidos solubles totales durante dos semanas. Las pruebas, demuestran que las matrices poliméricas mejoran la vida útil de las frutas presentando una calidad considerable. Las muestras recubiertas presentaron bajos porcentajes de deshidratación del fruto y además inhibe los procesos de conversión de almidón a azúcar [70].
Asimismo, el efecto de las partículas de nanoparticulas de Zn y de ZnO sobre contaminantes bacterianos y micóticos de cultivos de banano in vitro, fue reportado por Helaly y colaboradores. Los experimentos demostraron que concentraciones inferiores a 200 mg/L, inhiben el crecimiento de los microorganismos y previenen significativamente su crecimiento sin causar efectos negativos en la regeneración de los explantes [71].
Entre los diferentes ensayos empleados sobre plantas de banano, quizás los más relevantes corresponden a los que mencionan el uso de nanopartículas de plata. Las AgNPs se han utilizado para evaluar el efecto sobre el crecimiento in vitro de plantas la especie Musa spp. La concentración de 1 ppm presentó los mejores resultados de acuerdo a parámetros como altura, números de hojas, números de raíces, peso fresco, peso seco y total de clorofila [72]. Consecuentemente, concentraciones mayores de NPsAg presentaron un efecto inhibitorio en el crecimiento de los brotes [73]. Los estudios a nivel de invernadero reportaron resultados similares [72].
Vidyalakshmi y colaboradores cultivaron banano de la variedad Grand naine en condiciones in vitro empleando medio de enraizamiento suplementado con diferentes concentraciones de NPsAg y AgNO3, y encontraron diferencias en la anatomía de las raíces de las plantas, habiendo un incremento en el número de elementos de metaxilema a altas concentraciones de AgNO3. Se confirmó que las NPsAg no provocan efectos tóxicos sobre las plantas cultivadas in vitro, lo cual ofrece oportunidades para explorar el desarrollo de formulaciones basadas en NP que permitan incrementar la productividad de plantas como el banano [74].
Recientemente, nuestro grupo desarrolló un sistema de encapsulación de biocontroladores, usando quitosano como material para la elaboración nanopartículas con el fin de ser utilizadas en el control de nematodos principalmente de Radopholus similis. Diferentes filtrados metabólicos de Bacillus sp fueron encapsulados en las nanopartículas, mostrando una liberación de la carga a los 6 días de tratamiento y produciendo mortalidades entre el 40 % y 70 % de los nematodos en las pruebas en invernadero [75]. De acuerdo a los autores, el sistema formulado permitió mejorar la persistencia y la actividad biológica de los microorganismos, produciendo un control más eficaz de los nematodos. Actualmente, el grupo de trabajo orienta su investigación en la optimización de la formulación para aumentar su permeabilidad en las zonas afectadas de la planta.
Aunque en la mayoría de los casos el uso de pesticidas asegura la producción agrícola del cultivo de banano, el aumento de mejores prácticas agrícolas, una producción más ecológica y el uso de tecnologías más verdes, se proyecta en la industria bananera. La revisión evidencia que la introducción de materiales nanoestructurados para aplicaciones en las plantaciones de banano son necesarios y urgentes para lograr mayor productividad. Sin duda, estas estrategias están llamadas a impactar y así lograr una producción más integral, con impacto científico, ambiental y, con altas productividades para beneficio de los productores y para el desarrollo económico y social de los países que producen este cultivo.
Conclusiones
El estudio evidencia que existe una importante aplicación de sistemas nanostructurados en la agricultura y una diversidad de materiales, tanto sintéticos y naturales, con formas y tamaños diversos, que podrían potenciar el control de plagas y la productividad. Asimismo, las diferentes estrategias buscan contribuir con la aplicación de manera segura y sostenible de fertilizantes y plaguicidas convencionales y de origen natural. Las nanopartículas inorgánicas presentan diferentes ventajas, pero se ha realizado estudios donde dependiendo de la concentración y morfología puede generar efectos adversos en las plantas, sobre todo a nivel de toxicidad y pérdidas del crecimiento del cultivo generado por estrés oxidativo. La revisión evidencia una escasa aplicación de las NP`s en el cultivo de banano, limitándose a ensayos in vitro. Finalmente, el uso de matrices biodegradables para el encapsulamiento de agentes biocidas es una área emergente y con gran potencial para el sector agrícola.
Agradecimiento
A los recursos del fondo del proyecto: “Maestría en Ciencia y Tecnología para la Sostenibilidad” presentado a los fondos del sistema 2020, del Consejo Nacional de Rectores CONARE, según el acuerdo CNR-381-2019 del 7 de noviembre 2019. Por el aporte económico brindado.
Referencias
[1] V. Mohanraj and Y. Chen, “Nanoparticles: a review of particle toxicology following inhalation exposure,” Trop. J. Pharm. Res., vol. 5, no. 1, pp. 125-561–573135, Jun. 2006, doi: 10.3109/08958378.2010.642021.
[2] R. Muñoz-Espí, C. K. Weiss, and K. Landfester, “Inorganic nanoparticles prepared in miniemulsion,” Current Opinion in Colloid and Interface Science, vol. 17, no. 4. Elsevier Ltd, pp. 212–224, 2012. doi: 10.1016/j.cocis.2012.04.002.
[3] G. Salas, R. Costo, and M. del P. Morales, “Synthesis of Inorganic Nanoparticles,” vol. 4, 2012, pp. 35–79. doi: 10.1016/B978-0-12-415769-9.00002-9.
[4] R. Grillo, A. H. Rosa, and L. F. Fraceto, “Engineered nanoparticles and organic matter: A review of the state-of-the-art,” Chemosphere, vol. 119, pp. 608–619, 2015, doi: 10.1016/j.chemosphere.2014.07.049.
[5] M. Nasrollahzadeh, Z. Issaabadi, M. Sajjadi, S. M. Sajadi, and M. Atarod, Types of Nanostructures, 1st ed., vol. 28. Elsevier Ltd., 2019. doi: 10.1016/B978-0-12-813586-0.00002-X.
[6] V. Ghormade, M. V Deshpande, and K. M. Paknikar, “Perspectives for nano-biotechnology enabled protection and nutrition of plants,” Biotechnol. Adv., vol. 29, no. 6, pp. 792–803, 2011, doi: 10.1016/j.biotechadv.2011.06.007.
[7] A. H. Faraji and P. Wipf, “Nanoparticles in cellular drug delivery,” Bioorg. Med. Chem., vol. 17, no. 8, pp. 2950–2962, Apr. 2009, doi: 10.1016/j.bmc.2009.02.043.
[8] P. K. Rai et al., “Nanoparticle-plant interaction: Implications in energy, environment, and agriculture,” Environ. Int., vol. 119, no. April, pp. 1–19, Oct. 2018, doi: 10.1016/j.envint.2018.06.012.
[9] S. C. Capaldi Arruda, A. L. Diniz Silva, R. Moretto Galazzi, R. Antunes Azevedo, and M. A. Zezzi Arruda, “Nanoparticles applied to plant science: A review,” Talanta, vol. 131, pp. 693–705, Jan. 2015, doi: 10.1016/j.talanta.2014.08.050.
[10] M. Khater, A. de la Escosura-Muñiz, D. Quesada-González, and A. Merkoçi, “Electrochemical detection of plant virus using gold nanoparticle-modified electrodes,” Anal. Chim. Acta, vol. 1046, pp. 123–131, Jan. 2019, doi: 10.1016/j.aca.2018.09.031.
[11] M. Nasrollahzadeh, M. Atarod, M. Sajjadi, S. M. Sajadi, and Z. Issaabadi, “Plant-Mediated Green Synthesis of Nanostructures: Mechanisms, Characterization, and Applications,” in Interface Science and Technology, 1st ed., vol. 28, Elsevier Ltd., 2019, pp. 199–322. doi: 10.1016/B978-0-12-813586-0.00006-7.
[12] A. Pérez-de-Luque, “Interaction of nanomaterials with plants: What do we need for real applications in agriculture?,” Front. Environ. Sci., vol. 5, no. APR, pp. 1–7, 2017, doi: 10.3389/fenvs.2017.00012.
[13] E. Vázquez-núñez, M. L. López-moreno, G. De, R. Álvarez, and F. Fernández-luqueño, Agricultural Nanobiotechnology. Cham: Springer International Publishing, 2018. doi: 10.1007/978-3-319-96719-6.
[14] R. Ladj et al., “Polymer Encapsulation of Inorganic Nanoparticles for Biomedical Applications Authors:,” Int. J. Pharm., 2013, doi: 10.1016/j.ijpharm.2013.09.001.
[15] A. Pugazhendhi, T. N. J. I. Edison, I. Karuppusamy, and B. Kathirvel, “Inorganic nanoparticles: A potential cancer therapy for human welfare,” Int. J. Pharm., vol. 539, no. 1–2, pp. 104–111, Mar. 2018, doi: 10.1016/j.ijpharm.2018.01.034.
[16] A. S. C. Capaldi et al., “Nanoparticles applied to plant science: A review,” Talanta, vol. 131, pp. 693–705, 2015, doi: 10.1016/j.talanta.2014.08.050.
[17] P. Wang, E. Lombi, F. Zhao, and P. M. Kopittke, “Nanotechnology : A New Opportunity in Plant Sciences,” Trends Plant Sci., vol. 21, no. 8, pp. 699–712, 2016, doi: 10.1016/j.tplants.2016.04.005.
[18] Z. Li et al., “Study of UV-shielding properties of novel porous hollow silica nanoparticle carriers for avermectin,” vol. 246, no. December 2006, pp. 241–246, 2007, doi: 10.1002/ps.
[19] M. Linglan et al., “Rubisco activase mRNA expression in spinach: Modulation by nanoanatase treatment,” Biol. Trace Elem. Res., vol. 122, no. 2, pp. 168–178, 2008, doi: 10.1007/s12011-007-8069-4.
[20] E. H. Dehkourdi and M. Mosavi, “Effect of Anatase Nanoparticles ( TiO 2 ) on Parsley Seed Germination ( Petroselinum crispum ) In Vitro,” pp. 283–286, 2013, doi: 10.1007/s12011-013-9788-3.
[21] M. N. Khan, M. Mobin, Z. K. Abbas, K. A. AlMutairi, and Z. H. Siddiqui, “Role of nanomaterials in plants under challenging environments,” Plant Physiol. Biochem., vol. 110, pp. 194–209, Jan. 2017, doi: 10.1016/j.plaphy.2016.05.038.
[22] R. Nair, S. H. Varghese, B. G. Nair, T. Maekawa, Y. Yoshida, and D. S. Kumar, “Plant Science Nanoparticulate material delivery to plants,” Plant Sci., vol. 179, no. 3, pp. 154–163, 2010, doi: 10.1016/j.plantsci.2010.04.012.
[23] J. Young, K. Byung, and J. Geunhwa, “Antifungal Activity of Silver Ions and Nanoparticles on Phytopathogenic Fungi,” Plant Dis., vol. 93, no. 10, pp. 1037–1043, 2009, doi: 10.1094/PDIS-93-10-1037.
[24] J.-S. Min et al., “Effects of Colloidal Silver Nanoparticles on Sclerotium-Forming Phytopathogenic Fungi,” Plant Pathol. J., vol. 25, no. 4, pp. 376–380, Dec. 2009, doi: 10.5423/PPJ.2009.25.4.376.
[25] A. Strayer, I. Ocsoy, W. Tan, J. B. Jones, and M. L. Paret, “Low Concentrations of a Silver-Based Nanocomposite to Manage Bacterial Spot of Tomato in the Greenhouse,” Plant Dis., vol. 100, no. 7, pp. 1460–1465, Jul. 2016, doi: 10.1094/PDIS-05-15-0580-RE.
[26] I. Ocsoy et al., “Nanotechnology in plant disease management: DNA-directed silver nanoparticles on graphene oxide as an antibacterial against Xanthomonas perforans,” ACS Nano, vol. 7, no. 10, pp. 8972–8980, 2013, doi: 10.1021/nn4034794.
[27] J. J. Bello-Bello et al., “Hormetic Response by Silver Nanoparticles on In Vitro Multiplication of Sugarcane ( Saccharum spp. Cv. Mex 69-290) Using a Temporary Immersion System,” Dose-Response, vol. 15, no. 4, p. 155932581774494, Dec. 2017, doi: 10.1177/1559325817744945.
[28] C. de O. Timoteo et al., “In vitro growth of Physalis peruviana L. affected by silver nanoparticles,” 3 Biotech, vol. 9, no. 4, p. 145, Apr. 2019, doi: 10.1007/s13205-019-1674-z.
[29] I. Iavicoli, V. Leso, L. Fontana, and E. Calabrese, “Nanoparticle Exposure and Hormetic Dose–Responses: An Update,” Int. J. Mol. Sci., vol. 19, no. 3, p. 805, Mar. 2018, doi: 10.3390/ijms19030805.
[30] F. A. Strayer-Scherer., YY. Liao., M. Young., L. Ritchie., G. E. Vallad., S. Santra. and M. L. J.H., Clark, D., Jones, J. B., and Paret, “Advanced Copper Composites against Copper-Tolerant Xanthomonas perforans and Tomato Bacterial Spot,” Phytopathology, pp. 1–40, 2017.
[31] M. Shenashen, A. Derbalah, A. Hamza, A. Mohamed, and S. El Safty, “Antifungal activity of fabricated mesoporous silica nanoparticles against early blight of tomato,” Egypt. J. Basic Appl. Sci., vol. 5, no. 2, pp. 145–150, 2018, doi: 10.1016/j.ejbas.2018.05.002.
[32] K. J. Rao and S. Paria, “Use of sulfur nanoparticles as a green pesticide on Fusarium solani and Venturia inaequalis phytopathogens,” RSC Adv., vol. 3, no. 26, p. 10471, 2013, doi: 10.1039/c3ra40500a.
[33] W. H. Elmer and J. C. White, “The use of metallic oxide nanoparticles to enhance growth of tomatoes and eggplants in disease infested soil or soilless medium,” Environ. Sci. Nano, vol. 3, no. 5, pp. 1072–1079, 2016, doi: 10.1039/c6en00146g.
[34] W. Elmer et al., “Effect of Metalloid and Metal Oxide Nanoparticles on Fusarium Wilt of Watermelon,” Plant Dis., vol. 102, no. 7, pp. 1394–1401, Jul. 2018, doi: 10.1094/PDIS-10-17-1621-RE.
[35] I. O. Adisa et al., “Role of Cerium Compounds in Fusarium Wilt Suppression and Growth Enhancement in Tomato ( Solanum lycopersicum ),” J. Agric. Food Chem., vol. 66, no. 24, pp. 5959–5970, Jun. 2018, doi: 10.1021/acs.jafc.8b01345.
[36] H. Chu et al., “A nanosized Ag-silica hybrid complex prepared by γ-irradiation activates the defense response in Arabidopsis,” Radiat. Phys. Chem., vol. 81, no. 2, pp. 180–184, 2012, doi: 10.1016/j.radphyschem.2011.10.004.
[37] R. Gogoi, “Suitability of Nano-sulphur for Biorational Management of Powdery mildew of Okra (Abelmoschus esculentus Moench) caused by Erysiphe cichoracearum,” J. Plant Pathol. Microbiol., vol. 04, no. 04, 2013, doi: 10.4172/2157-7471.1000171.
[38] A. H. Wani and M. A. Shah, “A unique and profound effect of MgO and ZnO nanoparticles on some plant pathogenic fungi,” J. Appl. Pharm. Sci., vol. 2, no. 3, pp. 40–44, 2012, doi: 10.7324/JAPS.2012.2307.
[39] T. N. V. K. V. Prasad et al., “EFFECT OF NANOSCALE ZINC OXIDE PARTICLES ON THE GERMINATION, GROWTH AND YIELD OF PEANUT,” J. Plant Nutr., vol. 35, no. 6, pp. 905–927, Apr. 2012, doi: 10.1080/01904167.2012.663443.
[40] H. Guan, D. Chi, J. Yu, and X. Li, “A novel photodegradable insecticide : Preparation , characterization and properties evaluation of nano-Imidacloprid,” vol. 92, pp. 83–91, 2008, doi: 10.1016/j.pestbp.2008.06.008.
[41] A. Ranjan, V. D. Rajput, T. Minkina, T. Bauer, A. Chauhan, and T. Jindal, “Nanoparticles induced stress and toxicity in plants,” Environ. Nanotechnology, Monit. Manag., vol. 15, no. December 2020, p. 100457, May 2021, doi: 10.1016/j.enmm.2021.100457.
[42] M. Rizwan et al., “Effects of nanoparticles on trace element uptake and toxicity in plants: A review,” Ecotoxicol. Environ. Saf., vol. 221, p. 112437, Sep. 2021, doi: 10.1016/j.ecoenv.2021.112437.
[43] W. Zhang, J. Long, J. Geng, J. Li, and Z. Wei, “Impact of Titanium Dioxide Nanoparticles on Cd Phytotoxicity and Bioaccumulation in Rice (Oryza sativa L.),” Int. J. Environ. Res. Public Health, vol. 17, no. 9, p. 2979, Apr. 2020, doi: 10.3390/ijerph17092979.
[44] L. Tostado, Atlas de los Pesticidas, Primera. Berlin: Fundación Heinrich Böll, 2023. [Online]. Available: https://www.dw.com/es/atlas-de-los-pesticidas-la-huella-de-un-negocio-tóxico-en-el-mundo/a-60428078
[45] V. Saharan et al., “Synthesis and in vitro antifungal efficacy of Cu-chitosan nanoparticles against pathogenic fungi of tomato,” in International Journal of Biological Macromolecules, vol. 75, Elsevier B.V., 2015, pp. 346–353. doi: 10.1016/j.ijbiomac.2015.01.027.
[46] H. Chhipa, “Nanofertilizers and nanopesticides for agriculture,” Environ. Chem. Lett., vol. 15, no. 1, pp. 15–22, 2017, doi: 10.1007/s10311-016-0600-4.
[47] R. Raliya et al., “Cu-chitosan nanoparticle boost defense responses and plant growth in maize (Zea mays L.),” Sci. Rep., vol. 7, no. 1, pp. 1–11, 2017, doi: 10.1038/s41598-017-08571-0.
[48] R. Grillo, N. Z. P. dos Santos, C. R. Maruyama, A. H. Rosa, R. de Lima, and L. F. Fraceto, “Poly(ɛ-caprolactone) nanocapsules as carrier systems for herbicides: Physico-chemical characterization and genotoxicity evaluation,” J. Hazard. Mater., vol. 231–232, pp. 1–9, Sep. 2012, doi: 10.1016/j.jhazmat.2012.06.019.
[49] M. aJ Villaseñor and Á. Ríos, “Nanomaterials for water cleaning and desalination, energy production, disinfection, agriculture and green chemistry,” Environ. Chem. Lett., vol. 16, no. 1, pp. 11–34, 2018, doi: 10.1007/s10311-017-0656-9.
[50] A. L. Boehm, I. Martinon, R. Zerrouk, E. Rump, and H. Fessi, “Nanoprecipitation technique for the encapsulation of agrochemical active ingredients,” J. Microencapsul., vol. 20, no. 4, pp. 433–441, Jan. 2003, doi: 10.1080/0265204021000058410.
[51] Y. Liu, Z. Tong, and R. K. Prud’homme, “Stabilized polymeric nanoparticles for controlled and efficient release of bifenthrin,” Pest Manag. Sci., vol. 64, no. 8, pp. 808–812, Aug. 2008, doi: 10.1002/ps.1566.
[52] Y. Liu, L. Yan, P. Heiden, and P. Laks, “Use of nanoparticles for controlled release of biocides in solid wood,” J. Appl. Polym. Sci., vol. 79, no. 3, pp. 458–465, Jan. 2001, doi: 10.1002/1097-4628(20010118)79:3<458::AID-APP80>3.0.CO;2-H.
[53] E. V. Campos Ramos et al., “Polymeric and solid lipid nanoparticles for sustained release of carbendazim and tebuconazole in agricultural applications,” Sci. Rep., vol. 5, no. 1, p. 13809, Nov. 2015, doi: 10.1038/srep13809.
[54] A. E. S. Pereira, R. Grillo, N. F. S. Mello, A. H. Rosa, and L. F. Fraceto, “Application of poly(epsilon-caprolactone) nanoparticles containing atrazine herbicide as an alternative technique to control weeds and reduce damage to the environment,” J. Hazard. Mater., vol. 268, pp. 207–215, Mar. 2014, doi: 10.1016/j.jhazmat.2014.01.025.
[55] H. C. Oliveira, R. Stolf-Moreira, C. B. R. Martinez, R. Grillo, M. B. de Jesus, and L. F. Fraceto, “Nanoencapsulation enhances the post-emergence herbicidal activity of atrazine against mustard plants,” PLoS One, vol. 10, no. 7, p. e0132971, Jul. 2015, doi: 10.1371/journal.pone.0132971.
[56] O. Rojas, M. Moya, M. Sibaja, C. Ruepert, and J. Vega-Baudrit, “Estudio de la liberación controlada de plaguicidas incorporados en hidrogeles de ácido itacónico,” Rev. Iberoam. polímeros, vol. 5, no. 3, pp. 133–143, 2004.
[57] M. R. Forim, E. S. Costa, M. F. das G. F. da Silva, J. B. Fernandes, J. M. Mondego, and A. L. Boiça Junior, “Development of a New Method To Prepare Nano-/microparticles Loaded with Extracts of Azadirachta indica, Their Characterization and Use in Controlling Plutella xylostella,” J. Agric. Food Chem., vol. 61, no. 38, pp. 9131–9139, Sep. 2013, doi: 10.1021/jf403187y.
[58] F.-L. Yang, X.-G. Li, F. Zhu, and C.-L. Lei, “Structural Characterization of Nanoparticles Loaded with Garlic Essential Oil and Their Insecticidal Activity against Tribolium castaneum (Herbst) (Coleoptera: Tenebrionidae),” J. Agric. Food Chem., vol. 57, no. 21, pp. 10156–10162, Nov. 2009, doi: 10.1021/jf9023118.
[59] P. Mondal, R. Kumar, and R. Gogoi, “Azomethine based nano-chemicals: Development, in vitro and in vivo fungicidal evaluation against Sclerotium rolfsii, Rhizoctonia bataticola and Rhizoctonia solani,” Bioorg. Chem., vol. 70, pp. 153–162, 2017, doi: 10.1016/j.bioorg.2016.12.006.
[60] S. Pradhan et al., “Entomotoxicity and biosafety assessment of PEGylated acephate nanoparticles: A biologically safe alternative to neurotoxic pesticides,” J. Environ. Sci. Heal. - Part B Pestic. Food Contam. Agric. Wastes, vol. 48, no. 7, pp. 559–569, 2013, doi: 10.1080/03601234.2013.774891.
[61] Sandhya, S. Kumar, D. Kumar, and N. Dilbaghi, “Preparation, characterization, and bio-efficacy evaluation of controlled release carbendazim-loaded polymeric nanoparticles,” Environ. Sci. Pollut. Res., vol. 24, no. 1, pp. 926–937, Jan. 2017, doi: 10.1007/s11356-016-7774-y.
[62] C. R. Maruyama, N. Bilesky-José, R. de Lima, and L. F. Fraceto, “Encapsulation of Trichoderma harzianum Preserves Enzymatic Activity and Enhances the Potential for Biological Control,” Front. Bioeng. Biotechnol., vol. 8, no. March, pp. 1–14, 2020, doi: 10.3389/fbioe.2020.00225.
[63] C. Sun et al., “Encapsulation and controlled release of hydrophilic pesticide in shell cross-linked nanocapsules containing aqueous core,” Int. J. Pharm., vol. 463, no. 1, pp. 108–114, 2014, doi: 10.1016/j.ijpharm.2013.12.050.
[64] M. G. Paulraj et al., “Comparative studies of tripolyphosphate and glutaraldehyde cross-linked chitosan-botanical pesticide nanoparticles and their agricultural applications,” Int. J. Biol. Macromol., vol. 104, pp. 1813–1819, 2017, doi: 10.1016/j.ijbiomac.2017.06.043.
[65] J. L. De Oliveira et al., “Geraniol Encapsulated in Chitosan/Gum Arabic Nanoparticles: A Promising System for Pest Management in Sustainable Agriculture,” J. Agric. Food Chem., vol. 66, no. 21, pp. 5325–5334, 2018, doi: 10.1021/acs.jafc.8b00331.
[66] F. M. Pelissari, P. J. do A. Sobral, and F. C. Menegalli, “Isolation and characterization of cellulose nanofibers from banana peels,” Cellulose, vol. 21, no. 1, pp. 417–432, Feb. 2014, doi: 10.1007/s10570-013-0138-6.
[67] S. Majumder and S. Johari, “Development of a gold-nano particle based novel dot immunobinding assay for rapid and sensitive detection of Banana bunchy top virus,” J. Virol. Methods, vol. 255, pp. 23–28, May 2018, doi: 10.1016/j.jviromet.2018.01.015.
[68] S. Galdiero, A. Falanga, M. Vitiello, M. Cantisani, V. Marra, and M. Galdiero, “Silver nanoparticles as potential antiviral agents,” Molecules, vol. 16, no. 10, pp. 8894–8918, 2011, doi: 10.3390/molecules16108894.
[69] E. K. F. Elbeshehy, A. M. Elazzazy, and G. Aggelis, “Silver nanoparticles synthesis mediated by new isolates of Bacillus spp., nanoparticle characterization and their activity against Bean Yellow Mosaic Virus and human pathogens,” Front. Microbiol., vol. 6, no. MAY, pp. 1–13, 2015, doi: 10.3389/fmicb.2015.00453.
[70] C. Lustriane, F. M. Dwivany, V. Suendo, and M. Reza, “Effect of chitosan and chitosan-nanoparticles on post harvest quality of banana fruits,” J. Plant Biotechnol., vol. 45, no. 1, pp. 36–44, 2018, doi: 10.5010/JPB.2018.45.1.036.
[71] M. N. Helaly, M. A. El-Metwally, H. El-Hoseiny, S. A. Omar, and N. I. El-Sheery, “Effect of nanoparticles on biological contamination of in vitro cultures and organogenic regeneration of banana,” Aust. J. Crop Sci., vol. 8, no. 4, pp. 612–624, 2014.
[72] D. Giap, T. K. Thuy, T. H. Trang, T. Duoc, T. Tuan, and D. Hieu, “Effects of nano silver on the growth of banana ( Musa spp .) cultured in vitro,” J. Vietnamese Environ., vol. 10, no. 2, pp. 92–98, 2018, doi: 10.13141/jve.vol10.no2.pp92-98.
[73] H. M. H. Salama, “Effects of silver nanoparticles in some crop plants, common bean (Phaseolus vulgaris L.) and corn (Zea mays L.),” Int. Res. J. Biotechnol., vol. 3, no. 10, pp. 190–197, 2012.
[74] N. Vidyalakshmi, R. Thomas, R. Aswani, G. P. Gayatri, E. K. Radhakrishnan, and A. Remakanthan, “Comparative analysis of the effect of silver nanoparticle and silver nitrate on morphological and anatomical parameters of banana under in vitro conditions,” Inorg. Nano-Metal Chem., vol. 47, no. 11, pp. 1530–1536, Nov. 2017, doi: 10.1080/24701556.2017.1357605.
[75] H. Ureña-Saborío, S. Madrigal-Carballo, J. Sandoval, J. R. Vega-Baudrit, and A. Rodríguez-Morales, “Encapsulation of bacterial metabolic infiltrates isolated from different Bacillus strains in chitosan nanoparticles as potential green chemistry-based biocontrol agents against Radopholus similis,” J. Renew. Mater., vol. 5, no. 3, pp. 290–299, Jul. 2017, doi: 10.7569/JRM.2017.634119.
1 Centro Nacional de Innovación en Biotecnología (CENIBiot), CeNAT-CONARE. Costa Rica.
 jorgearayam23@gmail.com
jorgearayam23@gmail.com https://orcid.org/0000-0001-9809-0005
https://orcid.org/0000-0001-9809-00052 Laboratorio de Investigación en Biocontrol, Corporación Bananera Nacional (CORBANA). Costa Rica.
 jsandoval@corbana.co.cr
jsandoval@corbana.co.cr3 Laboratorio de Investigación y Tecnología de Polímeros, Escuela de Química, Universidad Nacional (UNA). Costa Rica.
 oscar.rojas.carrillo@una.cr
oscar.rojas.carrillo@una.cr