Desarrollo de un protocolo para producir quitosano a partir de la exuvia larval de Tenebrio molitor
Development of a protocol to produce chitosan from the larval exuvia of Tenebrio molitor
Itnan Vargas-Venegas1, Alejandro Medaglia-Mata2, Laura Chavarría-Pizarro3
Fecha de recepción: 15 de agosto, 2023
Fecha de aprobación: 28 de noviembre, 2023
Vargas-Venegas, I; Medaglia-Mata, A; Chavarría-Pizarro, L. Desarrollo de un protocolo para producir quitosano a partir de la exuvia larval de Tenebrio molitor. Tecnología en Marcha. Vol. 37, No 3. Julio-Setiembre, 2024. Pág. 3-16. https://doi.org/10.18845/tm.v37i2.6724
https://doi.org/10.18845/tm.v37i2.6724
Palabras clave
Polímeros; biomateriales; insectos; revalorización de desechos; procesamiento químico.
Resumen
Muchos de los polímeros que son utilizados actualmente en la industria, investigación y otras áreas no son fácilmente biodegradables. Estos polímeros la mayoría de las veces suelen ser derivados del petróleo, lo que implica un gran impacto ambiental en su producción. El quitosano actúa como una materia prima alternativa, con el potencial de reemplazar distintos materiales gracias a sus propiedades, sin embargo, la mayor parte del quitosano industrial es extraído de desechos de especies marinas procesadas para la industria alimentaria, lo que hace que su extracción sea poco escalable y dependiente de las estaciones donde se pescan estas especies, además de tener un alto contenido en minerales, los cuales son difíciles de remover.
Es posible obtener quitosano de insectos, de manera más escalable y no dependiente de las estaciones de pesca. En el presente estudio, se desarrolló un protocolo para obtener quitosano de las exuvias larvales de la especie Tenebrio molitor, a partir de un procesamiento químico donde se desproteinizan y demineralizan estos desechos para transformarlos en quitina, y posteriormente de desacetila para transformala en quitosano.
Al procesar las mudas de las larvas, y tras distintos cambios al protocolo de extracción, se logró obtener un rendimiento global de un 13.01% de la masa total de la materia prima utilizada. Así mismo, se evidenció mediante espectros infrarrojos (FTIR) la transformación de las exuvias larvales hacia quitosano. Finalmente, se confirmó que el producto obtenido era quitosano mediante un perfil termogravimétrico (TGA) y se observaron diferencias morfológicas entre las mudas de larvas, el quitosano obtenido y el quitosano comercial mediante microscopía electrónica de barrido.
Keywords
Polymers; biomaterials; insects; waste revaluation; chemical processing.
Abstract
Many of the polymers currently used in industry, research, and other fields are not easily biodegradable. These polymers most of the time are derived from petroleum, which has a significant environmental impact in their production. Chitosan serves as an alternative raw material with the potential of replacing various materials due to its properties. However, most of the industrial chitosan is extracted from waste generated by marine species processed for the food industry, making its extraction process non-scalable and dependent on the seasons when these species are caught. Additionally, industrial chitosan often has a high mineral content that is difficult to remove.
It is possible to obtain chitosan from insects in a more scalable and season-independent manner. In this study, a protocol was developed to obtain chitosan from the exuviae of larvae from the species Tenebrio molitor. The process involves chemical treatment to deproteinize and demineralize these waste materials to convert them into chitin. Subsequently, deacetylation is carried out to transform chitin into chitosan.
By processing the larval exuviae and making various modifications to the extraction protocol, an overall yield of 13.01% of the total mass of the raw material used was achieved. The transformation of larval exuviae into chitosan was confirmed through infrared spectroscopy (FTIR). Finally, the obtained product was confirmed to be chitosan through thermogravimetric analysis (TGA), and morphological differences were observed between the larval exuviae, the obtained chitosan, and commercial chitosan using scanning electron microscopy.
Introducción
Muchos de los polímeros que son utilizados actualmente en la industria, investigación y otras áreas, conllevan procesos complicados para su eliminación, ya que no son fácilmente biodegradables [1] [2]. Además, estos polímeros suelen ser derivados del petróleo, lo que implica un gran impacto ambiental en su producción, acompañado de un constante aumento en el precio de esta materia prima [2]. Por tanto, surge la creciente necesidad de obtener polímeros menos contaminantes, económicos y derivados de recursos renovables [3].
Dentro de este contexto, la quitina actúa como una materia prima alternativa, capaz de sustituir distintos materiales gracias a sus propiedades. La quitina es el segundo polisacárido más abundante de la naturaleza, después de la celulosa, y es encontrada en gran diversidad de especies, incluyendo algas, hongos, crustáceos e insectos [4]. Este polisacárido es bastante difícil de manipular y utilizar debido a su solubilidad y a su poca reactividad, pues solamente es soluble en medios muy ácidos [5]. Sin embargo, por medio de un proceso de desacetilación parcial de la quitina, es posible obtener quitosano, el cual aumenta su solubilidad en agua y reactividad general, facilitando su uso en distintas aplicaciones [6].
El quitosano es un polímero formado por cadenas de 2-amino-2-desoxi-D-glucopiranosa y 2-acetamida-2-desoxi-D-glucopiranosa unidas mediante enlaces glicosídicos β-(1,4) [7], cuyas propiedades pueden variar dependiendo del método de extracción utilizado y de la fuente utilizada [8]. La mayor parte de la quitina industrial extraída proviene de desechos marinos de la industria alimenticia, principalmente de caparazones de crustáceos como cangrejos, camarones y krill, los cuales están compuestos aproximadamente de un 30% a 40% de proteínas, 30% a 50% de carbonato de calcio y 20% a 30% de quitina, con variaciones entre especies y estaciones [9]. A pesar de que la extracción de quitina a partir de estos desechos representa una gran alternativa para el manejo de desechos en la industria alimenticia, resulta poco escalable y dependiente de otros mercados, además, su composición presenta grandes porcentajes de minerales, los cuales deben ser eliminados para la extracción de la quitina y síntesis de quitosano, por lo que es importante explorar alternativas no contaminantes, independientes, escalables y con mayor posibilidad de obtener un producto más puro.
Una de estas alternativas es la extracción de quitina/quitosano proveniente de insectos, los cuales poseen bajos porcentajes de humedad, cenizas y minerales; esto facilitaría el proceso de extracción, requiriendo concentraciones menores de los reactivos utilizados y manteniendo así la integridad del material, obteniéndose un producto mejor conservado [9] [10]. Aunque la desmineralización es un proceso clave para purificar la quitina, se ha demostrado que, en ocasiones, la concentración de minerales en insectos es tan baja, que no es necesario realizar una desmineralización para obtener quitosano [11] [12].
Otra ventaja que representa el uso de insectos para la extracción de quitina/quitosano es su escalabilidad, pues es posible criar distintos insectos en espacios reducidos y obtener sus cuerpos o exuvias de sus distintas etapas de desarrollo para tal objetivo. Tal es el caso de la especie Tenebrio molitor, la cual se alimenta de desechos orgánicos como frutas y verduras, y es incluso utilizada de manera casera para producir compost orgánico [13] [14]. El exoesqueleto y exuvias de los escarabajos, en sus distintas fases de vida, está constituido principalmente por proteínas, carbohidratos (principalmente quitina), catecoles y un pequeño porcentaje de lípidos [15].
Por los motivos expuestos anteriormente, el presente proyecto plantea el desarrollo de un protocolo de extracción y purificación de quitina de las exuvias de larvas de la especie Tenebrio molitor, para posteriormente realizar una desacetilación parcial y producir quitosano, en miras de utilizarlo para futuros proyectos.
Metodología
La extracción de quitina y síntesis de quitosano se resume en tres procedimientos: desproteinización, desmineralización y desacetilación. La desproteinización de la quitina es un proceso complejo que consiste en utilizar medios básicos para romper los enlaces químicos entre las proteínas y las moléculas de quitina, para esto, se han utilizado una gran cantidad de medios, entre los cuales se incluyen el NaOH, Na2CO3, NaHCO3, KOH, K2CO3, Ca(OH)2, Na2SO3, NaHSO3, CaHSO3, Na3PO4 y el Na2S, sin embargo, el más utilizado y efectivo ha sido el NaOH, en concentraciones entre 0.125 a 5.0M, a distintas temperaturas y tiempos, dependiendo de la fuente de la biomasa [16] [17]. Además, pueden ocurrir algunos efectos esperados, como una desacetilación parcial de la quitina y la permanencia de algunas proteínas que no fueron desacomplejadas durante el lavado [17].
Por otro lado, la desmineralización consiste en la separación de minerales mediante un lavado a la quitina con una solución ácida, entre las cuales se han utilizado tanto ácidos orgánicos como inorgánicos, incluyendo HCl, HNO3, H2SO4, CH3COOH y otros, siendo el HCl el más utilizado, a concentraciones entre 0.275 a 2M, a tiempos mínimos de 1 hora y máximos de 48 horas y temperaturas no mayores a 100°C [17] [18]. Generalmente, la principal concentración de minerales en la quitina es de CaCO3, y este es degradado mediante la siguiente fórmula [17]:
2HCl + CaCO3 → CaCl2 + H2O + CO2↑
Además, tras el proceso de desacetilación de la quitina (cuando pasa a ser quitosano), es posible conocer las características y pureza del quitosano extraído mediante distintos análisis fisicoquímicos, incluyendo la espectroscopía, calorimetría, viscosimetría, y otros análisis [19].
Para extraer el quitosano a partir de las mudas de larvas Tenebrio molitor, se utilizó la metodología propuesta por Song et al. [20], ligeramente modificada. El procedimiento se describe a continuación:
Primero, 30 gramos de exuvia larval fueron secados en estufa a 30°C por 48 horas. Tras ese tiempo, se realizaron varios lavados con agua destilada hasta que el agua utilizada se observó limpia, esto se hizo para remover cualquier impureza superficial que pudiera tener la muestra. Para desproteinizar la muestra, se lavó en una solución de NaOH al 1M por 3 horas a 95°C en agitación. Seguidamente, se filtró al vacío, se hicieron lavados con agua destilada hasta neutralizar el pH, y se volvió a filtrar al vacío para posteriormente dejarlo secando en estufa a 30°C por 1 hora.
Luego, para desmineralizar la muestra, se lavó en una solución de HCl al 1M por 3 horas a 20°C en agitación. Seguidamente, se filtró al vacío, se hicieron lavados con agua destilada hasta neutralizar el pH, y se volvió a filtrar al vacío para posteriormente dejarlo secando en estufa a 30°C por 1 hora. A partir de este punto, el residuo es conocido como quitina. Para transformar la quitina a quitosano, se deberá realizar una desacetilación de la muestra, mediante un lavado con NaOH al 12.5M por 5 horas a 105°C en agitación. Seguidamente, se filtró al vacío, se hicieron lavados con agua destilada hasta neutralizar el pH, y se volvió a filtrar al vacío para posteriormente dejarlo secando en estufa a 30°C por 1 hora.
Del peso seco total de la muestra utilizada, se esperó obtener aproximadamente un 18% de quitina y tras desacetilarla, el producto sería de aproximadamente un 9% de quitosano, con un porcentaje de desacetilación cercano al 50%. Además, cada extracción de quitina y transformación a quitosano se realizó por duplicado. Finalmente, el quitosano obtenido, así como un quitosano comercial de peso molecular medio que funcionó como patrón, fueron sometidos a espectroscopía infrarroja por transformada de Fourier (FTIR) (Thermo Scientific Nicolet 380) por cada etapa de la extracción de quitina y síntesis de quitosano para comprender cómo se transforma la quitina en quitosano. También se sometieron a análisis termogravimétricos (TGA) (TA Instruments SDT Q600) para confirmar la estructura del producto obtenido y verificar su estabilidad térmica. Además, Se utilizó un microscopio electrónico de barrido (Hitachi TM3000) para observar la microestructura y morfología del producto obtenido.
Resultados
Extracción de quitina y producción de quitosano a partir de las mudas de larvas T. molitor
Para el procesamiento de las mudas de larvas de T. molitor (Materia prima) para la extracción de quitina y síntesis de quitosano, se pesaron 500mg de material y se le realizaron una serie de lavados en agitación constante (500rpm), con el volumen necesario para cubrir la muestra; secando en estufa a 70°C por 1h, equilibrando el pH entre 6 a 7 y filtrando al vacío entre cada lavado. Se siguió el protocolo propuesto por Song [20], con ligeras modificaciones. Se inició con un lavado de agua destilada al material para eliminar cualquier contaminación superficial, seguido de un lavado con NaOH 1M por 3 horas y a 100°C, para eliminar proteínas. Seguidamente, se realizó una desmineralización con HCl 1M por 3h y a temperatura ambiente, donde se obtuvo la quitina. Para la síntesis de quitosano, se procedió a desacetilar la quitina mediante un lavado de NaOH 12.5M por 5 horas a 100°C.
Cuadro 1. Masa Desproteinización (DP), desmineralización (DM), desacetilación (DA) y rendimiento de síntesis de quitosano, tras procesar químicamente las mudas de larvas de T. molitor (mg).
|
Repetición |
Materia prima |
Lavado |
DP |
DM |
DA |
Rendimiento Global |
|
1 |
514.2 |
398.6 |
226.2 |
193.4 |
37.6 |
7.31% |
|
2 |
533.4 |
410.1 |
250.6 |
200.4 |
69.45 |
13.01% |
En la primera extracción de quitosano y síntesis de quitina realizada (Repetición 1) el rendimiento fue muy escaso (7.31%), comparado al reportado en literatura, el cual se encuentra alrededor de 9.20% [20]. Además, se veían daños morfológicos significativos en la estructura del material, causados por la larga exposición a la base concentrada (12.5M), durante el proceso de desacetilación. Además, se puede observar cómo en esta misma etapa se tuvo la mayor pérdida de masa entre etapas, disminuyendo un 80.56% de la masa total obtenida después de la desmineralización (Cuadro 1).
Para tener un mayor rendimiento se redujo el tiempo de desacetilación de 5h a 3h (Repetición 2), ya que distintos autores han obtenido mayores rendimientos de quitosano, proveniente de insectos, realizando la desacetilación por tiempos de 3h o menos [19]. Tras hacer la modificación en el tiempo de la etapa de desacetilación, se obtuvo una menor pérdida de masa entre la etapa de desmineralización y la etapa de desacetilación, siendo ahora un 65.34%. Por ende, se obtuvo un mayor rendimiento de síntesis de quitosano, siendo este un 13.01% de la masa total de la materia prima utilizada, acercándose más a los rendimientos reportados en literatura mencionados previamente.
Descripción fisicoquímica de las propiedades del quitosano obtenido
Como se mencionó anteriormente, para identificar y caracterizar la síntesis de quitosano realizada, se realizaron distintos análisis físicoquímicos, comparando el producto obtenido con un quitosano comercial de peso molecular medio. Específicamente, se realizaron espectros infrarrojos por transformada de Fourier (FTIR), análisis termogravimétricos (TGA) y observación en microscopía electrónica de barrido (SEM).
Espectroscopía infrarroja por transformada de Fourier (FTIR)
Se realizó un análisis de espectroscopía infrarroja por transformada de Fourier (Thermo Scientific Nicolet 380) por cada etapa de la extracción de quitina y síntesis de quitosano (Figura 1), para comprender cómo afecta cada una de estas al material en cuestión. Además, el espectro del producto obtenido permite confirmar la estructura química del quitosano sintetizado a partir de las mudas de larvas de T. molitor, mediante la identificación de bandas características de este material, comparando su espectro con el de un quitosano comercial de peso molecular medio (Figura 2).
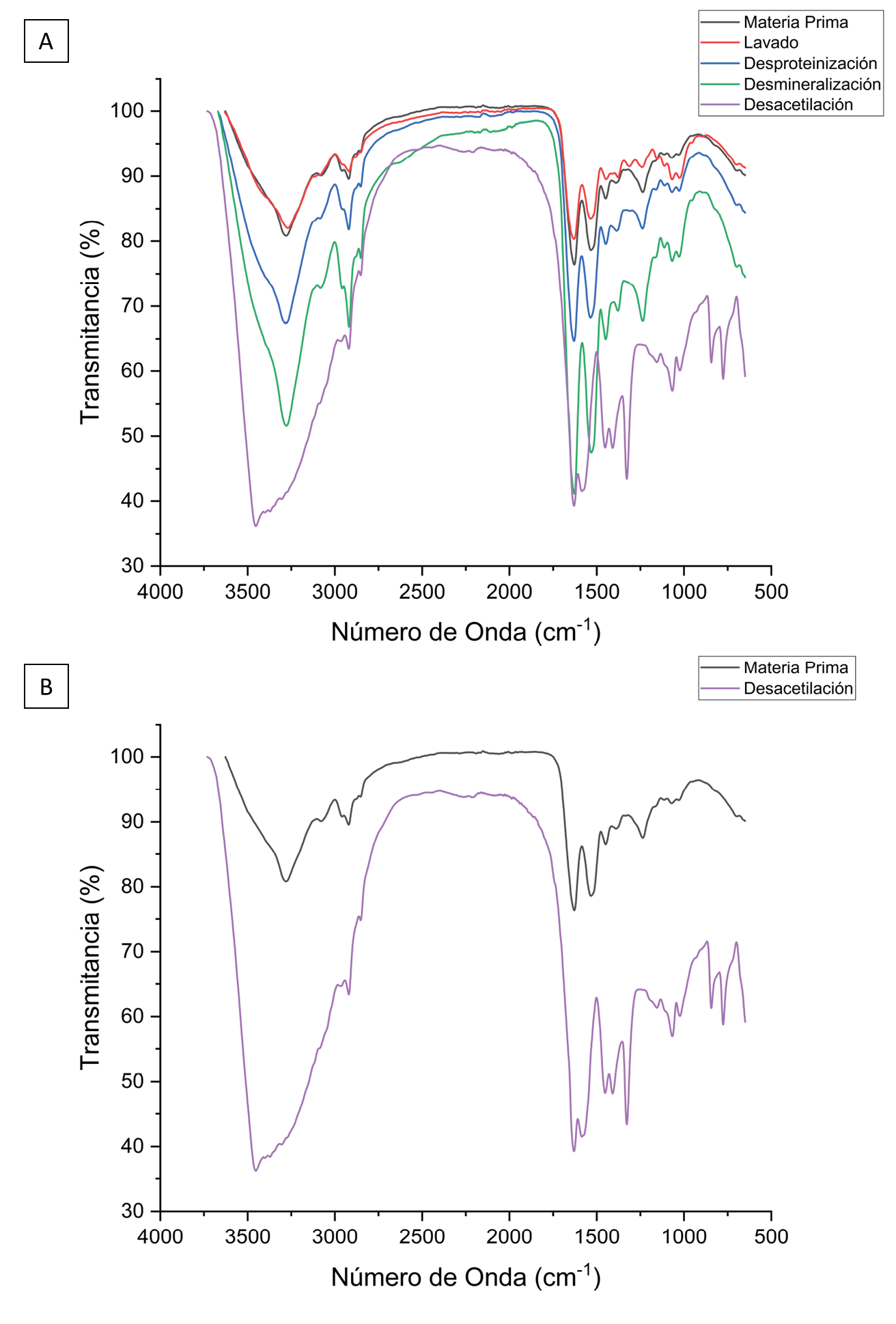
Figura 1. Espectroscopía infrarroja por transformada de Fourier (FTIR) de (A) las diferentes etapas del proceso de síntesis de quitosano a partir de mudas de larva de T. molitor y (B) comparación únicamente entre los espectros de la materia prima utilizada y el producto final obtenido
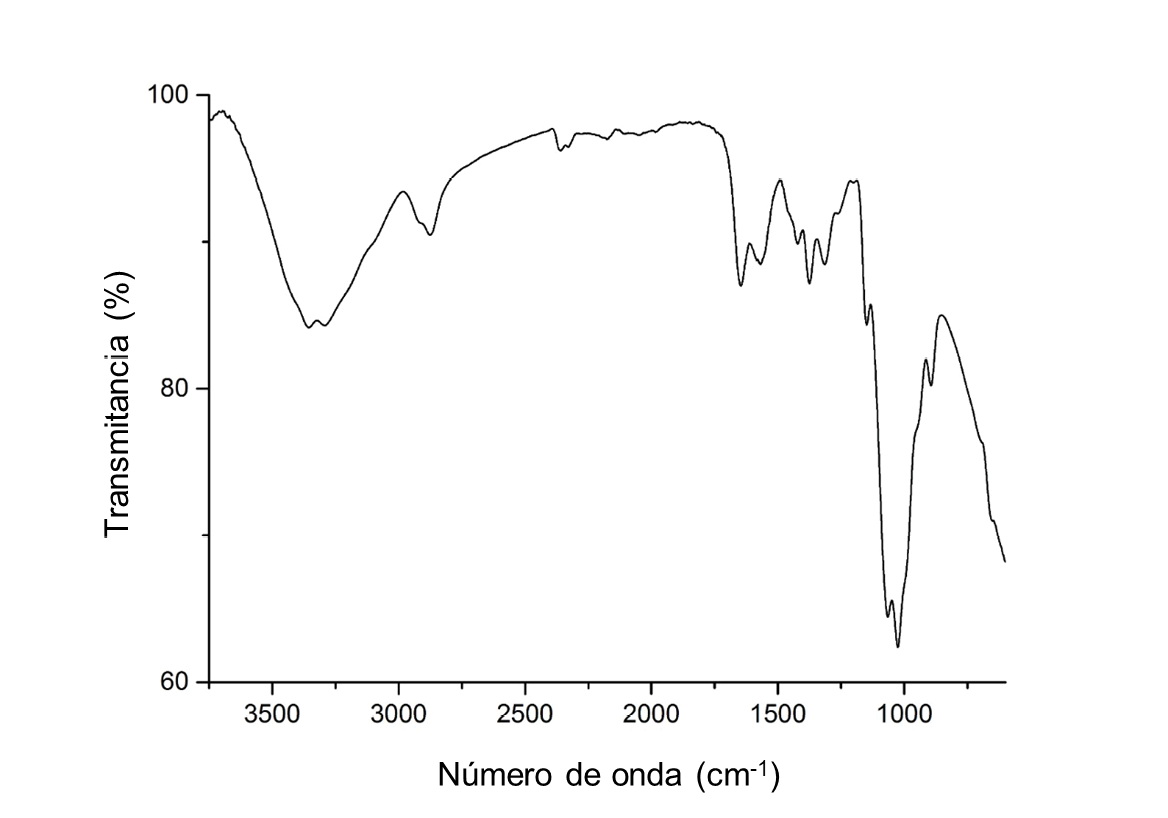
Figura 2. Espectroscopía infrarroja por transformada de Fourier (FTIR) del quitosano comercial de peso molecular medio
Análisis termogravimétricos (TGA)
Se realizaron análisis termogravimétricos (TA Instruments SDT Q600) para confirmar la estructura del producto obtenido y verificar su estabilidad térmica, al compararla con la materia prima utilizada y un quitosano comercial de peso molecular medio (Figura 3). La rampa de calentamiento del equipo fue desde temperatura ambiente hasta los 400°C, con una tasa de calentamiento de 10°C/min, bajo una atmósfera de nitrógeno con un flujo de 100mL/min.

Figura 3. Análisis termogravimétricos (TGA) de (A) mudas de larvas de T. molitor (B) quitosano comercial de peso molecular medio y (C) quitosano extraído de mudas de larvas de T. molitor
Microscopía electrónica de barrido (SEM)
Se utilizó un microscopio electrónico de barrido (Hitachi TM3000) para observar la microestructura y morfología del producto obtenido, así como de la materia prima y un quitosano comercial de peso molecular medio a 200x y 1000x (Figura 4). Las muestras fueron recubiertas con una delgada capa de oro-paladio para mejorar su conductividad eléctrica y que, de este modo, se pudieran ver bajo el microscopio electrónico.

Figura 4. Microscopía electrónica de barrido (SEM) de (A) mudas de larvas de T. molitor a 200x y (B) 1000x, (C) quitosano comercial de peso molecular medio a 200x y (D) 1000x y (E) quitosano extraído de mudas de larvas de T. molitor a 200x y (F) 1000x
Variación de las propiedades del quitosano obtenido, modificando el protocolo de extracción
Al realizar la modificación del tiempo en la etapa de desacetilación, se logró obtener un mayor rendimiento de quitosano, además de un mejor aspecto general en la morfología del material.
Discusión
Descripción fisicoquímica del quitosano obtenido
Según los resultados obtenidos, la banda ancha cerca de los 3500cm-1 de la Figura 1B indica la presencia de grupos hidroxilo (OH) [21], siendo estos mucho más notorios en la quitina que en el quitosano, al estar más expuestos. Así mismo, en la Figura 1A, se identifica cómo en cada etapa del tratamiento se van atenuando cada vez más estos grupos, exceptuando la etapa de lavado, pues como se mencionó anteriormente, esta es una etapa únicamente para eliminar las impurezas superficiales de la materia prima.
Por otro lado, cerca de los 2890cm-1, se puede ver en la quitina una ligera banda característica del enlace CH2, propiamente cuando se encuentra en los grupos CH2OH [22]. En el caso del quitosano, esta banda se ve mucho más atenuada, debido a la pérdida de estos grupos durante el proceso de desacetilación. Además, se observa cerca de 1630cm-1 la banda respectiva a los enlaces C=O de la amida primaria, los cuales están más atenuados en el producto, ya que también se pierden con la desacetilación. Finalmente, se identifican también bandas características del quitosano en 1420, 1315 y 1080cm-1, pertenecientes a enlaces CH2, CN y COC [23], siendo estos mucho más atenuados en el producto obtenido que en la quitina, ya que estos enlaces se encuentran en los grupos acetilo que se eliminan. De esta manera, y al comparar el espectro del producto obtenido con el espectro del patrón de quitosano de peso molecular medio, se confirma la transformación de la materia prima en quitina y, posteriormente, en quitosano.
En los termogramas (TGA) de las tres muestras se pueden identificar dos etapas de descomposición principales. La primera pérdida de masa, la cual se encuentra entre 50-110°C y corresponde a entre un 11-15% del peso total de la muestra, representa la evaporación de agua, mientras que la segunda, la cual empieza alrededor de los 200-250°C y hasta los 300-400°C, indica la descomposición de la estructura de la quitina o quitosano [24]. En el termograma de la materia prima, se pueden ver bandas de procesos de descomposición relativamente anchas, lo cual indica que la muestra presenta una gran cantidad de impurezas, a diferencia de la banda presente en los 300°C en el termograma del quitosano comercial de peso molecular medio, la cual es angosta.
En el termograma del quitosano extraído, se observan tres bandas, siendo la primera (cerca de 50°C) y la tercera (en 300°C) similares a los del quitosano comercial, sin embargo, en el caso de la tercera, esta se encuentra desviada hacia los 350°C, y se presenta otro pico antes. De acuerdo con Paulino et al. [24], este pico antes puede deberse a una degradación de parte de las moléculas que fueron desacetiladas, y la desviación en las bandas evidencia una baja estabilidad térmica del polímero sintetizado debido al proceso de síntesis [22]. Finalmente, la masa residual de los tres polímeros, que es de entre un 28-41%, sugiere la presencia de minerales y otros compuestos cuya temperatura de descomposición supera los 400°C, y que, en el caso del quitosano extraído, no fueron eliminados durante la fase ácida [24].
Al analizar las imágenes obtenidas mediante microscopía electrónica de barrido (SEM), se pueden identificar grandes diferencias entre la materia prima, el quitosano extraído y el quitosano comercial. En el caso de las mudas de larvas de T. molitor, estas presentan una superficie uniforme y porosa, con presencia de algunas vellosidades.
Por otro lado, el quitosano comercial está conformado por partículas de superficie áspera y con distintas formas, algunas más alargadas que otras, llegando a formar incluso fibras. Es importante recordar que este quitosano proviene de cáscaras de crustáceos, por lo que es entendible que tenga una morfología muy distinta a la que presenta el quitosano obtenido. Esto puede deberse a que la cutícula de los crustáceos, a diferencia de las mudas de los insectos, presenta altas concentraciones (20-60%) de carbonato de calcio, lo que rigidiza la estructura de la quitina, y que a pesar de que se realiza un proceso de desmineralización, siempre se mantiene un porcentaje de estos minerales en el quitosano extraído [17]. Esto se puede comprobar en los análisis termogravimétricos, pues después de 400°C se mantiene un 28-41% del peso de la muestra, lo cual se atribuye a la presencia de minerales.
El quitosano obtenido, por su parte, está compuesto de partículas de tamaño similar, pero menos uniformes que las del quitosano comercial. En este caso, no se observan fibras, y se nota una superficie mucho más áspera, generada por el tratamiento con ácidos y bases concentradas.
Kaya et al. [25] mencionan que el quitosano obtenido de distintas fuentes posee diferentes morfologías, tales como fibras, poros y la ausencia de estos. Además, la morfología de la quitina, y por ende también del quitosano, varía según la especie o hasta de los individuos de los que se extrajo, así como de la materia prima utilizada. Así mismo, la pureza de la muestra y la predominancia de unidades desacetiladas influencia de manera directa la estructura de este biomaterial, lo que podría explicar la morfología del producto obtenido.
Ventajas del producto obtenido para la bioeconomía
La economía moderna ha abusado de los productos derivados del petróleo para crear combustibles, plásticos, gomas, geles, cápsulas, entre otros, generando una gran contaminación y aumento de precios en los productos [2]. Estos derivados podrían sustituirse con biopolímeros como el quitosano, ya que también puede ser utilizado para estos fines [26]. De hecho, en cuanto al quitosano extraído de camarón, se ha comprobado que invertir en sistemas de producción de camarón y aprovechar sus desechos para producir quitosano es más rentable que mantenerse solamente en la producción de camarón [27].
Sin embargo, la obtención de quitosano proveniente de desechos larvales de insectos como T. molitor representa una gran alternativa de fácil acceso frente a la extracción a partir de desechos de crustáceos, pues al ser esta especie de crianza doméstica, no es una fuente de quitina estacional, como sí es el caso de los crustáceos [17]. Además, el poco espacio que requieren las larvas de este insecto permite que su producción sea mucho más escalable e independiente, a diferencia de la extracción de crustáceos, la cual es dependiente de la actividad pesquera.
El quitosano, debido a que presenta las ventajas de ser biorenovable, biocompatible, biodegradable, no tóxico y no irritante, puede ser utilizado en una gran variedad de industrias, y son su grado de desacetilación, peso molecular y pureza los que definirán su funcionalidad para una aplicación u otra [17]. Esto se debe a que estos tres factores influyen directamente en propiedades como la viscosidad, solubilidad e interacciones con sistemas biológicos [28]. Por ejemplo, un quitosano con una pureza alta (baja contenido de humedad, cenizas y materia insoluble) y bajo peso molecular puede ser utilizado para aplicaciones biomédicas, debido a que es soluble en agua en un rango extenso de pH [29], mientras que uno con una menor pureza puede ser utilizado para biocontrol en la agricultura [30].
Conclusiones y Recomendaciones
Es posible obtener quitosano mediante el procesamiento de quitina extraída de las mudas de larvas de T. molitor, el cual puede ser utilizado en el futuro para distintas aplicaciones. Esto representa una alternativa al uso del quitosano comercial, el cual es de muy alto costo, poco escalable y dependiente de la pesca.
Se recomienda realizar un análisis de optimización de respuesta para mejorar las condiciones, concentraciones de reactivos y tiempos de la extracción de quitina y síntesis de quitosano, con el objetivo de evitar la degradación de la molécula, y así obtener un producto con mayor pureza para ser utilizado en aplicaciones que así lo requieran, como por ejemplo las del ámbito biomédico o alimenticio [28]. Además, se recomienda calcular y optimizar el grado de desacetilación, así como el peso molecular y pureza del producto obtenido, pues estas son las características más críticas para definir la funcionalidad que se le puede dar al quitosano [17] [29].
Referencias
[1] O. P. Abioye, A. A. Abioye, S. A. Afolalu y S. O. Ongbali, “A review of biodegradable plastics in Nigeria,” International Journal of Mechanical Engineering and Technology (IJMET), vol. 9, no. 10, 2018.
[2] I. Vroman y L. Tighzert, “Biodegradable polymers,” Materials, vol. 2, no. 2, pp. 307-344, 2009.
[3] S. RameshKumar, P. Shaiju y K. E. O’Connor, “Bio-based and biodegradable polymers: State-of-the-art, challenges and emerging trends,” Current Opinion in Green and Sustainable Chemistry, vol. 21, pp. 75-81, 2020.
[4] C. L. Velásquez, “Quitina y quitosano: materiales del pasado para el presente y el futuro,” Avances en química, vol. 1, no. 2, pp. 15-21, 2006.
[5] C. K. S. Pillai, W. Paul y C. P. Sharma, “Chitin and chitosan polymers: Chemistry, solubility and fiber formation,” Progress in polymer science, vol. 34, no. 7, pp. 641-678, 2009.
[6] Z. Mármol, G. Páez, M. Rincón, K. Araujo, C. Aiello, C. Chandler y E. Gutiérrez, “Quitina y quitosano polímeros amigables. Una revisión de sus aplicaciones,” Revista Tecnocientífica URU, vol. 1, pp. 53-58, 2011.
[7] H. Sato et al., “Determination of the degree of acetylation of chitin/chitosan by pyrolysis-gas chromatography in the presence of oxalic acid,” Analytical Chemistry, vol. 70, no. 1, pp. 7-12, 1998.
[8] L. Parada, G. Crespín, R. Miranda y I. Katime, “Caracterización de quitosano por viscosimetría capilar y valoración potenciométrica,” Revista iberoamericana de polímeros, vol. 5, no. 1, pp. 1-16, 2004.
[9] W. Arbia, L. Arbia, L. Adour y A. Amrane, “Chitin extraction from crustacean shells using biological methods–a review,” Food Technology and Biotechnology, vol. 51, no. 1, pp. 12-25, 2013.
[10] C. Ramírez, “Implicaciones del uso de larvas de Tenebrio molitor y Zophobas morio en la alimentación avícola,” 2020.
[11] S. P. Campana-Filho et al., “Extração, estruturas e propriedades de α- e β-quitina,” Química Nova, 2007.
[12] J. A. de M. Delezuk, M. B. Cardoso, A. Domard y S. P. Campana-Filho, “Ultrasound assisted deacetylation of beta-chitin: influence of processing parameters,” Polymer International, vol. 60, pp. 903–909, 2011. https://doi.org/10.1002/pi.3037.
[13] C. A. Castro León, J. F. Cervantes Mayagoitia, B. S. Schettino Bermúdez y N. Nogueda Hernández, “COMPARACIÓN DE CINCO DIETAS ALIMENTICIAS EN LA CRÍA DE Tenebrio molitor L. (COLEOPTERA: TENEBRIONIDAE),” Entomología Mexicana, vol. 4, pp. 616–620, 2017.
[14] A. Sarmiento, “Establecimiento e implementación de un protocolo de cría de gusano de harina Tenebrio molitor (coleóptera: tenebrionidae), como apoyo al programa de conservación de la rana venenosa dorada Phyllobates terribilis (anura: dendrobatidae) en el bioparque Wakatá, parque Jaime Duque,” Trabajo de grado, Universidad Nacional Abierta ya Distancia “UNAD”, Colombia, 2018.
[15] K. J. Kramer, T. L. Hopkins y J. Schaefer, “Applications of solids NMR to the analysis of insect sclerotized structures,” Insect Biochemistry and Molecular Biology, vol. 25, no. 10, pp. 1067–1080, 1995. doi:10.1016/0965-1748(95)00053-4.
[16] I. Younes y M. Rinaudo, “Chitin and chitosan preparation from marine sources. Structure, properties and applications,” Marine drugs, vol. 13, no. 3, pp. 1133-1174, 2015.
[17] A. Romero–Serrano y J. Pereira, “Estado del arte: Quitosano, un biomaterial versátil. Estado del Arte desde su obtención a sus múltiples aplicaciones,” Revista INGENIERÍA UC, vol. 27, no. 2, pp. 118-135, 2020.
[18] A. Percot, C. Viton y A. Domard, “Optimization of Chitin Extraction from Shrimp Shells,” Biomacromolecules, vol. 4, no. 1, pp. 12–18, 2003.
[19] T. Hahn et al., “Current state of chitin purification and chitosan production from insects,” Journal of Chemical Technology & Biotechnology. doi:10.1002/jctb.6533, 2020.
[20] Y.-S. Song et al., “Extraction of chitin and chitosan from larval exuvium and whole body of edible mealworm, T. molitor,” Entomological Research, vol. 48, no. 3, pp. 227–233, 2018. doi:10.1111/1748-5967.12304.
[21] E. Khor, “Chitin: fulfilling a biomaterials promise,” Elsevier, 2014.
[22] A. J. da Silva Lucas et al., “Extraction, physicochemical characterization, and morphological properties of chitin and chitosan from cuticles of edible insects,” Food Chemistry, vol. 343, p. 128550, 2021.
[23] N. H. Marei et al., “Isolation and characterization of chitosan from different local insects in Egypt,” International Journal of Biological Macromolecules, vol. 82, pp. 871-877, 2016.
[24] A. T. Paulino, J. I. Simionato, J. C. Garcia y J. Nozaki, “Characterization of chitosan and chitin produced from silkworm crysalides,” Carbohydrate Polymers, vol. 64, no. 1, pp. 98–103, 2006. doi:10.1016/j.carbpol.2005.10.032.
[25] M. Kaya, K. Sofi, I. Sargin y M. Mujtaba, “Changes in physicochemical properties of chitin at developmental stages (larvae, pupa and adult) of Vespa crabro (wasp),” Carbohydrate Polymers, vol. 145, pp. 64-70, 2016.
[26] M. Rinaudo, “Chitin and chitosan: Properties and applications,” Progress in Polymer Science, vol. 31, no. 7, pp. 603-632, 2006.
[27] M. Cadeza-Espinosa, J. Brambila-Paz, L. E. Chalita-Tovar y A. González-Estrada, “Evaluación financiera con la metodología de opciones reales de una inversión para producir quitosano con base en desperdicio de camarón,” Agricultura, sociedad y desarrollo, vol. 14, no. 4, pp. 533-545, 2017.
[28] I. Aranaz et al., “Functional characterization of chitin and chitosan,” Current chemical biology, vol. 3, no. 2, pp. 203-230, 2009.
[29] V. Zargar, M. Asghari y A. Dashti, “A Review on Chitin and Chitosan Polymers: Structure, Chemistry, Solubility, Derivatives, and Applications,” ChemBioEng Reviews, vol. 2, no. 3, pp. 204–226, 2015. doi:10.1002/cben.201400025.
[30] H. Hernández Cocoletzi, E. Águila Almanza, O. Flores Agustin, E. L. Viveros Nava y E. Ramos Cassellis, “Obtención y caracterización de quitosano a partir de exoesqueletos de camarón,” Superficies y vacío, vol. 22, no. 3, pp. 57-60, 2009.
1 Estudiante de Ingeniería en Biotecnología del Instituto Tecnológico de Costa Rica. Costa Rica.
 itnanVargasVenegas@gmail.com.
itnanVargasVenegas@gmail.com. https://orcid.org/0000-0001-6379-7430
https://orcid.org/0000-0001-6379-7430
2 Profesor e investigador de la Escuela de Biología y del Laboratorio Institucional de Microscopía del Instituto Tecnológico de Costa Rica. Costa Rica.
 amedaglia@itcr.ac.cr.
amedaglia@itcr.ac.cr.  https://orcid.org/0000-0003-3496-0571
https://orcid.org/0000-0003-3496-0571
3 Profesora e investigadora de la Escuela de Biología y del Centro de Investigación en Biotecnología del Instituto Tecnológico de Costa Rica. Costa Rica.
 laura.chavarria@tec.ac.cr
laura.chavarria@tec.ac.cr https://orcid.org/0000-0002-7630-1104
https://orcid.org/0000-0002-7630-1104