Miel como inductor de compuestos fenolicos, flavonoides y de crecimiento de fruto de mango var. ataúlfo
Honey as an inducer of phenolic compounds, flavonoids and growth of mango fruit var. ataúlfo
Víctor Jesús Albores-Flores1, Julieta Grajales-Conesa2, Grisel Pérez-Santos3, Karina Janeth Pérez-Escobar4, José Alfonso López-García5, Claudia Ivette Albores-Flores6, Marycarmen Utrilla-Vázquez7
Fecha de recepción: 14 de mayo, 2023
Fecha de aprobación: 27 de setiembre, 2023
Albores Flores, V. J; Grajales Conesa, J; Pérez Santos, G: Pérez-Escobar, K. J; López-García, J. A; Albores-Flores, C. I; Utrilla-Vázquez, M . Miel como inductor de compuestos fenolicos, flavonoides y de crecimiento de fruto de mango var. ataúlfo. Tecnología en Marcha. Vol. 37, No 2. Abril-Junio, 2024. Pág. 134.143. https://doi.org/10.18845/tm.v37i2.6723
https://doi.org/10.18845/tm.v37i2.6723
Palabras clave
Miel; fruto; fenoles; etapas; hojas; defensas.
Resumen
La producción de miel tiene vestigios ancestrales, considerando a Apis como la más domesticada y comercializada. Por otro lado, las abejas meliponinos, que tienen vestigios precolombinos han sido poco estudiadas y tiene propiedades fisicoquímicas importantes y de gran valor para ser usadas en el área agrícola. El cultivo del mango, del cual dependen una variedad de familias por ser un soporte socioeconómico, además de lo anterior, se le invierte bastante para sostenerlo con un buen manejo agronómico, donde hay insuficiente herramientas biológicas que permitan dar una producción menos dañina al ambiente. El objetivo del presente trabajo fue evaluar la acción elicitora de metabolitos de defensa y de la inducción de crecimiento de los frutos de mango al aplicar miel. El estudio se llevó a cabo en el rancho San Juan, en el municipio de Tapachula, Chiapas. Se establecieron 4 tratamientos en campo, considerando las etapas de producción del fruto de mango. Se encontró diferencias significativas entre las concentraciones de fenoles totales analizadas en hojas y entre todos los tratamientos, observando que es mejor realizar la aplicación de miel después de la floración y durante el crecimiento del fruto de mango. No importa la concentración de miel utilizada, ambas estimulan el crecimiento del fruto de mango. Se encontró una relación significativa entre las concentraciones de fenoles, tiempo de aplicación y crecimiento del fruto de mango, con miel de M. beecheii.
Keywords
Honey; fruit; phenols; stages; leaves; defenses.
Abstract
The production of honey has ancestral vestiges, considering Apis as the most domesticated and commercialized. On the other hand, meliponine bees, which have pre-Columbian remains, have been little studied and have important physicochemical properties of great value for use in agriculture. Mango cultivation, on which a variety of families depend for being a socioeconomic support, in addition to the above, is invested enough to sustain it with good agronomic management, where there are insufficient biological tools that allow for less harmful production to the environment. The objective of this work was to evaluate the eliciting action of defense metabolites and the growth induction of mango fruits when applying honey. The study was carried out at the San Juan ranch, in the municipality of Tapachula, Chiapas. Four treatments were established in the field, considering the production stages of the mango fruit. Significant differences were found between the concentrations of total phenols analyzed in the leaves and between all the treatments, observing that it is better to apply honey after flowering and during the growth of the mango fruit. No matter the concentration of honey used, both stimulate the growth of the mango fruit. A significant relationship was found between the concentrations of phenols, application time and growth of the mango fruit, with M. beecheii honey.
Introducción
El manejo agronómico de los cultivos frutales, presenta una variedad de limitaciones desde su establecimiento, injertado, promoción de tejido vegetal, inducción de los diferentes etapas de producción cada año, aumentando estos cuando son jóvenes los árboles y dificultándose conforme presentan más edad [1, 2].
A pesar que el desarrollo tecnológico ha tenido avances significativos, la falta de tecnología agrícola confiable y de poco impacto sobre el ambiente es muy escasa. El uso de drones ya es una realidad, pero no es suficiente para sufragar las necesitas fitosanitarios y menos para orquestar una buena producción que sostenga y prometa un fruto de mejor calidad [3, 4].
El cultivo del mango, centro de generación de empleo temporal para varias familias y permanente, para unas cuantas minorías, es reconocido como un alimento frutal de alta importancia a nivel mundial. Este cultivo, susceptible al manejo agrícola también presenta problemas fitosanitarios, como son las enfermedades fúngicas, como antracnosis que provoca pérdidas de producción del 60% o más [3, 5]. El manejo fitosanitario convencional se sostiene del uso de productos agroquímicos, que además de afectar al ambiente, repercute negativamente sobre la biodiversidad y principalmente sobre los polinizadores [6]. Entre las estrategias menos agresivas al ambiente, se ha utilizado la resistencia inducida, que es una estrategia de control emergente que puede usarse para este fin [7]. A lo anterior se suma el uso de fertilizantes que proporcionen un equilibrio nutrimental y hormonal, que fortalezca el amarre de los frutos y estimule su crecimiento, encontrando que las alternativas biológicas o naturales son escasas [8].
Es urgente utilizar productos de origen natural que actúen como fungicida y bactericidas, e incluso sean elicitores para inducir resistencia en las plantas [9]. Las moléculas antes mencionadas son compuestos que actúan a nivel metabólico e inducen una señal directa para activar mecanismos de defensa química y bioquímica en las plantas, dando como resultados la producción de diversos metabolitos, los cuales en su mayoría son compuestos fenólicos y flavónicos [10].
Los extractos vegetales de tipo alcohólico u acuoso, microorganismos entre otros, han demostrado presentar acción inductora de resistencia en plantas e incluso árboles y por otro lado, un grupo de investigación del Instituto de Biociencias, preocupados por el uso de desarrollo de nuevos procesos de Fito sanidad y fisiológicos que no afecten la biodiversidad del agro-ecosistema y a los polinizadores, han incursionado en esta área para acrecentar el conocimiento del uso de productos biológicos y de origen natural, publicando en el 2018 [11], avances del uso de miel con acción anti fúngica sobre el desarrollo de Colletotricum gloeosporioides, principal causante de antracnosis en cultivos de mango.
También se ha demostrado que la miel se puede utilizar a nivel de campo sin presentarse consecuencias de atracción de hormigas, se utilizó como adherente o fertilizante foliar con resultados significativos. Aplicaciones en el campo agrícola Incluyendo lo antes expuesto es difícil de imaginar que la miel, producida tanto por abejas Apis mellifera como por abejas Meliponinos, pudieran ser usadas en las actividades diarias en el manejo agrícola, tanto a nivel de invernadero, pos cosecha y de producción en campo. Las investigaciones realizadas en Mèxico, a partir del 2001, reportaron el uso de miel de abeja Apis como complemento nutrimental de plántulas de tomate con la finalidad de obtener plantas de alto vigor y buena calidad de trasplante [12]. A lo antes expuesto, el objetivo del presente estudio de investigación fue evaluar la acción elicitora de metabolitos de defensa y de la inducción de crecimiento de los frutos de mango al aplicar miel.
Materiales y métodos
El estudio fue realizado en un cultivar de mango ataúlfo, localizado en Tapachula, Chiapas, México en el km 227.5 con la ubicación geográfica Lat. 14°54′25.0“N, Lon. 92°17’43.0”W. En los periodos de octubre de 2021 hasta junio del 2022.
Se recolectaron las muestras de miel de la especie Melipona beecheii a la que se le determinó pH (potenciómetro), grados brix (refractómetro).
Se realizó un diseño factorial 32 completamente al azar con 3 testigos: Positivo 1 (ácido salicílico), Positivo 2 (Agromil-V®) y negativo (agua). De manera general, los tratamientos se distribuyeron en las etapas del cultivo: 1) inducción de floración, 2) floración y 3) crecimiento y llenado del fruto.
Los lapsos de aplicación de cada tratamiento se realizaron cada 21 días durante 3 meses por aspersión en los tejidos foliares de los árboles de mango y frutos desde el amarre de estos, con la ayuda de bombas de mochila de capacidad de 20 L, con aplicación manual. En los tratamientos positivo 1 y 2 se utilizaron inex como adherente. El inductor de crecimiento de frutos (Agromil-V®) se aplicó en la semana 3, 7 y 11 de crecimiento.
De forma semanal se midió la severidad por antracnosis en las hojas de los árboles de mango. Cada árbol se dividió en 4 secciones, analizando hojas y frutos de cada sección del árbol. Se colecto muestra de hoja y frutos de cada sección del árbol de mango y se realizó la evaluación de fenoles y flavonoides. Tanto hojas como cascara de fruto colectadas fueron secadas por 72 horas a 40°C. Se trituraron y se pasaron por tamices de malla de 150 mm, hasta colectar un polvo tipo harina. Se utilizó 1.0 gr de harina de hojas y frutos de mango por separado para elaborar un extracto metanólico al 5%, y se utilizó para la determinación de fenoles totales por el método de Folin-Ciocalteu [11], expresados como mg EAG/g y de flavonoides [13], expresado como mg EQ/g.
Cada semana se midió el fruto con una cinta métrica el largo y ancho del fruto.
Los datos obtenidos se analizaron con un ANOVA y una prueba de tukey p > 0.05. También se realizó una prueba de correlación de Pearson para determinar relaciones entre variables.
Resultados
El análisis de la miel, indicó que es ácida con valor de pH de 3.0 (± 0.12) y de grados brix de 76.03 (±0.91).
Se observó que la severidad de las hojas de mango (Figura 1), antes de la etapa de floración (las primeras 3 semanas de evaluación), los valores entre los tratamientos fue similar (p= 0.058). En la etapa de floración (la semana 4 y 5 de studio), se redujo este valor en los tratamientos que recibieron miel de M. beecheii, independientemente de la concentración utilizada (p=0.032). Los valores de severidad en los tratamientos testigo, fue superior al 40%. La severidad se redujo por debajo del 30% en los tratamientos de miel y del testigo positivo, a partir de la semana 6 y fue decreciendo este valor hasta alcanzar un mínimo de 18 % en la semana 19, correspondiendo este lapso de tiempo al crecimiento del fruto.
Se pudo observar (Figura 2) que en las primeras tres semanas de estudio (correspondiente a la etapa pre floración), los tratamientos testigos presentaron valores similares en fenoles, en el tratamiento de miel baja se redujo los valores, a diferencia del tratamiento alta de miel donde los valores fueron de forma creciente. En las semanas 4 y 5, donde se llevo a cabo la etapa de floración, los tratamientos testigo fueron similares al tratamiento de miel concentración baja y únicamente la miel a concentración alta se elevaron los valores de fenoles por arriba del valor de 0.25 mg EAG. El tratamiento baja de miel presentó valores altos, a partir de la semana 8 y el tratamiento alta de miel, los valores altos se presentarón después de la semana 3.
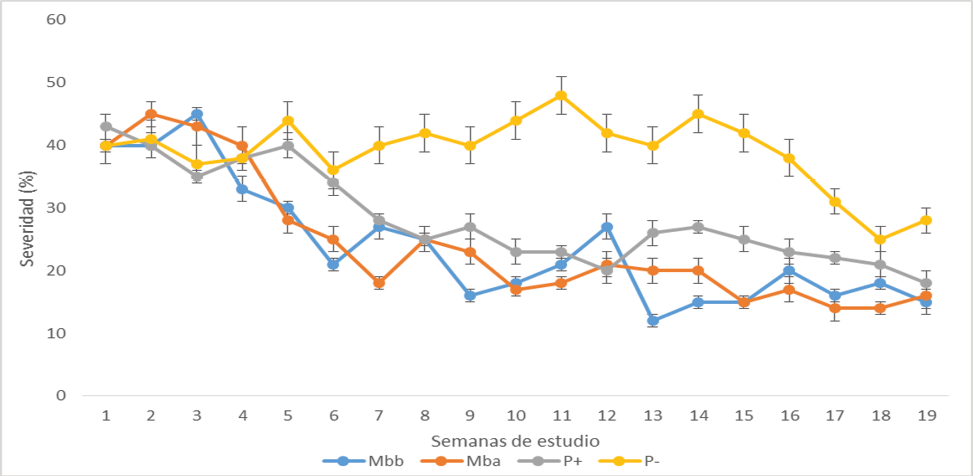
Figura 1. Valores de severidad de las hojas de mango en todos los tratamientos. (Mbb: concentración baja de miel, Mba: concentración alta de miel, P(+): testigo positivo, P(-): testigo negativo).
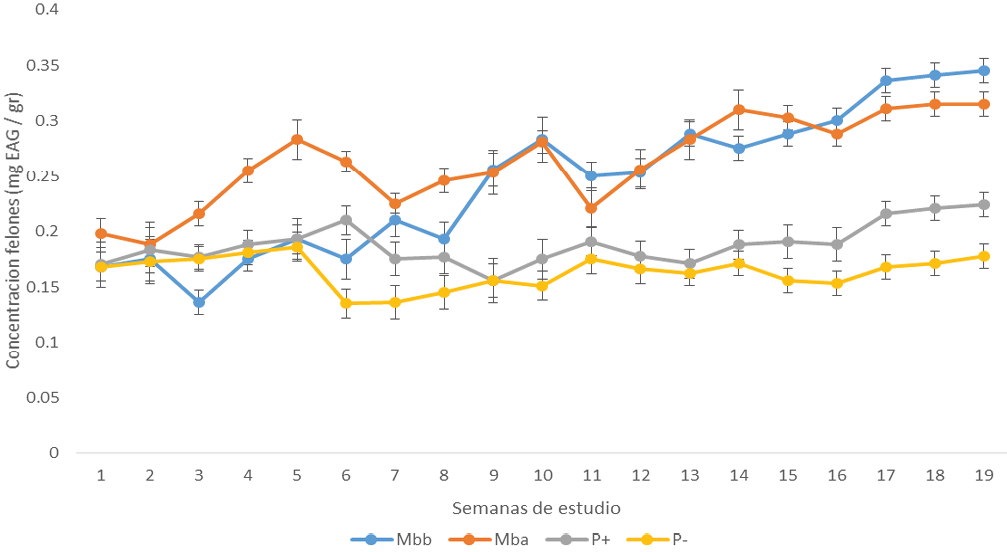
Figura 2. Valores de fenoles totales en las hojas de mango en todos los tratamientos. (Mbb: concentración baja de miel, Mba: concentración alta de miel, P(+): testigo positivo, P(-): testigo negativo).
La cantidad de flavonoides presentes en las hojas de mango, se observan en la figura 3. En la etapa pre floración (los primeros 3 semanas), el tratamiento de miel a concentración alta presentó los valores mas altos, diferenciandose de los demás tratamientos. En la etapa de floración (semana 4 y 5) y en las primeras 3 semanas de crecimiento del fruto (semana 6 al 8), todos los tratamientos presentaron valores similares de flavonoides. De la semana 8 a la semana 15, se presentaron valores máximos de flavonoides en los tratamientos de miel y en el testigo positivo. Únicamente el testigo negativo, no presentó esta variación.
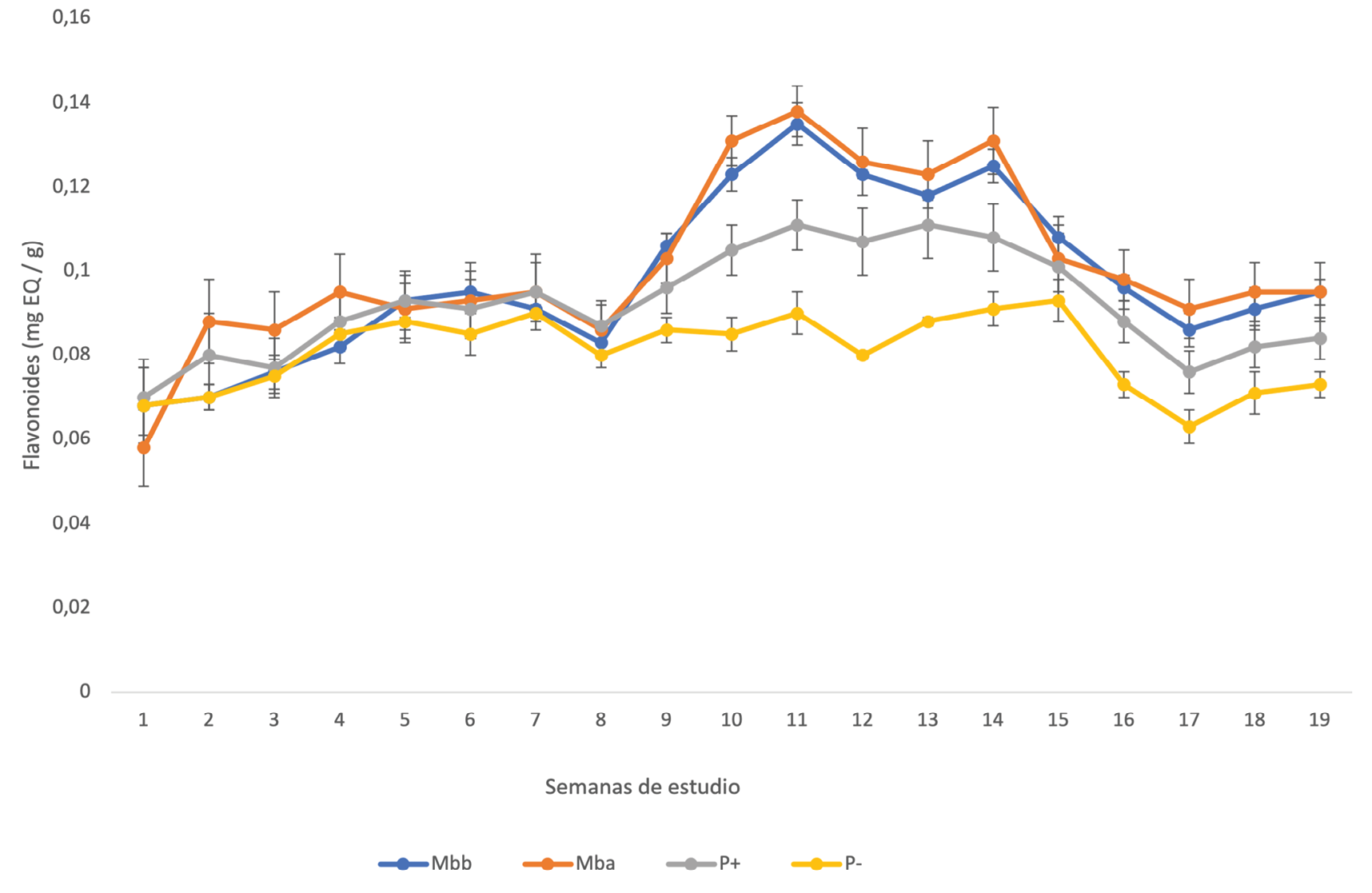
Figura 3. Valores de concentracion de flavonoides en hojas de mango en todos los tratamientos. (Mbb: concentración baja de miel, Mba: concentración alta de miel, P(+): testigo positivo, P(-): testigo negativo).
Se encontró que los tratamientos que recibieron las dos concentraciones de miel (Figura 4), presentaron tamaños de frutos similares durante todas las semanas de estudio. A partir de la cuarta semana de crecimiento (semana 9 de estudio), los tratamientos testigos fueron presentando menor valor de longitud, siendo los frutos mas pequeños los que no recibieron producto alguno a diferencia de los frutos que recibieron el estimulador de crecimiento, presentando valores similares a los tratamientos de miel en las semanas 7, 8, 11, 12 y 13.
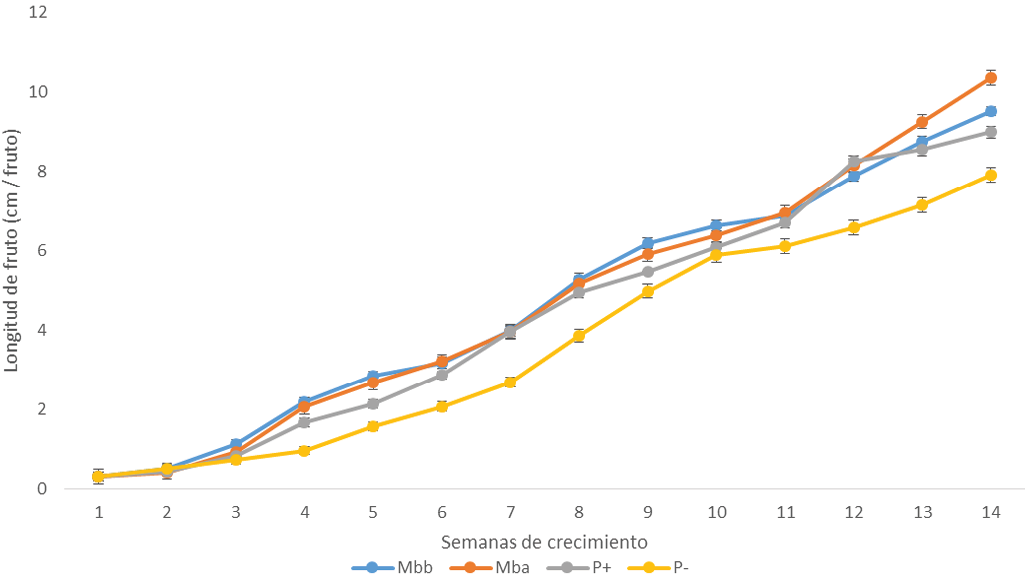
Figura 4. Valores de longitud de fruto de mango en todos los tratamientos. (Mbb: concentración baja de miel, Mba: concentración alta de miel, P(+): testigo positivo, P(-): testigo negativo).
Se encontró valores de correlación entre la severidad y fenoles, de -0.86 y -0.88 en los tratamientos de miel baja y alta respectivamente. En los testigos, los valores fueron de -0.56 y -0.37 en los tratamientos testigo positivo y negativo, respectivamente.
Entre el crecimiento y fenoles, los valores de correlación fueron de 0.91 y 0.90 en los tratamientos miel baja y alta, respectivamente. En los testigos los valores fueron menores, siendo 0.58 y 0.48, en testigo positivo y negativo, respectivamente.
Los valores de correlación entre flavonoides y severidad fueron: de la semana 6 a las 19 el valor fue de -0.76, -0.75 y -0.58, para miel alta, baja y testigo positivo, respectivamente. De la semana 1 a las semana 6, fue de -0.28, -0.32, -0.33 y -0.24 para miel baja, alta, testigo positivo y negativo, respectivamente.
Los valores entre crecimiento del fruto y flavonoides fueron: 0.63, 0.62, 0.55 y 0.48, para miel alta, baja, testigo positivo y negativo, respectivamente.
Discusión
La reducción de la severidad observada en los tratamientos que recibieron soluciones de miel (figura 1), a partir de la quinta semana de estudio, hace pensar tres explicaciones:
a)Que el contacto que tuvo la miel con la superficie de las hojas inhibio el desarrollo de los hongos fito-patógenos en esta superficie, similar a lo que reportan Albores [11],
b)Que los componentes de la miel penetraron la cutícula presente en las hojas [14] y ejercieron actividad inhibitoria [11] sobre los hongos que habian infectado el tejido, evitando que estos siguieran dañandolo y
c)Que los componentes de la miel que penetraron la cutícula, activaron mecanismos de defensa (como fenoles y flavonoides, figura 2 y 3, [15, 16] para contrarrestar el daño y que las hojas se pudieran defender de los hongos patógenos presentes.
La biosíntesis de compuestos fenólicos, base en el metabolismo primario para la generación de pared cellular y division cellular en tejido de todas las plantas, se efectua desde la formación de hojas, flores y frutos [17, 18], esto explica la presencia de fenoles desde el inicio del estudio. El cambio en la concentración de fenoles y flavonoides a través del tiempo, es un resultado de los cambios fisiológicos y fenológicos que suceden en los organos vegetales, sucitandose la bioíntesis de defensas despues de cierta edad del tejido [19, 20]. Estos niveles pueden cambiar si que aplican estimulantes, de origen sintético o biológico para apoyar a las defensas de las plantas [15, 16], lo anterior fue lo que logró observar con los tratamientos de miel y el testigo positivo.
La miel como sustancia producida por abejas a base de néctar de las flores y con una cantidad alta de compuestos fenólicos, ha demostrado actuar como agente anti fúngico y tener potencial de ser inductor de compuestos fenólicos [21, 11]. Las propiedades que presentan las mieles, de forma general, siendo tanto hidrofóbicas como hidrofílicas, permite que sean utilizadas en el área agrícola, para producción de cultivos de plantas, tal como lo explicó Villegas [12] en el cultivo de tomate. Por lo anterior, lo observado en el crecimiento del fruto (Figura 4), donde tanto los tratamientos con soluciones de miel y del inductor Agromil-V (testigo positivo), hacen pensar dos explicaciones:
1.Que además del soporte nutrimental que reciben los frutos durante su crecimiento, de las hojas (foto-sintatos), los compuestos fenólicos recibidos de forma externa (en los tratamientos de miel), permitieron promover la elongación de este órgano y mantuvieron la sanidad de estos [11, 22], logrando que los nutrientes recibidos se utilizaron en su totalidad y más eficientemente, en la división celular y en la elongación del fruto, logrando con ello, obtener frutos más grandes que el testigo negativo y de tamaño similar al testigo positivo.
2.Debido a los componentes que contienen las mieles, como son vitaminas, enzimas, aminoácidos, azúcares, proteínas, fenoles, flavonoides, entre otros [23], estimularon la etapa de elongación celular presentado en la semana 4 y 9 (Figura 4), que corresponde a la diferenciación celular y etapa de termino de llenado con maduración del fruto. En estas etapas apoyaron la formación de foto-asimilados formados en las hojas al mejorar el crecimiento del fruto. Los azúcares administrados de forma exógena (por la miel), actuaron de forma energética sobre la división y elongación celular [24], los aminoácidos, vitaminas, fenoles y flavonoides, aplicados de forma exógena, favorecieron a la bio-síntesis de compuestos estructurales y de hormonas para aumentar el crecimiento celular del fruto, al acelerar el metabolismo, dando como resultados cambios fisiológicos importantes y el aprovechamiento eficientes de todos los componentes indispensables para que este órgano creciera [25].
Conclusiones
La miel redujó más del 30 % la severidad en las hojas de los árboles de mango y aumento la concentración de fenoles por arriba de los 0.30 mg EAG / gr de hoja.
Las soluciones de miel, incrementó la concentración de flavonoides en la etapa de crecimiento del fruto de mango, específicamente en la etapa de mayor crecimiento que fue a partir de la 3ª semana hasta la semana 10 de crecimiento.
Las soluciones de miel de Melipona beecheii, aplicadas por aspersión en campo a los árboles de mango presentaron actividad elicitora sobre la producción de fenoles y actividad anti fúngica en tejido foliar de los árboles de mango.
La miel de M. beecheii presenta potencial de uso para estimular el crecimiento del fruto de mango.
Agradecimientos
Los autores agradecen a la Licenciada Maria Luisa Palacios y Palacios y al doctor Roberto Canell Aquino, por dar el permiso para efectuar el estudio en su predio commercial de cultivo de mango.
Referencias
[1] SIAP and Secretaria de agricultura y desarrollo rural, “Expectativas agroalimentarias”, editors SIAP y SADER, Ciudad de México, 2023, pp 64.
[2] M. E. García Álvarez, “Plantación y tecnología del cultivo”, Editores: A. E. García Álvarez, “Instructivo técnico para el cultivo del mango”, Habana, Cuba, 2023, pp. 40.
[3] P. Arús, “Agriculture of the future: Science and technology for sustainable agricultural development”. Métode science studies journal, 10:33-39, 2020, DOI: 10.7203/metode.10.12546
[4] J. L. López-González, E. Salgado-Villavicencio, J. F. Aguirre-Cadena, J. A. Méndez-Espinosa, “Agricultura de temporal y seguridad alimentaria en familias campesinas, un estudio de caso en Puebla-México”, Agricultura, Sociedad y Desarrollo, 20: 109-124, 2023, https://doi.org/10.22231/asyd.v20i1.1531
[5] R. Sing & Deepankar, “Modeling for anthracnose development in mango in relation to weather parameters”, Australasian Plant Pathology, 49: 285-294, 2020.
[6] T. Y. Duran, C. G. Otero, A. L. D. Ortega, P. V. J. Arriola, A. J. A. Mora, N. A. Damián, E. P. García, “Evaluación de insecticidas para control de trips y ácaros plaga del mango (Mangifera indica L.) en tierra caliente, Guerrero, México”. Tropical and Subtropical Agroecosystems, 20(3), 2017, pp. 381-394.
[7] J. Flores-García, M. Madrid González, S. A. Nodal, “Uso de Bacillus sp. Como inductor ade resistencia en nopal frente a la pudrición escamosa”, Revista Mexicana de Ciencias Agrícolas, 14: 25-37, 2023. https://www.scielo.org.mx/pdf/remexca/v14n1/2007-0934-remexca-14-01-25.pdf
[8 C. Tiyayon & R. E. Paull, “Mango Production”, In “Handbook of mango fruit: production, postharvest science, processing technology and nutrition”, editors M. Siddiq, J. Brecht y S. Sidhu, John Wiley & Sons. June, pp: 17-35, 2017.
[9] L. L. H. Calcedo, A. A. L. Villagómez, O. D. Sáenz de la, G. C. E. Zavala, M. E. Espinoza, Z. H. Romero, “Elicitores: implicaciones bioéticas para la agricultura y la salud humana”, Revista Bioética, 29: 76- 86, 2021.
[10] M. S. García y M. J. M. León, “Estrategia para mejorar la producción de metabolitos secundarios en plantas” Ciencia UANL, 24: 106, 2021.
[11] Albores F. V., Marín S. I. J., López G. J.A., Sánchez G. A., y Grajales C. J. Antifungal property of honey on in vitro development of Colletotrichum gloeosporioides. Revista mexicana de fitopatología, vol. 36, no 3, pp. 423-431, 2018.
[12] T. O. G. Villegas, Ma de las N. Rodríguez, L. I. Trejo, G. G. Alcántar, “Potencial de la miel de abeja en la nutrición de plántulas de tomate”, Terra Latinoamericana, 19: 97-102, 2001.
[13] V. Albores-Flores, E. Saavedra-Camacho, J. A. López-García, J. Grajales-Conesa, L. C. Córdova-Albores, “Caracterización fisicoquímica, actividad antioxidante y antifúngica de agregado de polen de tres especies de abejas (Apidae: Meliponini) provenientes del Soconusco, Chiapas”, Revista Mexicana de Fitopatología, 39: 41-60, 2021, https://doi.org/10.18781/R.MEX.FIT.2009.4
[14] L. del C. González García, A. Sánchez Estrada, J. N. Mercado Ruiz, R. Báez Sañudo & A. González León, “Inducción de cambios de tamaño, color y en cutícula en bayas de uva de mesa por medio de bioreguladores: Cambios en bayas de uvas de mesa”, Biotecnia, 25(2), 113–119, 2023, https://doi.org/10.18633/biotecnia.v25i2.1874
[15] G. J. Góngora-Chi, J. Lizardi-Mendoza, Y. L. López-Franco, M. A. López-Mata, L. Quihui-Cota, “Métodos de extracción, funcionalidad y bioactividad de saponinas de Yucca: una revisión”, Biotecnia, 25: 147-155, 2023. https://doi.org/10.18633/biotecnia.v25i1.1800
[16] Anjali, S. Kumar, T. Korra, R. Thakur, R. Arutselvan, A. Shankar, Y. Nehela, V. Chaplygin, C. Keswani, “Role of plant secondary metabolites in defence and transcriptional regulation in response to biotic stress”, Plant Stress, 8: 1-19, 2023, https://doi.org/10.1016/j.stress.2023.100154
[17] A, Millán-Laleona, S. Núñez, F. Les, F. J. Bielsa, P. Errea, V. López, “Estudio comparativo de propiedades funcionales de variedades comerciales y autóctonas de manzana (Malus domestica Borkh)”, in Avances en maduración y poscosecha de frutas y hortalizas, 1ª edición, Zaragoza, España, E. Arias Álvarez, S. Remón Oliver, R. Oria Almudí. 2022. Capitulo 2, sección 1, pp 14 – 17.
[18] M. A. Camacho-Escobar, D. A. Ramos-Ramos, N. Y. Ávila-Serrano, E. I. Sánchez-Bernal, S. J. López-Garrido, “Las defensas físico-químicas de las plantas y su efecto en la alimentación de los rumiantes”, Terra Latinoamericana, 38(2): 443-453, 2020
[19] H. G. Martijn ten, P. Deberdt, M. Mbenoun, y C. Cilas, “Modelling cacao pod growth: Implications for disease control”, Annals of Applied Biology, 160: 260-272, 2012.
[20] S. Kaur, M. K. Samota, M. Choudhary, A. K. Pandey, A. Sharma, J. Thakur, “How do plants defend themselves against pathogens-biochemical mechanisms and genetic interventions”, Physiology and molecular Biology and plants, 28(2): 485-504, 2022, doi: 100.1007/s12298-022-01146-y.
[21] T. C. Espinoza, O. A. Vázquez, S. R. Torres de los, G. A. López, V. J. Albores and J. Grajales, “Mieles de abejas sin aguijón del Soconusco, Chiapas: enfoque complementario.” Revista de Biología Tropical, 66(4): 1536, 2018.
[22] Viveros L. J. L., Sarma S. S. S., Guerero Z. L. A., Rodríguez D. A. (2018). Bioensayo del efecto de fenoles producidos por Myriophylum aquaticum en cultivo de Lactuca sativa. Hidrobiología. Vol. 28, pp. 109-119, 2018.
[23] C. M. E. García, R. E. Armenteros, A.M. Escobar, C. J. A. García, M. J. Méndez & C. G. Ramos, “Composición química de la miel de abeja y su relación con los beneficios a la salud” Revista Médica Electrónica, 44: 155-167, 2022. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684-18242022000100155&lng=es&tlng=es.
[24] B. M. H. Pérez, B. A. Álvarez, G. E. Avitia, 24.- L. A. I. Pérez, C. M. V. Santos, “Temperatura y desarrollo floral en la formación de frutos partenocárpicos en mango “Ataúlfo””, Revista mexicana de ciencias agrícolas, 23: 199-210, 2019.
[25] W. M. Elakbawy, S. M. M. Shanab, E. A. Shalaby, “Enhancement of plant growth regulators production from microalgae cultivated in treated sewage wastewater (TSW)”, BMC Plant Biology, 22: 377, 2022. DOI: 10.1186/ s12870-022-03764-
1 Universidad Autónoma de Chiapas. Instituto de Biociencias. Chiapas, México.
2 Universidad Autónoma de Chiapas. Instituto de Biociencias. Chiapas, México.
 https://orcid.org/0000-0002-1522-5646
https://orcid.org/0000-0002-1522-5646
3 Universidad Autónoma de Chiapas. Instituto de Biociencias. Chiapas, México.
 https://orcid.org/0009-0008-8195-7870
https://orcid.org/0009-0008-8195-7870
4 Universidad Autónoma de Chiapas. Instituto de Biociencias. Chiapas, México.
 https://orcid.org/0009-0003-2477-6954
https://orcid.org/0009-0003-2477-6954
5 Universidad Autónoma de Chiapas. Instituto de Biociencias. Chiapas, México.
 https://orcid.org/0000-0001-8993-689X
https://orcid.org/0000-0001-8993-689X
6 El Colegio de la Frontera Sur.Chiapas, México.
Correo electrónico: alboresflores@hotmail.com https://orcid.org/0000-0003-0834-9576
https://orcid.org/0000-0003-0834-9576
7 Universidad Politécnica de Tapachula.Chiapas, México.
 https://orcid.org/0000-0001-8779-8876
https://orcid.org/0000-0001-8779-8876