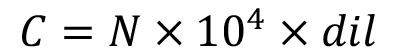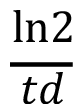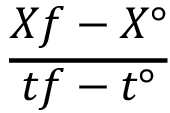Efectos de la longitud de onda de luz, el fotoperiodo y la salinidad en los parámetros de producción de Isochrysis galbana
Effects of the wavelength of light, photoperiod, and salinity in the production parameters of Isochrysis galbana
Silvia Ramírez-Flores1, Francinie Murillo-Vega2,
Fabian Villalta-Romero3, Maritza Guerrero-Barrantes4
Fecha de recepción: 14 de abril, 2023
Fecha de aprobación: 22 de julio, 2023
Ramírez-Flores, S; Murillo-Vega, F; Villalta-Romero, F; Guerrero-Barrantes, M. Efectos de la longitud de onda de luz, el fotoperiodo y la salinidad en los parámetros de producción de Isochrysis galbana. Tecnología en Marcha. Vol. 37, No 1. Enero-Marzo, 2024. Pág. 88-101. https://doi.org/10.18845/tm.v37i1.6693
https://doi.org/10.18845/tm.v37i1.6693
Palabras clave
Microalgas; luz azul; luz LED; fotosíntesis; acuicultura.
Resumen
La microalga Isochrysis galbana es un bioproducto alimenticio fundamental en los cultivos acuícolas, ya que aporta calidad nutricional a las larvas en su desarrollo óptimo. El desarrollo de la acuicultura en Costa Rica ha generado la necesidad de fomentar la producción microalgal para producir mayor cantidad y calidad de biomasa, por lo que se generó un diseño para evaluar la incidencia de factores ambientales en el cultivo de esta microalga. Los cultivos microalgas se llevaron a cabo en botellas con una capacidad de 5,5 L, se realizaron en total 6 tratamientos, tres con longitud de onda de luz blanca (500 nm) y tres con longitud de onda de luz azul (455 nm). En cada longitud de onda se analizaron tres fotoperiodos: a- 16h:8h, b- 12h:12h y 24h (Luz/Oscuridad) y 4 salinidades (32ppm, 30ppm, 28ppm y 25ppm) las cuales se trabajaron por triplicado, para un total de 12 cultivos por tratamiento. Después de 12 días de cultivo se observó una mayor cantidad de células/ml en el tratamiento de luz azul con irradiación constante 24h y salinidad de 28ppm, El fotoperiodo de 12h:12h (L/0) no tuvo en buen crecimiento en ninguna de las longitudes de onda de luz empleadas. En cuanto a la producción de biomasa se determinó que la luz azul, con fotoperiodo 16h:8h (L/O) y salinidad de 30ppm fue el que produjo mayor biomasa seca. Se pudo determinar que la combinación de factores de luz azul, con luz constante de 24h y salinidad de 28ppm, permitieron alcanzar la mayor densidad celular.
Keywords
Microalgae; blue light; LED light; photosynthesis; aquaculture.
Abstract
Production of Isochrysis galbana is one of the fundamental steps in oyster farms. The nutritional quality of this microalgae is very important, from this will depend the optimal development of the larvae, since in Costa Rica oyster culturing is growing, optimizing the microalgal culture has become a necessity not only in terms of producing more biomass but also to reduce the cost associated to it. For the bioassays, bottles with a capacity of 5.5 L were used, a total of 6 tests were carried out, three with a wavelength of white light (500 nm) and three with a wavelength of blue light (455 nm), at each wavelength three photoperiods were tested 16h:8h, 12h:12h and 24h (Light/Dark) and 4 salinities (32ppm, 30ppm, 28ppm and 25ppm). After 12 days of culture, it was observed that the highest number of cells/ml were obtained in the blue light treatment, with constant irradiation 24h and salinity of 28ppm. The photoperiod of 12h:12h (L/0) did not have a good effect on growth in any of the wavelengths of light used. Regarding biomass production, it was determined that the blue light treatment, photoperiod 16h:8h (L/O) and salinity of 30ppm was the one with the highest weight of dry biomass. The bioassays made it possible to determine that the combination of blue light, with constant irradiation 24h and salinity of 28ppm, showed the highest cell density.
Introducción
En acuicultura las microalgas son fuentes de alimento necesarias en diferentes fases de crecimiento por ser capaces de producir los nutrientes básicos y de calidad para el desarrollo de especies acuícolas en producción [1]. Estas se consideran una fuente primaria de proteínas, carbohidratos, lípidos y vitaminas, necesarios para el desarrollo larval de muchas especies de importancia económica de especies marinas. En específico, los lípidos son un nutriente muy importante durante el desarrollo temprano de las larvas al prevenir malformaciones, además de intervenir en la regulación de procesos fisiológicos como el crecimiento, osmorregulación y la reproducción [2].
Los ácidos grasos poliinsaturados, se utilizan en la industria alimentaria tanto animal como humana, entre los más utilizados están el ácido decosaexanoico (DHA) y ácido eicosapentaenoico (EPA), más conocidos como omega 3, los cuales son necesarios para un correcto funcionamiento metabólico, así como para prevenir enfermedades inflamatorias y neurodegenerativas [3][2], actualmente el DHA y el EPA se extraen del aceite de pescado, lo que ha provocado una sobreexplotación del recurso marino, sin embargo, por su importancia se hace necesario contar con diferentes fuentes para cumplir con los requerimientos nutricionales, tanto de las especies cultivadas como del ser humano, en respuesta a esto se han considerado fuentes alternativas como la producción las microalgas marinas, que al ser productoras primarias de omega 3, permitirían avanzar en el desarrollo de dietas balanceadas para el cultivo de peces de origen marino [4].
Es necesario establecer las características fisicoquímicas del cultivo de microalgas en reactores, ya que se requiere obtener una mayor producción de biomasa en menor tiempo, con alto contenido de DHA y EPA a menor costo [5]. Esto implica conocer con detalle la respuesta de la microalga en cuanto a duplicación y producción de biomasa, cuando se expone a diferentes condiciones como fotoperíodo, concentración salina y diferentes longitudes de onda de la luz (WL, siglas en inglés) [5] [6]. La inducción de las microalgas a condiciones de estrés permite que esta utilice diferentes rutas metabólicas y como resultado de esto, la acumulación de metabolitos primarios como lípidos en el citoplasma [7] [8].
Estudios realizados en biorreactores, que utilizan lámparas fluorescentes con una longitud de onda de luz (WL, por sus siglas en inglés) que va desde los 400 y hasta los 500 nm, han revelado que las microalgas presentan baja actividad fotosintética y que el uso de estas luces implica un alto consumo energético por el uso ineficiente de la luz [9] [10] [11]. Para mejorar la eficiencia fotosintética de las microalgas se utilizan LEDS (diodos emisores de luz), que permiten utilizar WL específicas y monocromáticas [12]. Zhong et al. [13], emplearon luces LED con WL roja y azul en cultivos de especies de Phaeodactylum tricornutum, Isochrysis galbana, Nannochloropsis salina y Nannochloropsis oceánica y determinaron que estas longitudes de onda estimulan pigmentos fotosintéticos, que da como resultado un aumento de células/ml y una mejor composición bioquímica en contraposición a las microalgas cultivadas con luz blanca. Yoshioka et al. [14], Sánchez-Saavedra et al. [11], aplicaron luz azul a un cultivo con la especie I. galbana y determinaron que esta WL fomenta la duplicación celular en menor cantidad de tiempo.
Con respecto al mejoramiento de la eficiencia de la cinética de crecimiento de la microalga en respuesta a los cambios del fotoperiodo, Sirisuk et al. [12] determinaron que el crecimiento celular bajo diferentes WL varía de acuerdo con el fotoperiodo utilizado. La luz continua (24h) aplicada a los cultivos tiene un efecto directo positivo en su capacidad para aumentar la biomasa [15], sin embargo, Sirisuk et al. [12] y Zhong et al. [13], probaron otros fotoperiodos similares a las condiciones de luz natural y determinaron que bajo un régimen de irradiación de 16h:8h (L/O), la densidad celular aumenta, esto permite mejorar la eficiencia de producción al cultivar las microalgas con iguales o mejores resultados de crecimiento y a un menor costo energético. Yoshioka et al. [14], cultivaron Isochrysis galbana, hicieron modificaciones en la WL y el fotoperiodo y observaron que estos cambios tienen un efecto positivo en la cinética de crecimiento, pues bajo condiciones de luz azul intermitente, hubo aumento de la densidad celular, comparada con el tratamiento control de luz blanca continua, reportaron una densidad celular de 3.5±0.6×105 células mL−1 y 1.9±0.3×105 cel/ ml−1 respectivamente.
Las concentraciones de salinidad en el medio de cultivo también interactúan con la WL, el uso de salinidades similares a las del medio natural donde habita la microalga, permite reducir el estrés de las células y obtener una mejor densidad celular, esto se debe a que la salinidad tiene un importante papel en la osmorregulación celular [1]. Suyono et al. [16]demostraron que en cultivos de Chlorella vulgaris expuestos a luz azul y salinidades de 12ppm, 19ppm y 21ppm, se alcanza mayor biomasa, en los cultivos con salinidad de 19 ppm. Por otro lado, Ra et al. [17], con I. galbana determinó que la biomasa se incrementa, al cultivarla con una salinidad de 32 ppm y longitud de onda de luz azul, contrario a cuando se cultiva con luces rojas y blancas y la misma salinidad.
Este estudio pretende determinar el efecto de la longitud de onda de luz, el fotoperiodo y la salinidad, en la cinética de crecimiento de Isochrysis galbana. con el fin de generar las condiciones óptimas de menor costo y de mayor rendimiento en la producción de biomasa.
Metodología
El montaje de los sistemas de cultivo y los bioensayos, se realizaron en el Laboratorio de Producción de Plancton Marino (LPPM) de la Estación de Biología Marina de la Universidad Nacional, una vez establecidos los cultivos, las muestras diarias tomadas de los botellones se llevaron al Laboratorio de Patología Acuícola (LAPA) de la Universidad Técnica Nacional para determinar la densidad óptica y realizar los conteos celulares, ambos laboratorios están ubicados en la ciudad de Puntarenas, Costa Rica. Al finalizar, los cultivos se trasladaron al Laboratorio de Microalgas del Instituto Tecnológico de Costa Rica, donde se concentró la biomasa y se realizaron los análisis a la biomasa microalgal.
Se empleó la microalga Isochrysis galbana, por su alto contenido de proteínas, así como de lípidos, especialmente del ácido graso docosahexanoico (DHA), la cepa fue suministrada por el Laboratorio de Producción de Plancton Marino de la Universidad Nacional. Se cultivó en un sistema tipo “batch” en botellones con 6 L de capacidad, a 25 °C ± 2°C, con flujo de aire constante y medio de cultivo “F/2” de Guillar (J. Stein, 1979). El equipo de iluminación consistió en barras de luces LED blancas de 18W y 6000 K e intensidad lumínica de 76.44 µmoles/m2/s y barras de luz LED azul de 18W y 6000 K, con una intensidad lumínica de 32.48 µmoles/m2/s, colocadas en posición vertical para cubrir en toda la longitud a dos botellones,
Para analizar el efecto en la cinética de crecimiento de I. galbana con diferente longitud de onda de la luz, fotoperiodo y concentración de la salinidad se evaluó en este estudio: dos longitudes de onda de la luz azul (455nm) y blanca (500 nm), tres fotoperiodos 16h:8h, 12h:12h (L/O), 24 h (luz) y cuatro salinidades (32ppm, 30ppm, 28ppm y 25ppm), con tres repeticiones cada uno, con una duración de cultivo de 12 días y con un volumen de trabajo de 5.5 L. Los controles para cada tratamiento fueron cultivados con luz blanca o azul, salinidad de 32 ppm y 24 horas de luz continua.
Durante los 12 días de cultivo, se tomaron 5 ml de cada unidad experimental a la misma hora y se fijaron con lugol para realizar el conteo celular (cel/ml), cada muestra se contó en la cámara Neaubauer, haciendo una dilución 1:10. La evaluación de la densidad óptica se realizó en un biofotómetro (Eppendorf, modelo D30), con una longitud de onda de 550 nm [18]. Para la determinación del peso seco de la biomasa se tomaron 10 ml de cada tratamiento en el día 12, se utilizó un filtro de acetato de celulosa de 0.2 µm previamente seco, posteriormente la muestra se filtró con un Kitasato, se llevó a un horno a 60°C hasta llevar a peso constante. La biomasa filtrada se colocó en un analizador de humedad (RADWAG PMR 50) para calcular la humedad relativa de la misma.
Para calcular los parámetros productivos microalgales en los cultivos de I. galbana, se emplearon las fórmulas descritas en el cuadro 1.
Cuadro 1. Fórmulas para cálculo de parámetros productivos microalgales.
|
Incógnita |
Fórmula* |
|
Concentración celular en cámara de NeauBauer |
|
|
Velocidad de crecimiento en fase exponencial(µe) |
|
|
Productividad de biomasa (cel/ml d-1x10-6) |
|
*C= células/mL; N=promedio de células presentes en 1 mm2; 104= factor de conversión de 0.1 µL a 1 mL; dil= dilución (1:10)
Para cada color de luz y fotoperiodo se hizo una comparación entre salinidades, para determinar si tenían un efecto significativo sobre la velocidad de crecimiento y la productividad de la biomasa, para esto se aplicó la prueba de normalidad Shapiro wilk, un análisis de varianza de una vía ANOVA y una prueba post-hoc de Tukey (p ≤ 0.05), con el programa estadístico InfoStat estudiantil versión 2014.
En el análisis estadístico, se utilizaron modelos lineales generalizados mixtos, para determinar el efecto de los tratamientos (longitud de onda, salinidad y fotoperíodo) sobre la producción de biomasa (g/ml) y densidad celular. Para analizar el efecto de las variables a evaluar sobre la producción de biomasa y la densidad celular se incluyó en el modelo: el tratamiento y las repeticiones como variables predictivas. Inicialmente, el modelo incluía todas las variables predictivas mencionadas anteriormente y las interacciones entre ellas (modelo saturado). Para el modelo final, se excluyeron aquellas variables que no tuvieron impacto en la predicción del efecto que tienen la longitud de onda, el fotoperíodo y la salinidad, sobre la producción de biomasa y la densidad celular, utilizando los criterios de Akaike (AIC) y el análisis de los residuos. Los análisis estadísticos y los gráficos se realizaron utilizando el lenguaje estadístico R (versión 3.02: R Core Team 2013).
Los resultados obtenidos a partir de este estudio demostraron que, la longitud de onda de la luz, el fotoperiodo y la salinidad afectan la producción de biomasa en los cultivos de microalgas.
Al estimar los parámetros de cinética celular y analizar los cambios en la productividad celular diaria (cel/ml día-1), se observó que en los cultivos microalgales sometidos al tratamiento de luz azul, y con salinidad de 28 ppm e irradiación continua (24h), hubo un aumento significativo en la productividad 1,43 ± 0,05 cel/ml d-1 (p-valor ≤ 0.05) respecto a aquellos cultivos que se sometieron a la condición de luz blanca (figura 1). Los cultivos con un fotoperiodo de 12h:12h (L/O), tanto en luz blanca como en luz azul, mostraron una productividad de la microalga significativamente menor, específicamente el fotoperiodo 12h:12h (L/O) y salinidad de 32ppm obtuvo la menor productividad con 0,63 ± 0,12 cel/ml d-1 (p-valor ≤ 0.05) (figura 1). Para el color de luz blanca, se observó que el tratamiento con fotoperiodo 16h:8h (L/O) y salinidad de 25ppm, fue el que tuvo un aumento significativo en la productividad celular diaria con un valor de 1,27 ± 0,03 cel/ml d-1 (p-valor ≤ 0.05) (figura 1).
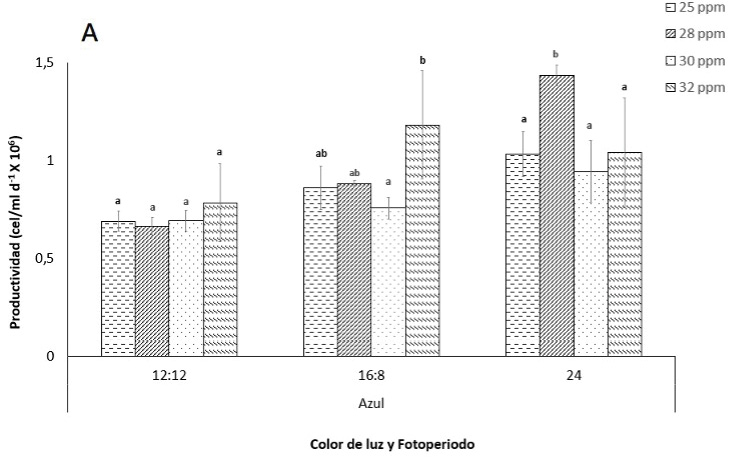

Figura 1. Efecto del fotoperiodo, salinidad y color de luz en la productividad (cel/ml d-1x10-6) de I.galbana. A. Tratamiento de luz azul, B. Tratamiento luz blanca. Las barras de error representan la desviación estándar (n=3). Valores que no comparten una letra son significativamente diferentes (p-valor ≤ 0.05) dentro de los tratamientos.
Los análisis de la velocidad de crecimiento µe(d-1) de los cultivos celulares de I. galbana, se observa que, con luz azul, con fotoperiodo 24 h y una salinidad de 28 ppm, se propicia el mayor crecimiento de la microalga 0,38 ± 0,006 µe(d-1) (p-valor ≤ 0.05), no así para los cultivos donde se utilizó luz blanca, que se obtiuvieron los mejores resultados de velocidad de crecimiento con una salinidad de 25 ppm y el fotoperiodo de 16h:8h (L/O) 0,36 ± 0,003 µe(d-1) (p-valor ≤ 0.05) (figura 2). De igual manera se observó que el fotoperiodo 12h:12h (L/O) tuvo una velocidad de crecimiento significativamente menor en ambos colores de luz utilizados, con resultados más bajos en las condiciones de luz blanca y salinidad de 32 ppm 0,19 ± 0,02 µe(d-1) (p-valor ≤ 0.05) (figura 2).
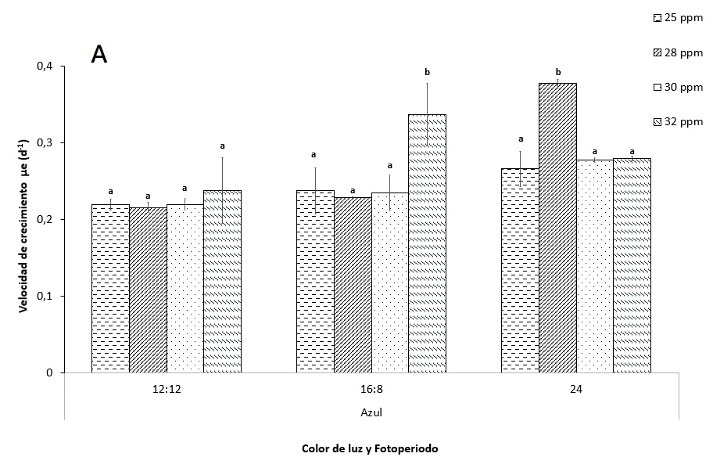
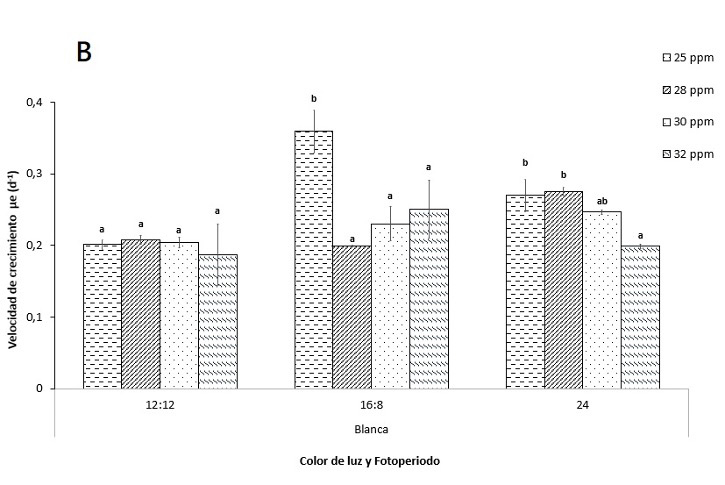
Figura 2. Efecto del fotoperiodo, salinidad y color de luz en la velocidad de crecimiento en fase exponencial µe (d-1) de I.galbana. A. Tratamiento de luz azul, B. Tratamiento luz blanca. Las barras de error representan la desviación estándar (n=3). Valores que no comparten una letra son significativamente diferentes (p-valor ≤ 0.05) dentro de los tratamientos.
El análisis estadístico del modelo lineal mixto aplicado a los datos de densidad celular (cel/ml), permitió determinar el efecto que tuvieron los tres fotoperiodos con luz blanca y la salinidad en el medio de cultivo. Se demostró, que los cultivos con salinidades de 28ppm y 25ppm presentaron mayor cantidad de células por mililitro (P=0.0023 y P=0.0110 respectivamente), por otro lado, se observa que los cultivos llegaron a alcanzar mayor densidad celular con fotoperiodos de 24h y de 16h:8h (L/O) (cuadro 2).
Cuadro 2. Modelo lineal mixto para luz blanca, en salinidades 32 ppm, 30 ppm, 30 ppm, 30ppm, 28ppm y 25ppm, con fotoperiodos 24 h luz, 12h:12h y 16h:08h (L/O).
|
Tratamiento |
Estimado |
Error Estándar |
df |
T |
P(valor) |
|
(Intercept) 32ppm 12h |
4.230e+06 |
6.825e+05 |
1.268e+01 |
6.197 |
3.61e-05 *** |
|
30ppm |
1.015e+05 |
1.181e+05 |
3.868e+21 |
0.860 |
0.3900 |
|
28ppm |
3.600e+05 |
1.181e+05 |
3.879e+21 |
3.048 |
0.0023 ** |
|
25ppm |
3.002e+05 |
1.181e+05 |
2.681e+21 |
2.541 |
0.0110 * |
|
16h |
1.382e+06 |
1.023e+05 |
6.682e+22 |
13.510 |
< 2e-16 *** |
|
24h |
1.378e+06 |
1.023e+05 |
1.913e+22 |
13.471 |
< 2e-16 *** |
En el análisis de la interacción de la densidad celular en cultivos microalgales expuestos a luz azul, donde se considera el fotoperiodo vs concentración de salinidad vs día, muestran que las densidades son similares en casi todos los tratamientos estudiados. Se observó que, indistintamente a la concentración de sal que se utilice en los cultivos, la densidad celular no cambió. Además, se determinó que existe una disminución en la densidad celular, en aquellos cultivos expuestos a fotoperiodo de 12h:12h L/O (P= 0.00418) (cuadro 3).
Cuadro 3. Modelo lineal mixto para determinar el efecto de luz azul, en salinidades 32 ppm, 30ppm, 28ppm y 25ppm, con fotoperiodos 24 h luz, 12h:12h y 16h:08h (L/O).
|
Tratamiento |
Estimado |
Error Estándar |
df |
T |
P(valor) |
|
(Intercept) 32ppm 24h |
2.512e+06 |
2.409e+05 |
4.471e+42 |
10.431 |
< 2e-16 *** |
|
30ppm |
-2.356e+05 |
1.830e+05 |
4.471e+42 |
-1.287 |
0.19797 |
|
28ppm |
2.874e+04 |
1.830e+05 |
4.471e+42 |
0.157 |
0.87520 |
|
25ppm |
1.508e+04 |
1.843e+05 |
4.471e+42 |
0.082 |
0.93477 |
|
16h |
-4.652e+05 |
3.001e+05 |
4.471e+42 |
-1.550 |
0.12117 |
|
12h |
-8.596e+05 |
3.001e+05 |
4.471e+42 |
-2.864 |
0.00418 ** |
|
día |
6.819e+05 |
3.051e+04 |
4.471e+42 |
22.346 |
< 2e-16 *** |
|
16h:día |
-6.251e+04 |
4.276e+04 |
4.471e+42 |
-1.462 |
0.14373 |
|
12h:día |
-1.980e+05 |
4.276e+04 |
4.471e+42 |
-4.631 |
3.64e-06 *** |
El modelo lineal mixto de la densidad celular, que compara los cultivos sometidos a luz azul vs luz blanca con diferentes fotoperiodos (24 h luz, 16h:08h (L/O)) y salinidades muestran que, con luz azul continua de (24h) (P<0.001) y una salinidad de 28 ppm ((P<0.000251) hay una mayor densidad celular, que en aquellos cultivos sometidos a luz blanca (P<0.001) (cuadro 4).
Cuadro 4. Modelo lineal mixto para determinar el efecto de luz azul vs luz blanca, en salinidades 32 ppm, 30ppm, 28ppm y 25ppm, con fotoperiodos 24 h luz y 16h:08h (L/O).
|
Tratamiento |
Estimado |
Error Estándar |
df |
T |
P(valor) |
|
(Intercept) 32ppm 24h |
6.210e+06 |
7.372e+05 |
1.228e+01 |
8.424 |
1.88e-06 *** |
|
30ppm |
-1.074e+05 |
1.002e+05 |
1.167e+22 |
-1.072 |
0.283693 |
|
28ppm |
3.668e+05 |
1.002e+05 |
1.562e+22 |
3.661 |
0.000251 *** |
|
25ppm |
1.889e+05 |
1.007e+05 |
7.867e+13 |
1.876. |
0.060708 |
|
16h |
-4.030e+05 |
7.102e+04 |
3.115e+14 |
-5.675 |
1.39e-08 *** |
|
Luz blanca |
-3.224e+05 |
7.102e+04 |
3.115e+14 |
-4.539 |
5.65e-06 *** |
Productividad de biomasa microalgal (g/L) en cultivos de I. galbana
El modelo linear con interacción, realizado para el análisis de la producción de biomasa, según cada tratamiento, mostró que se produjo mayor biomasa (g/L) bajo condiciones de luz blanca, con un fotoperiodo de 16h:8h (L/O), (P=0.00176) y salinidad de 30ppm, no así con los demás tratamientos analizados (cuadro 5, figura 3).
Cuadro 5. Efecto de la luz blanca, la salinidad y fotoperiodo, sobre el aumento del peso seco de la microalga Isochrysis galbana.
|
Tratamiento |
Estimado |
Error estándar |
df |
T |
P(valor) |
|
(Intercepto) 32ppm 24h |
0.376667 |
0.128845 |
24.000000 |
2.923 |
0.00744 ** |
|
30ppm |
-0.236667 |
0.182214 |
24.000000 |
-1.299 |
0.20634 |
|
28ppm |
-0.236667 |
0.182214 |
24.000000 |
-1.299 |
0.20634 |
|
25ppm |
-0.133333 |
0.182214 |
24.000000 |
-0.732 |
0.47141 |
|
16h |
-0.033333 |
0.182214 |
24.000000 |
-0.183 |
0.85639 |
|
12h |
0.003333 |
0.182214 |
24.000000 |
0.018 |
0.98556 |
|
30ppm:16h |
0.906667 |
0.257689 |
24.000000 |
3.518 |
0.00176 ** |
|
28ppm:16h |
0.123333 |
0.257689 |
24.000000 |
0.479 |
0.63655 |
|
25ppm:16h |
0.016667 |
0.257689 |
24.000000 |
0.065 |
0.94897 |
|
30ppm:24h |
0.213333 |
0.257689 |
24.000000 |
0.828 |
0.41590 |
|
28ppm:24h |
0.286667 |
0.257689 |
24.000000 |
1.112 |
0.27696 |
|
25ppm:24h |
-0.010000 |
0.257689 |
24.000000 |
-0.039 |
0.96937 |
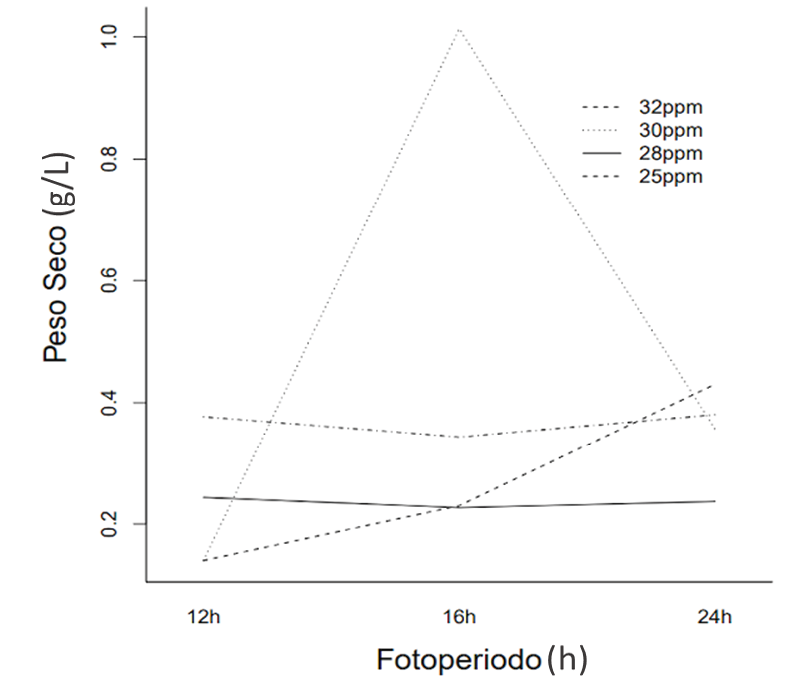
Figura 3. Interacción estadística del modelo lineal del efecto del color de la luz blanca, la salinidad y fotoperiodo, sobre el aumento del peso seco de la microalga Isochrysis galbana.
Los resultados de interacción del modelo lineal mixto aplicados a la producción de biomasa en cultivos expuestos a luz azul, diferentes fotoperiodos y al efecto de la salinidad, se determina que, en todos los casos, la producción es similar en todos los tratamientos. Por otro lado, cuando se analiza la variable fotoperiodo y la de salinidad, determina que se produce mayor cantidad de biomasa, con un fotoperiodo de 16h:8h (L/O) y una salinidad de 32ppm (P<0.0001). Además, en esta prueba la interacción de variables analizadas demuestra que, el fotoperiodo vs salinidad produce menor biomasa en los cultivos con un fotoperiodo de 16h:8h (L/O) y 25 ppm de salinidad (P<0.0001) (cuadro 6, figura 4).
Cuadro 6. Análisis de interacción del efecto del color de la luz azul, la salinidad y fotoperiodo, sobre la productividad de biomasa de la microalga Isochrysis galbana.
|
Tratamiento |
Estimado |
Error estándar |
df |
T |
P(valor) |
|
(Intercepto) 32ppm 12h |
3.667e-01 |
6.439e-02 |
2.242e+01 |
5.695 |
9.31e-06 *** |
|
30ppm |
-4.667e-02 |
8.882e-02 |
2.093e+01 |
-0.525 |
0.6048 |
|
28ppm |
4.333e-02 |
8.882e-02 |
2.093e+01 |
0.488 |
0.6307 |
|
25ppm |
-1.200e-01 |
8.882e-02 |
2.093e+01 |
-1.351 |
0.1911 |
|
16h |
5.467e-01 |
8.882e-02 |
2.093e+01 |
6.155 |
4.23e-06 *** |
|
24h |
-2.333e-01 |
8.882e-02 |
2.093e+01 |
-2.627 |
0.0158 * |
|
30ppm:16h |
-2.233e-01 |
1.256e-01 |
2.093e+01 |
-1.778 |
0.0899. |
|
28ppm:16h |
-1.667e-01 |
1.256e-01 |
2.093e+01 |
-1.327 |
0.1989 |
|
25ppm:16h |
-6.700e-01 |
1.256e-01 |
2.093e+ 01 |
-5.334 |
2.76e-05 *** |
|
30ppm:24h |
2.000e-02 |
1.256e-01 |
2.093e+01 |
0.159 |
0.8750 |
|
28ppm:24h |
2.390e-15 |
1.256e-01 |
2.093e+01 |
0.000 |
1.0000 |
|
25ppm:24h |
1.144e-01 |
1.335e-01 |
2.120e+01 |
0.857 |
0.4012 |
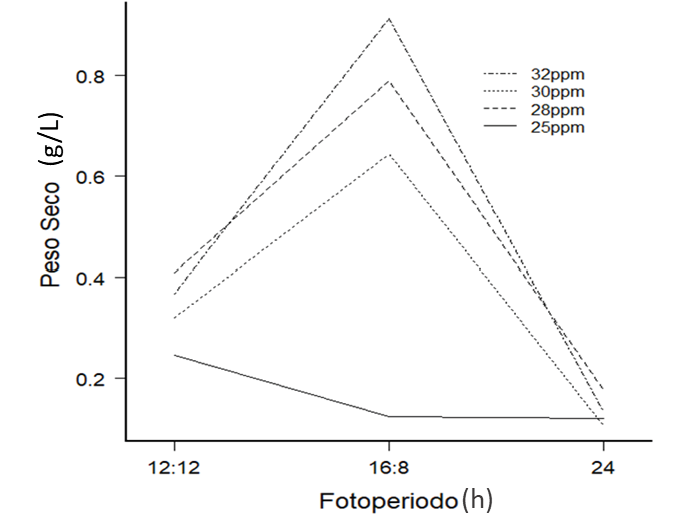
Figura 4. Análisis de interacción del efecto del color de la luz azul, la salinidad y fotoperiodo, sobre la productividad de biomasa de la microalga Isochrysis galbana.
En general cuando se comparan ambos colores de luz empleados en los cultivos, se determina que la luz azul y el fotoperiodo 16h:8h (L/O) y salinidades de 28ppm, 30 ppm y 32 ppm induce a una mayor producción de biomasa (cuadro 7).
Cuadro 7. Análisis de modelo linear entre el efecto de la productividad biomásica, cuando se expone a luz blanca y luz azul. Se analiza la concentración de la salinidad y fotoperiodo, sobre la productividad de biomasa de la microalga Isochrysis galbana.
|
Tratamiento |
Estimado |
Error Estándar |
df |
T |
P(valor) |
|
(Intercept) 32ppm 12h |
0.35625 |
0.07769 |
64.00000 |
4.585 |
2.16e-05 *** |
|
30ppm |
0.01111 |
0.08306 |
64.00000 |
0.134 |
0.89400 |
|
28ppm |
-0.05611 |
0.08306 |
64.00000 |
-0.676 |
0.50174 |
|
25ppm |
-0.22074 |
0.08432 |
64.00000 |
-2.618 |
0.01103 * |
|
Luz Blanca |
-0.01879 |
0.05918 |
64.00000 |
-0.318 |
0.75183 |
|
16h |
0.25500 |
0.07193 |
64.00000 |
3.545 |
0.00074*** |
|
24h |
-0.03889 |
0.07275 |
64.00000 |
-0.535 |
0.59481 |
Discusión
En los bioensayos realizados, se pudo determinar que, tanto en luz blanca como en luz azul, los fotoperiodos tienen un papel importante en el aumento de parámetros de producción de la microalga, resultando que el fotoperiodo con menor tiempo irradiación, no favorece los parámetros productivos, en ninguno de los colores de luz y concentraciones de salinidad probados; se observó en el resultado de la interacción linear para luz blanca, que en los fotoperiodos de 24h y 16h:8h (L/O) con 28ppm y 25 ppm de salinidad hubo mayor densidad celular, resultado congruente con el obtenido en el análisis de varianza para comparar las salinidades, en cada color de luz y fotoperiodo, el cual permitió observar que, la producción de biomasa y la velocidad de crecimiento aumentan los fotoperiodos 24h y 16h:8h (L/O) y salinidades 28ppm y 25 ppm. Estos resultados pueden ser comparados a los obtenidos por Yusof et al. [15], quienes al cultivar I.galbana en condiciones de luz blanca y con fotoperiodos 12h:12h (L/O) y 24 h luz continua, observaron un aumento de la densidad celular al utilizar iluminación continua, atribuido a que mientras más largos sean los períodos de exposición a la luz, la microalga puede mantenerse en una fase continua de crecimiento, debido a que se garantiza que la energía total y el carbón fijado que se producen durante la fotosíntesis aumenten [19] [15].
El resultado del análisis de la interacción de los factores: luz azul vs luz blanca vs fotoperíodo vs salinidad sobre el efecto en la densidad celular (cel/m), demostró que los cultivos sometidos a luz azul con 24 h de exposición de fotoperiodo y con 28 ppm de salinidad presentan mayor cantidad de células/ mL, por otro lado a partir del análisis de varianza para comparar las salinidades, en cada color de luz y fotoperiodo permitió determinar que la producción de biomasa y la velocidad de crecimiento celular también son mayores en las condiciones de luz azul supracitadas. Esto es congruente con lo obtenido por Yoshioka et al. [14]; Sánchez-Saavedra et al. [11]; Sirisuk et al. [12], quienes emplearon diferentes longitudes de onda de luz (blanca, roja y azul), y pudieron observar que la densidad celular fue mejor bajo condiciones de luz azul, que con los demás colores probados. Como mencionan los autores supracitados, dicho comportamiento se puede deber a que Isochrysis galbana tiene una mejor capacidad de adaptarse a condiciones bajas de luminosidad, por el contenido clorofila c y clorofila a que posee en los cloroplastos, estos pigmentos absorben con mucha efectividad las bandas rojas y azules del espectro de luz, y le proporciona a la microalga la posibilidad de extender los espectros de absorción de la luz, permitiendo que la fotosíntesis se desarrolle, al garantizar un flujo continuo de electrones en los fotosistemas.
En cuanto al efecto de la concentración de salinidad utilizadas en los medios de cultivo de I galbana sobre la densidad celular (cel/ml), se observó que con 28ppm y 25 ppm aumento del número de células. Estudios realizados por Ono et al. [20], encontraron que el crecimiento de I.galbana en condiciones de salinidad de 27 ppm era mejor que en salinidades de 15 ppm o de 35 ppm, determinó que el efecto que tienen los valores altos de salinidad sobre el crecimiento de la especie son negativos y se manifiestan en la reducción de la tasa fotosintética de la microalga, la respiración y por ende en el crecimiento, por otro lado, si se trabaja con una salinidad baja en el medio de cultivo, se genera una condición hipotónica que hace que la célula se hinche y explote. En rangos de salinidad intermedios como los usados en este experimento, se pudo observar lo mencionado por Velasco et al. [1] y Cañaverate et al. [21] quienes determinaron que I. galbana tiene la capacidad de adaptarse a cambios de salinidad, esto lo hace al aumentar su volumen celular por medio de un mecanismo de regulación osmótica, en el cual capta iones hacia el interior de la célula y esto permite que se hinche sin reventarse y sin comprometer el buen funcionamiento de su mecanismo celular garantizando su crecimiento.
A partir de la interacción linear realizada para la producción biomásica microalgal (g/mL) se observó que hay un aumento de la producción en cultivos con luz blanca, con fotoperiodo 16h:8h (L/O) y salinidad de 30ppm, así mismo, las pruebas estadísticas de interacción entre luz blanca vs luz azul vs fotoperiodo vs salinidad señalan que la producción biomásica en luz azul es similar excepto por una marcada reducción en la biomasa, bajo condiciones de fotoperiodo 16h:8h (L/O) y salinidad de 25 ppm (L/O). Resultados similares a los obtenidos en este bioensayo fueron reportados por Che et al. [22] los investigadores observaron que I. galbana produce una mayor cantidad de biomasa bajo condiciones de fotoperiodo de 18h:6h (L/O), también observaron un aumento en la producción de lípidos bajo esas condiciones de fotoperiodo, lo cual puede explicar el aumento en el peso de la biomasa, Matos et al. [19] mencionan que, el período de exposición a la luz tiene una influencia directa en la producción de biomasa seca en las microalgas, debido a que genera un aumento de la tasa metabólica, que se traduce en un aumento en la producción de biocompuestos a partir de la fotosíntesis como almidón, proteínas y lípidos, la acumulación intracelular de estos, aumenta el peso de la célula y reduce el contenido de agua.
En otros estudios se ha observado que la exposición a regímenes de luz y oscuridad favorece la producción de biomasa seca en la microalga [24], pues la célula bajo condiciones de exposición a la luz más prolongados seguidos por periodos cortos de oscuridad, produce mayor cantidad de energía durante la fase luminosa de la que se utiliza en la fase oscura de respiración (mantenimiento del metabolismo), este sobrante energético funciona como una reserva que la célula utiliza, para continuar con sus procesos metabólicos durante la fase oscura, el resultado de esto es un aumento en la producción de metabolitos primarios y secundarios que se acumulan dentro de la célula y reducen el contenido de agua [19] [15].
Otro de los aspectos que pueden producir un aumento en la biomasa (g/L) es la etapa en la cual se hace la cosecha de la biomasa, al respecto Yusof et al. [15]; Alishah et al. [23] mencionan que el contenido de agua en la célula puede verse afectado por el tamaño de las organelas celulares, el cual varia por la acumulación de almidón, proteínas y lípidos en el citoplasma los cuales derivan de la fotosíntesis, estos compuestos se acumulan en la célula de manera diferente dependiendo de la fase de crecimiento en la que se encuentre el cultivo, y pueden aumentar al entrar en fase de crecimiento estacionaria [25]. En esta investigación, la cosecha de la biomasa se realizó durante la fase estacionaria, lo cual coincide con el mencionado por los autores, y pudo tener una influencia sobre el peso seco de la biomasa.
Este bioensayo permitió establecer que los cultivos sometidos a luz azul muestran un incremento en la densidad celular cuando se encuentran bajo un fotoperiodo 24h (L/O), con salinidad de 28 ppm. Se observó también que, con luz azul, fotoperiodo 16h:8h (L/O) y salinidades de 32ppm y 28 ppm, hay una mayor producción de biomasa. El conocimiento generado permitirá mejorar las condiciones de cultivo implementadas en el Laboratorio de producción de Plancton Marino, donde se cultiva la especie como alimento acuícola, la reducción del periodo de exposición a la luz y el cambio en el color de luz empleado permitirá obtener una concentración de células por mL adecuada para la alimentación y favorecer los parámetros productivos de la microalga.
Referencias
[1] L. A. Velasco, J. Barros-Gómez, G. H. Ospina-Salazar, and C. A. Trujillo, “Efecto de la intensidad lumínica, temperatura y salinidad sobre el crecimiento de la microalga Isochrysis galbana (clon T-ISO),” Revista Intrópica, vol. 4, pp. 93–99, 2009, Accessed: Jan. 26, 2023. [Online]. Available: https://revistas.unimagdalena.edu.co/index.php/intropica/article/view/142
[2] D. Lorenzo et al., “Los lípidos en los peces y los aportes benéficos en la salud humana”, Kuxulkab, vol. 23, no. 47, pp. 23–30, 2017, [Online]. Available: www.dgbiblio.unam.mx
[3] C. Bonfanti et al., “Potential of microalga Isochrysis galbana: Bioactivity and bioaccessibility,” Algal Res, vol. 29, pp. 242–248, 2018, doi: 10.1016/j.algal.2017.11.035.
[4] I. Barkia, N. Saari, and S. R. Manning, “Microalgae for high-value products towards human health and nutrition,” Marine Drugs, vol. 17, no. 5. p. 304, 2019. doi: 10.3390/md17050304.
[5] K. K. Sharma, H. Schuhmann, and P. M. Schenk, “High lipid induction in microalgae for biodiesel production,” Energies (Basel), vol. 5, no. 5, pp. 1532–1553, 2012, doi: 10.3390/en5051532.
[6] W. S. Shin, S. M. Jung, C. H. Cho, D. W. Woo, W. Kim, and J. H. Kwon, “Use of tar color additives as a light filter to enhance growth and lipid production by the microalga nannochloropsis gaditana,” Environmental Engineering Research, vol. 23, no. 2, pp. 205–209, 2018, doi: 10.4491/eer.2017.162.
[7] F. Choix, “Evaluación de la acumulación de carbohidratos en la microalga Chlorella spp. Asociada con la bacteria Azospirillum brasilense,” Centro de Investigaciones Biológicas del Noroeste S.C, 2014.
[8] W. Pugkaew, M. Meetam, K. Yokthongwattana, N. Leeratsuwan, and P. Pokethitiyook, “Effects of salinity changes on growth, photosynthetic activity, biochemical composition, and lipid productivity of marine microalga Tetraselmis suecica,” J Appl Phycol, vol. 31, no. 2, pp. 969–979, 2019, doi: 10.1007/s10811-018-1619-7.
[9] M. Atta, A. Idris, A. Bukhari, and S. Wahidin, “Intensity of blue LED light: A potential stimulus for biomass and lipid content in freshwater microalgae Chlorella vulgaris,” Bioresour Technol, vol. 148, pp. 373–378, 2013, doi: 10.1016/j.biortech.2013.08.162.
[10] P. S. C. Schulze, L. A. Barreira, H. G. C. Pereira, J. A. Perales, and J. C. S. Varela, “Light emitting diodes (LEDs) applied to microalgal production,” Trends in Biotechnology, vol. 32, no. 8. Elsevier Ltd, pp. 422–430, 2014. doi: 10.1016/j.tibtech.2014.06.001.
[11] M. del Pilar Sánchez-Saavedra, A. N. Maeda-Martínez, and S. Acosta-Galindo, “Effect of different light spectra on the growth and biochemical composition of Tisochrysis lutea,” J Appl Phycol, vol. 28, no. 2, pp. 839–847, 2016, doi: 10.1007/s10811-015-0656-8.
[12] P. Sirisuk, C. H. Ra, G. T. Jeong, and S. K. Kim, “Effects of wavelength mixing ratio and photoperiod on microalgal biomass and lipid production in a two-phase culture system using LED illumination,” Bioresour Technol, vol. 253, pp. 175–181, 2018, doi: 10.1016/j.biortech.2018.01.020.
[13] Y. Zhong, P. Jin, and J. J. Cheng, “A comprehensive comparable study of the physiological properties of four microalgal species under different light wavelength conditions,” Planta, vol. 248, no. 2, pp. 489–498, 2018, doi: 10.1007/s00425-018-2899-5.
[14] M. Yoshioka, T. Yago, Y. Yoshie-Stark, H. Arakawa, and T. Morinaga, “Effect of high frequency of intermittent light on the growth and fatty acid profile of Isochrysis galbana”, Aquaculture, vol. 338–341, pp. 111–117, 2012, doi: 10.1016/j.aquaculture.2012.01.005.
[15] N. S. Yusof, Y. S. Yeong, H. A. Zakeri, M. E. A. Wahid, S. N. A. Ghafar, and N. Yusuf, “Photoperiod influenced the growth and antioxidative responses of Chlorella vulgaris, Isochrysis galbana, and Tetraselmis chuii,” J Appl Pharm Sci, vol. 11, no. 4, pp. 125–134, Apr. 2021, doi: 10.7324/JAPS.2021.110415.
[16] E. A. Suyono, A. Listyarini, and A. Hardiyati, “Effect High Salinity and Red-Blue Light Treatment on Lipid Content of the Microalgae Chlorella zofingiensis Dönz as Biodiesel Source,” Applied Mechanics and Materials, vol. 842, pp. 103–110, 2016, doi: 10.4028/www.scientific.net/amm.842.103.
[17] C. H. Ra, P. Sirisuk, J. H. Jung, G. T. Jeong, and S. K. Kim, “Effects of light-emitting diode (LED) with a mixture of wavelengths on the growth and lipid content of microalgae,” Bioprocess Biosyst Eng, vol. 41, no. 4, pp. 457–465, Apr. 2018, doi: 10.1007/s00449-017-1880-1.
[18] B. O. Arredondo-Vega and D. Voltolina, Concentración, recuento celular y tasa de crecimiento, 1st ed. La Paz, Baja California, México: Centro de Investigaciones Biológicas del Noroeste, S.C., 2007. [Online]. Available: https://www.researchgate.net/publication/253237563
[19] Â. P. Matos, M. G. Cavanholi, E. H. S. Moecke, and E. S. Sant’Anna, “Effects of different photoperiod and trophic conditions on biomass, protein and lipid production by the marine alga Nannochloropsis gaditana at optimal concentration of desalination concentrate,” Bioresour Technol, vol. 224, pp. 490–497, 2017, doi: 10.1016/j.biortech.2016.11.004.
[20] M. Ono, K. Sawada, Y. Shiraiwa, and M. Kubota, “Changes in alkenone and alkenoate distributions during acclimatization to salinity change in Isochrysis galbana: Implication for alkenone-based paleosalinity and paleothermometry,” 2012.
[21] J. P. Cañavate, I. Hachero-Cruzado, C. Pérez-Gavilán, and C. Fernández-Díaz, “Lipid dynamics and nutritional value of the estuarine strain Isochrysis galbana VLP grown from hypo to hyper salinity,” J Appl Phycol, vol. 32, no. 6, pp. 3749–3766, 2020, doi: 10.1007/s10811-020-02258-2.
[22] C. A. Che, S. Kim, H. Hong, M. Kityo, I. Sunwoo, and J. Jeong, “Optimization of light intensity and photoperiod for Isochrysis galbana culture to improve the biomass and lipid production using 14-L photobioreactors with mixed light emitting diodes (LEDs) wavelength under two-phase culture system,” Bioresour Technol, vol. 285, 2019, doi: 10.1016/j.biortech.2019.121323.
[23] H. Alishah Aratboni, N. Rafiei, R. Garcia-Granados, A. Alemzadeh, and J. R. Morones-Ramírez, “Biomass and lipid induction strategies in microalgae for biofuel production and other applications,” Microbial Cell Factories, vol. 18, no. 1. BioMed Central Ltd., p. 178, 2019. doi: 10.1186/s12934-019-1228-4.
[24] I. Krzemińska, B. Pawlik-Skowrońska, M. Trzcińska, and J. Tys, “Influence of photoperiods on the growth rate and biomass productivity of green microalgae,” Bioprocess Biosyst Eng, vol. 37, no. 4, pp. 735–741, 2014, doi: 10.1007/s00449-013-1044-x.
[25] M. Chioccioli, B. Hankamer, and I. L. Ross, “Flow cytometry pulse width data enables rapid and sensitive estimation of biomass dry weight in the microalgae Chlamydomonas reinhardtii and Chlorella vulgaris,” PLoS One, vol. 9, no. 5, pp. 1–29, 2014, doi: 10.1371/journal.pone.0097269.
1 Universidad Técnica Nacional, Sede Regional Puntarenas. Costa Rica. Correo electrónico: sramirezf@utn.ac.cr
2 Centro de Investigación en Biotecnología, Escuela de Biología, Instituto Tecnológico de Costa Rica. Costa Rica. Correo electrónico: frmurillo@itcr.ac.cr
https://orcid.org/0000-0002-2751-8390
3 Centro de Investigación en Biotecnología, Escuela de Biología, Instituto Tecnológico de Costa Rica. Costa Rica. Correo electrónico: fvillalta@itcr.ac.cr
https://orcid.org/0000-0001-7484-8125
4 Centro de Investigación en Biotecnología, Escuela de Biología, Instituto Tecnológico de Costa Rica. Costa Rica. Correo electrónico: mguerrero@itcr.ac.cr
https://orcid.org/0000-0002-8253-5919