Efecto de una crema elaborada con plantago major en un modelo murino de herida aguda de piel
Plantago major based ointment effect in wound healing murine model
Silvia Castro-Piedra1, Daniela Porras-Jara2, Karol Jiménez-Quesada3, Giovanni Garro-Monge4
Fecha de recepción: 20 de febrero, 2023
Fecha de aprobación: 12 de junio, 2023
Castro-Piedra, S; Porras-Jara, D; Jiménez-Quesada, K; Garro-Monge, G. Efecto de una crema elaborada con plantago major en un modelo murino de herida aguda de piel. Tecnología en Marcha. Vol. 37, No 1. Enero-Marzo, 2024. Pág. 149-162. https://doi.org/10.18845/tm.v37i1.6661
https://doi.org/10.18845/tm.v37i1.6661
Palabras clave
Callo friable; cultivo celular; formulación; histología; regeneración de piel.
Resumen
Plantago major (llantén), es una planta a la que se le han atribuido propiedades medicinales debido a la diversidad de compuestos que presenta. Está comprobado que extractos crudos de esta especie, pueden ayudar a la regeneración de la piel, estimular la proliferación celular y que tienen actividad antibacterial. Por lo anterior, en la presente investigación se buscó analizar la capacidad regenerativa de diferentes extractos de P. major en un modelo in vitro e in vivo, incluyendo los cultivos celulares de la planta como una alternativa biotecnológica para la producción de metabolitos de interés. Para ello, se establecieron cultivos callogénicos a partir de hojas de plantas in vitro, utilizando un medio de cultivo con 50% de sales y vitaminas M&S, suplementado con 2,5 mg/l de TDZ, sacarosa 3% m/v y pH 7. Se probaron distintas concentraciones de diferentes muestras de P. major para evaluar cual era el efecto sobre la migración celular in vitro. Posteriormente, luego de seleccionar el tratamiento de extracto de campo como el más eficiente in vitro, se elaboró una crema a base de esta planta para analizar el efecto durante las diferentes fases de regeneración en piel en un modelo murino. En el caso del modelo de regeneración in vivo parece ser que el extracto de P. major ejerce una acción antiinflamatoria lo que favorece el incremento en la tasa de regeneración. De esta manera se concluye que la especie P. major podría tener un efecto positivo en la fase aguda del proceso de regeneración en piel.
Keywords
Cell culture; callus; histology; pharmaceutical formulation; skin regeneration.
Abstract
Plantago major is a plant that has been attributed medicinal properties due to the diversity of compounds present in it. Crude extracts of this plant have been shown to aid in skin regeneration, stimulate cell proliferation, and exhibit antibacterial activity. This research aims to analyze the regenerative capacity of various extracts of P. major in an in vitro and in vivo model, including plant cell cultures, as biotechnology alternatives to produce metabolites of interest. Callus cultures were established in vitro using plant leaves cultured in M&S medium containing 50% salts and vitamins, supplemented with 2.5 mg/l TDZ, 3% m/v sucrose and pH 7. Different concentrations of P. major samples were tested to evaluate the in vitro cell migration. It was found that field extract treatment was the most efficient. Then, it was used to develop an ointment for analyzing its effect during skin wound healing phases in a murine model. The results of the in vivo regeneration model suggest that the P. major extract has anti-inflammatory properties which could increase the closure rate Thus, it is concluded that P. major species may be able to a positive effect on the acute phase of the skin wound healing.
Introducción
Durante muchos años, se ha venido investigando alrededor del mundo, los mecanismos de muchas de las plantas utilizadas en la medicina tradicional con el fin de demostrar su efectividad en diversas condiciones de salud [1]. Recientemente la Organización Mundial de la Salud estima que cerca del 80% de la población mundial utiliza plantas medicinales en algunos casos de atención primaria de salud [2] .
Una planta que ha sido muy utilizada en diferentes culturas es Plantago major. En el caso de esta especie, se le ha atribuido propiedades regenerativas específicamente a las hojas y a las semillas ya que se ha evidenciado que Plantago major tiene actividad antiinflamatoria, analgésica, regenerativa, antioxidante e inmunomoduladora en estudios realizados a nivel in vitro e in vivo [1] [2]. Se considera que estas propiedades son brindadas por el contenido de compuestos bioactivos. A pesar de estos resultados, y que se ha venido estudiando los mecanismos implicados, existen muchas variables que dificultan la reproducibilidad de los resultados como lo son el origen de la planta, la metodología de elaboración del extracto y también la concentración utilizada. Por lo que es necesario estandarizar las condiciones para determinar el efecto biológico sobre las heridas.
Metodología
Establecimiento de cultivos callogénicos: La semilla, requerida para la introducción in vitro, fue suministrada por Laboratorios Lisan, a partir de su material de campo con el que cuentan para su Departamento de Investigación y Desarrollo de Procesos. El protocolo de introducción de semilla se apegó al establecido por Garro y Alvarenga en 2009 [7]. Una vez germinadas las semillas in vitro se trabajó con cultivo de ápices de acuerdo con el protocolo descrito por estos mismos autores.
A partir de las plántulas de llantén in vitro se extrajeron segmentos de hoja joven de 1 cm2 para la inducción de callogénesis somática, con el haz en contacto con el medio de cultivo. El medio de inducción de callogénesis, se formuló con una base de sales y vitaminas M&S [8] al 50 %, suplementado con 2,5 mg/l de TDZ, 3% m/v de sacarosa y pH 5,7; este medio de cultivo se denominó como M27.7 50S y corresponde al mismo empleado para el subcultivo del material también. Los explantes fueron colocados a una temperatura de 22°C y en condiciones de oscuridad durante 6 semanas.
Elaboración de extractos crudos y formulación cremosa: La sección de Investigación y Desarrollo de Procesos (I+D) de Laboratorios Lisan S.A. trabajó en el desarrollo de las metodologías de elaboración de extractos y de la formulación cremosa de uso tópico para comprobación de capacidad regenerativa de la planta en estudio. Los extractos hidro-alcohólicos crudos de P. major, elaborados por Laboratorios Lisan, se prepararon en una concentración de 10% p/v utilizando etanol al 95%, e incluyeron material de campo colectado a las 8 semanas de su cultivo, plantas in vitro de 6 semanas desde su subcultivo y cultivos callogénicos de 6 semanas (desde su 1er subcultivo).
Evaluación de la actividad regenerativa in vitro e in vivo: Para la prueba de migración y proliferación celular in vitro, se sembró una línea celular de fibroblastos murinos 3T3 a una densidad de 104 cél/pozo en placas de 24 pozos y se incubaron con medio DMEM suplementado con 10% de SFB hasta que alcanzaron una confluencia del 80%. En ese momento, se le realizó un rayado en forma de cruz en el centro de cada pozo. Luego, se realizaron lavados con PBS y se agregó DMEM con 5% de SFB como control y, se aplicaron las siguientes concentraciones: 0,02%, 0,04%, 0,06%, 0,08% y 0,1% de cada uno de los extractos de Plantago major: de hoja de planta de campo, de hoja de planta in vitro y de callo. Para este ensayo, se realizaron 4 repeticiones de cada tratamiento o condición y adicionalmente, se repitió 3 veces. Luego cada pozo fue fotografiado con el fin de observar la migración celular a través de la herida inducida. Este proceso se llevó a cabo hasta que la superficie fue totalmente cubierta. El proceso de captura de imágenes se realizó con un microscopio invertido Olympus CKX31. Luego con el programa de procesamiento de imágenes Image J 1.8 K (National Institutes of Health, USA), se analizó el porcentaje de área cubierta por migración de las células a las 24, 48 y 72 horas con los diferentes tratamientos. Los datos se analizaron con la prueba estadística ANOVA o bien Kruskal-Wallis, donde ρ ≤0,05 se consideró como estadísticamente significativo, para esto se utilizó el programa Minitab versión 18 (State College, PA).
Para la evaluación del P. major en el proceso de regeneración in vivo, se utilizaron 30 ratones de la cepa CD-1. Este experimento contó con la autorización del Comité Institucional de Cuido y Uso de los Animales de la UCR, siguiendo las recomendaciones y los lineamientos correspondientes para la ejecución de los experimentos.
Los ensayos se llevaron a cabo en el Instituto Clodomiro Picado de la Universidad de Costa Rica (UCR). Se trabajó con tres grupos de animales, todas hembras entre 5 y 6 semanas de nacidas de la cepa CD-1. El primer y segundo grupo consistieron de 12 animales cada uno. El tercer grupo, estuvo conformado por 6 animales. El primer grupo se utilizó para aplicar el tratamiento control. Para este, se aplicó el gel con excipiente sobre la lesión. El segundo grupo fue utilizado para aplicar el gel elaborado a partir de un extracto acuoso Plantago major (tomado de campo) al 4%. Los individuos del tercer grupo se utilizaron como controles negativos, por lo que no se les aplicó ningún tratamiento. De manera general, a los animales se les indujo anestesia con ketamina (90 mg/kg) y xilacina (10 mg/kg) vía i.p. y se les realizó una herida estandarizada > 1cm2, eliminando epidermis y dermis. Justo después, se aplicó de forma tópica cada uno de los tratamientos el gel con excipiente, el gel con P. major y el control negativo donde no se aplicó nada. Este procedimiento se realizó diariamente durante una semana completa. Tres animales de cada grupo fueron eutanasiados en cámara de CO2 los días 3, 7, 14 y 28 post-herida, con el fin de analizar el tejido formado en cada una de las fases correspondientes a la regeneración de la piel. Para determinar la tasa de regeneración todos los animales fueron fotografiados todos los días utilizando la misma distancia focal y junto a una regla métrica (usada para la calibración y estandarización del área de la lesión). Las fotos fueron analizadas con el programa Image J y se calculó el porcentaje de regeneración cutánea. Se calculó el porcentaje de cierre con la siguiente fórmula: ((área de herida inicial - área de herida díaX) / área inicial)*100.Se aplicaron pruebas de Mann-Whitney haciendo uso de los programas estadísticos IBM®SPSS Statistics® y GraphPad Prism versión 5.00 para Windows. Se reportaron los resultados como las medias ± el error estándar (SE).
Después de cada eutanasia, se tomó una muestra de la piel de la zona de la herida, incluyendo una parte de la piel sana, y se colocó en una solución de formalina fosfatada a 4°C. El tejido cortó en secciones de 4 o 5 mm de tal forma que abarcara la zona lesionada y los márgenes sanos. Posteriormente las muestras se tiñeron con hematoxilina y eosina para realizar una evaluación microscópica de la estructura de la piel formada. Las imágenes histológicas de las muestras se tomaron usando una cámara Evolution MP (Media Cybernetics, USA) y se analizaron con el programa Image Pro 6.3 (Media Cybernetics, USA). Para determinar el depósito de colágeno, las muestras también se tiñeron con rojo sirio. Se cuantificó el porcentaje del tejido total relacionado con deposición de colágeno (fibrosis) a los 28 días, haciendo uso del programa computacional “ImageJ 1.51K” (National Institutes of Health, USA).
Resultados
Establecimiento de cultivos celulares
En la figura 1 se presentan los resultados obtenidos en la inducción de callogénesis a partir de hoja in vitro de Plantago major.

Figura 1. Callo de la línea L19-06 subcultivado en medio M27.7 50S con 6 semanas de crecimiento.
Estimulación de la migración celular in vitro
Tal y como se observa en la figura 2, parece que el extracto de callo en bajas concentraciones tiene una actividad biológica importante sobre la migración celular. Por ejemplo, a las 48 y 72 horas, ya se puede observar una diferencia significativa en la migración celular con la concentración de 0,02% cuando se compara con el control. Pero curiosamente, cuando se compara entre todas las concentraciones a las 48 horas, la diferencia en la migración no es significativa (ρ >0,05, ANOVA). A las 72 horas, se observa que el área no cubierta por células en el control es significativamente mayor en comparación las concentraciones analizadas (ρ <0,05, Kruskal-Walis y mediana de Mood). A pesar de estos resultados, en algunos casos se presentó citotoxicidad a partir de la concentración de 0,04%, por lo que se descarta este extracto para realizar los ensayos in vivo.
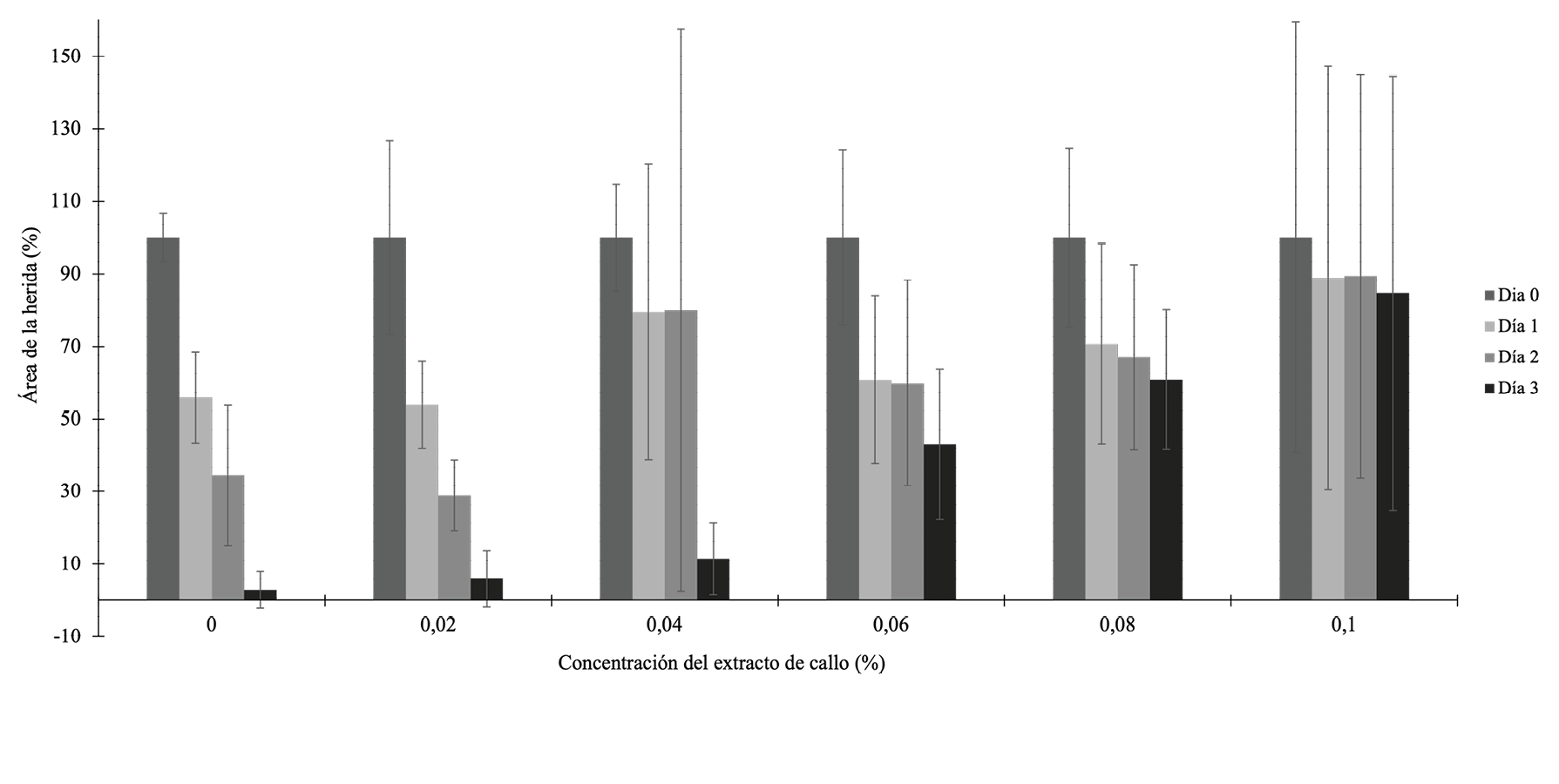
Figura 2. Efecto de un extracto de callo de P. major en diferentes concentraciones sobre la migración celular de fibroblastos murinos durante 24, 48 y 72 horas (Control, 0,02%, 0,06%, 0,08% y 0,1% ANOVA; 0,04% Kruskal Wallis). Las letras que son diferentes entre cada concentración (set de columnas) representan diferencias significativas.
En el caso del extracto de campo (figura 3), se puede afirmar que, a las 24 horas, a pesar de que en el control hubo menor porcentaje de cierre, no hay diferencias significativas entre los tratamientos (ρ >0,05, ANOVA). Pero, a las 48 horas, se encontró diferencias significativas entre el control y las concentraciones de 0,02%, 0,04%, 0,06% y 0,1%, siendo estas concentraciones más eficientes en estimular la migración celular (ρ <0,05, ANOVA). A las 72 horas, se encontró diferencia significativa entre 0.02% y el resto de concentraciones analizadas, incluido el control (ρ <0,05, Kruskal-Walis y prueba mediana de Mood). Lo anterior parece indicar que este extracto presenta alta bioactividad a bajas concentraciones. Sobre todo, porque desde la etapa anterior, es el que ha mostrado más reproducibilidad en los ensayos realizados.
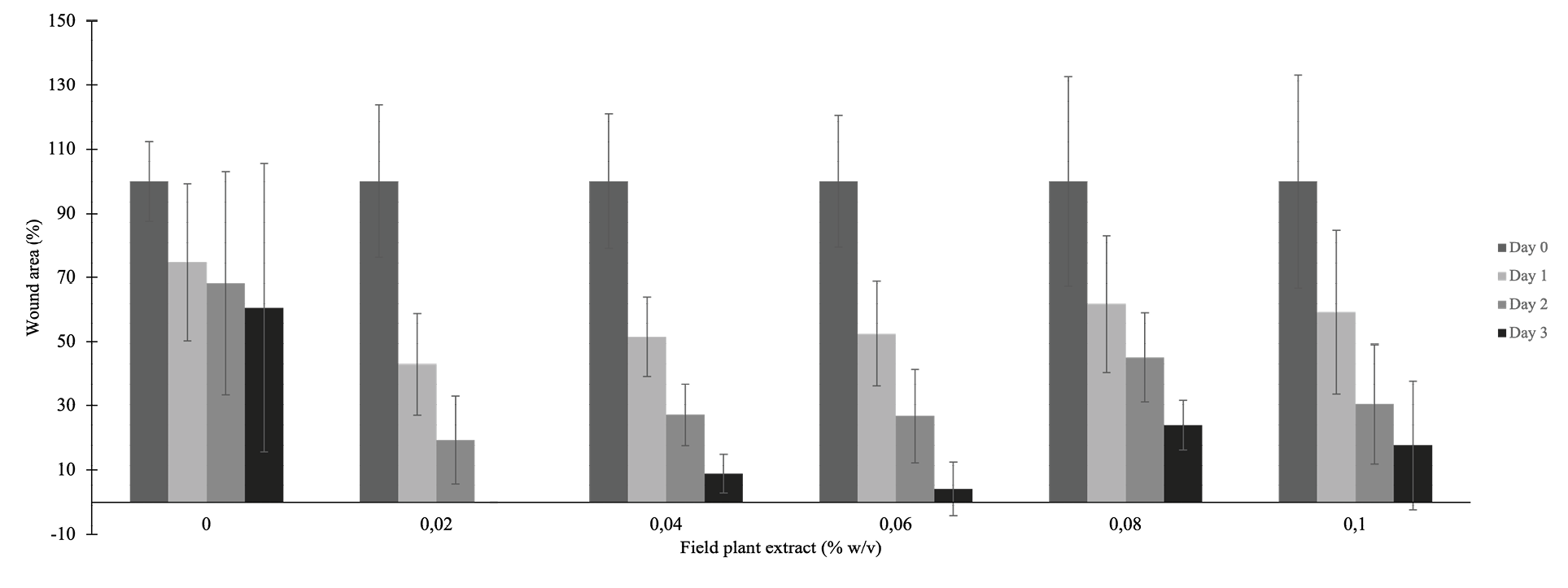
Figura 3. Efecto de un extracto de P. major (planta de campo) en diferentes concentraciones sobre la migración celular de fibroblastos murinos durante 24, 48 y 72 horas (ANOVA). Las letras que son diferentes entre cada concentración (set de columnas) representan diferencias significativas.
Finalmente, en el caso del extracto obtenido a partir de las plantas de llantén cultivadas in vitro (figura 4), a las 24 y 48 horas, a pesar de que en el control hubo menor porcentaje de cierre, en comparación con las diferentes concentraciones analizadas, no hay diferencias significativas entre cada una de las concentraciones analizadas en comparación con el control (ρ >0,05, Kruskal-Walis). A las 72 horas, se encontró diferencia significativa entre el control y los diferentes tratamientos. Sin embargo, entre tratamientos, no se encontró diferencias significativas, lo que indica que todas las concentraciones ejercen un efecto similar sobre la migración celular (ρ <0,05, Kruskal-Walis y prueba mediana de Mood). Aunque se podría considerar que este extracto presenta alta bioactividad en un rango de bajas concentraciones, se descarta para realizar las pruebas in vivo, debido a que sus resultados mostraron una gran desviación.
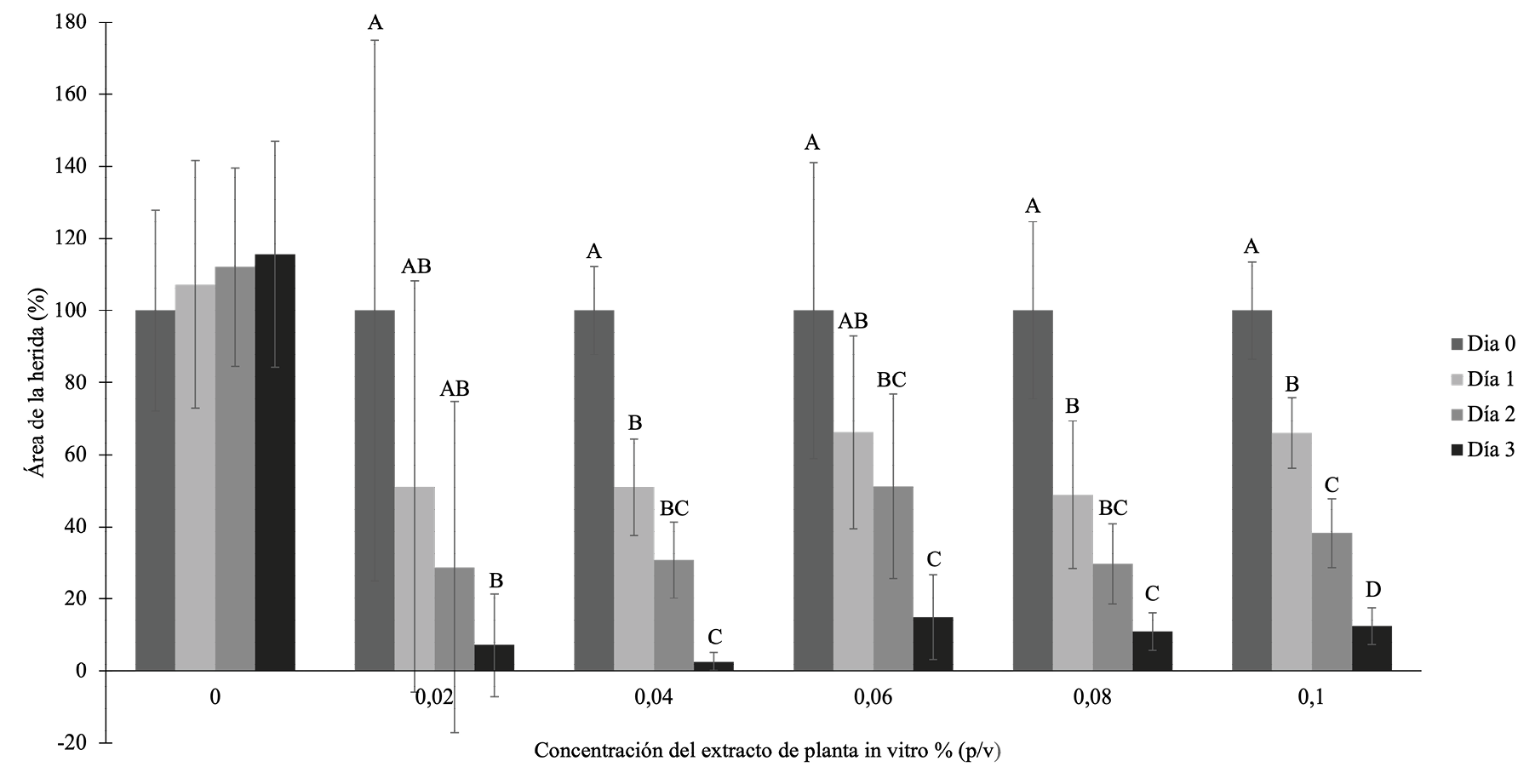
Figura 4. Efecto de un extracto de P. major (vitroplanta) en diferentes concentraciones sobre la migración celular de fibroblastos murinos durante 24, 48 y 72 horas. (ANOVA). Las letras que son diferentes entre cada concentración (set de columnas) representan diferencias significativas
Cuando se compara entre todos los tratamientos (extractos y concentraciones), se observa que, a las 24 horas, no hubo diferencias significativas entre las diferentes concentraciones de los 3 extractos, (ρ = 0,453, Kruskal-Walis). A las 48 horas, se encontró que los extractos de planta de campo al 0,02% y 0,04%, así como el extracto de callo al 0,02% y el extracto de planta de in vitro al 0,04%, estimula la migración de las células con respecto al resto de los tratamientos (ρ = 0,004, Kruskal Walis y Mediana de Mood). A las 72 horas, se encontró una migración significativamente superior cuando se utilizó el extracto de planta de campo e in vitro al 0.02% y 0,04%, lo que de nuevo demuestra que hay un potencial de esta planta a bajas concentraciones.
Efectos de P. major sobre la regeneración de la piel
En la figura 5 se puede observar la evolución de las heridas de acuerdo a los tratamientos aplicados durante un seguimiento de 28 días.
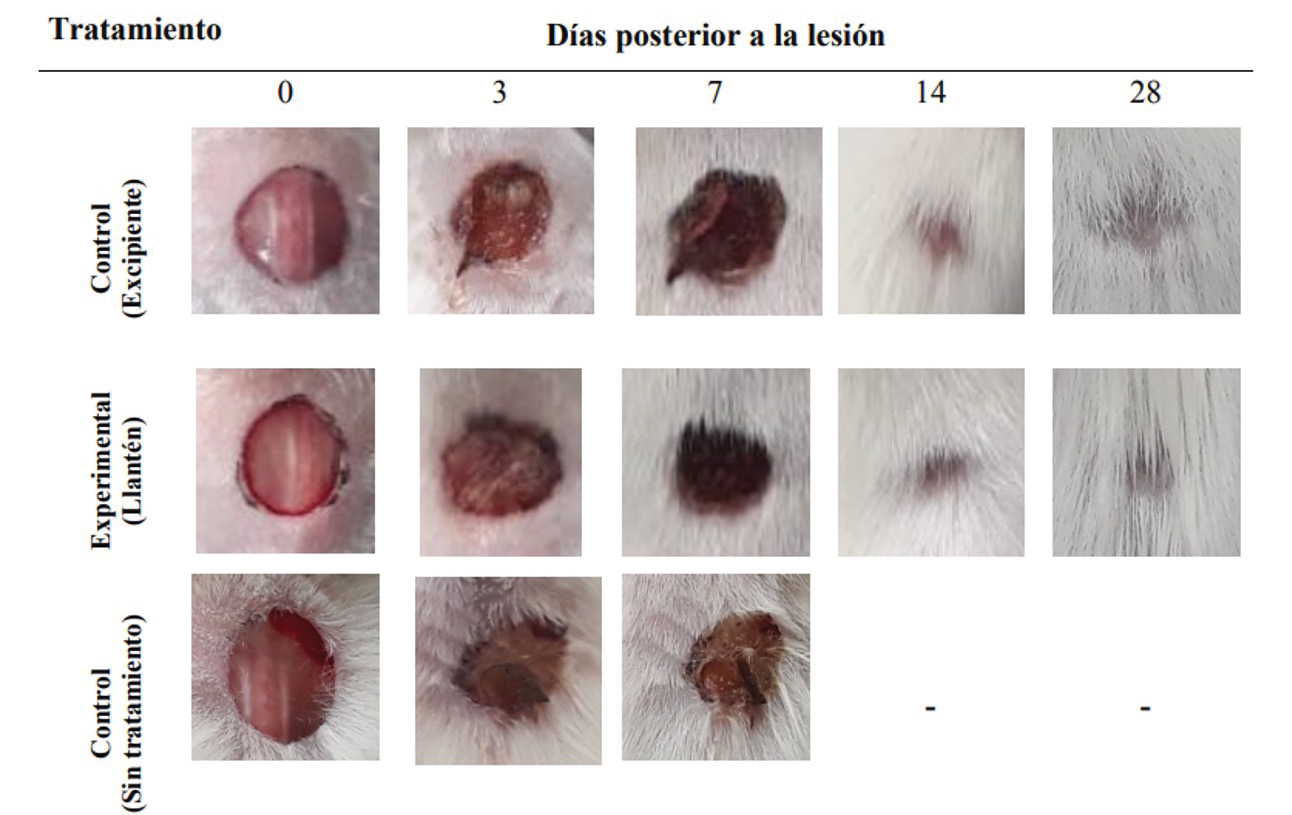
Figura 5. Imagen macroscópica de la evolución del proceso de regeneración de la lesión de los animales de experimentación desde el día 0 hasta el día 28. Se muestra la evolución del proceso para los diferentes tratamientos.
Como se puede apreciar, conforme avanza el tiempo la herida se contrae y cierra de manera progresiva en todos los tratamientos. Se observa que para el día 7 sin importar el tratamiento aplicado, la lesión presentaba un grano o costra, propio de la regeneración de heridas. Para el día 11, ya ninguno de los animales del tratamiento control con excipiente lo presentaban, caso contrario a los animales con el tratamiento experimental. De manera más específica, en la figura 6, se puede observar el porcentaje de cierre promedio calculado para los animales de cada respectivo día y tratamiento.
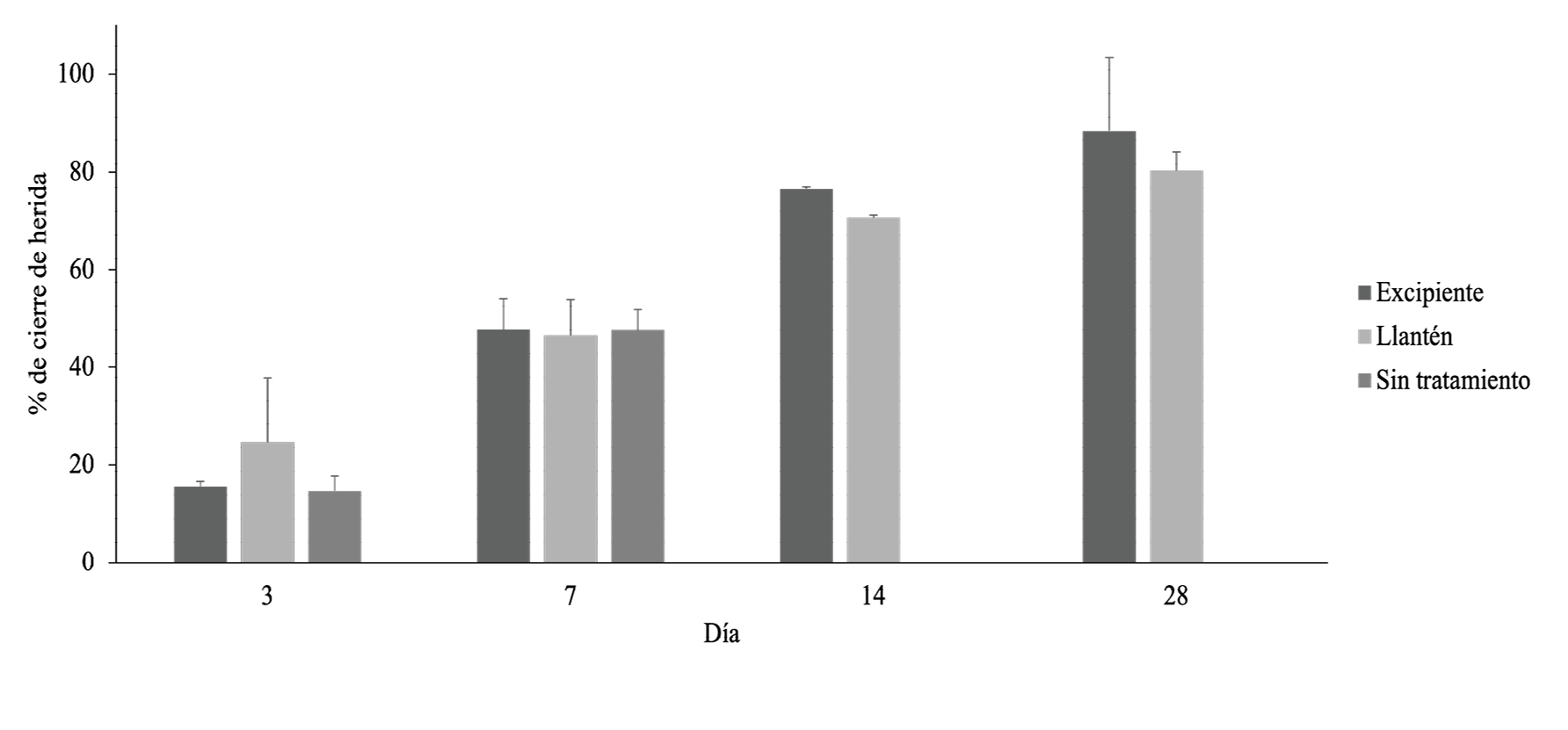
Figura 6. Porcentaje de cierre de la lesión para los animales en estudio.
En la figura 6 se puede observar que el porcentaje de cierre aumenta conforme avanza el tiempo en todos los casos. Además, se pueden apreciar que para el día 3, el porcentaje de cierre es mayor para los animales con el tratamiento experimental, pero, esta diferencia no es significativa (ANOVA Welch, p= 0,571). Caso semejante para estos últimos dos sucede en el día 7 (ANOVA, p= 0,967) y 28 (T-student, p =0,419). Sin embargo, en el día 14 se puede notar que el tratamiento control con excipiente tiene un porcentaje de cierre significativamente mayor que el tratamiento experimental (T-student, p <0,05).
Con respecto al conteo de polimorfonucleares, en el cuadro 1 se puede observar la cantidad de PMN/mm2 promedio para las muestras de cada tratamiento del día 3.
Cuadro 1. Cantidad de PMN/mm2 en la lesión de los animales de los diferentes tratamientos en el día 3.
|
Tratamiento |
PMN/mm2 |
|
Gel + excipiente |
2,126,6 ±117,26 |
|
Gel + P. major |
1,272,2 ± 167,91* |
|
Sin tratamiento |
2 183,3 ± 160,07 |
Se puede notar que la cantidad de PMN/mm2 para los animales tratados con el extracto de P.major en el día 3 es significativamente menor que la cantidad presente en los individuos tratados con solo el excipiente y sin aplicar tratamiento (ρ <0,05, Kruskal-Walis). Mientras que entre el tratamiento control con excipiente y el control sin tratamiento, el comportamiento es bastante semejante.
Con respecto al grosor de la epidermis (figura 7), el cambio a través del tiempo en los diferentes tratamientos puede observarse en la figura 7.

Figura 7. Cortes histológicos de una tinción con HE de muestras de piel de ratón sometidos a diferentes tratamientos. Aumento: 40x.
De manera más cuantitativa, la figura 8 muestra que el día 7 los animales tratados con el extracto de llantén tienen la epidermis menos gruesa de manera significativa (ANOVA, ρ<0,05), comparada con el grupo control excipiente y control sin tratamiento. Para el día 14 no hay diferencia significativa entre los tratamientos (T-student, ρ = 0,07) y a los 28 días tampoco (Mann-Whitney, ρ =0,306). El grosor de la epidermis obtenido a los 28 días es significativamente mayor que el grosor de una epidermis sana (17,3 µm, Wilcoxon, ρ <0,05).
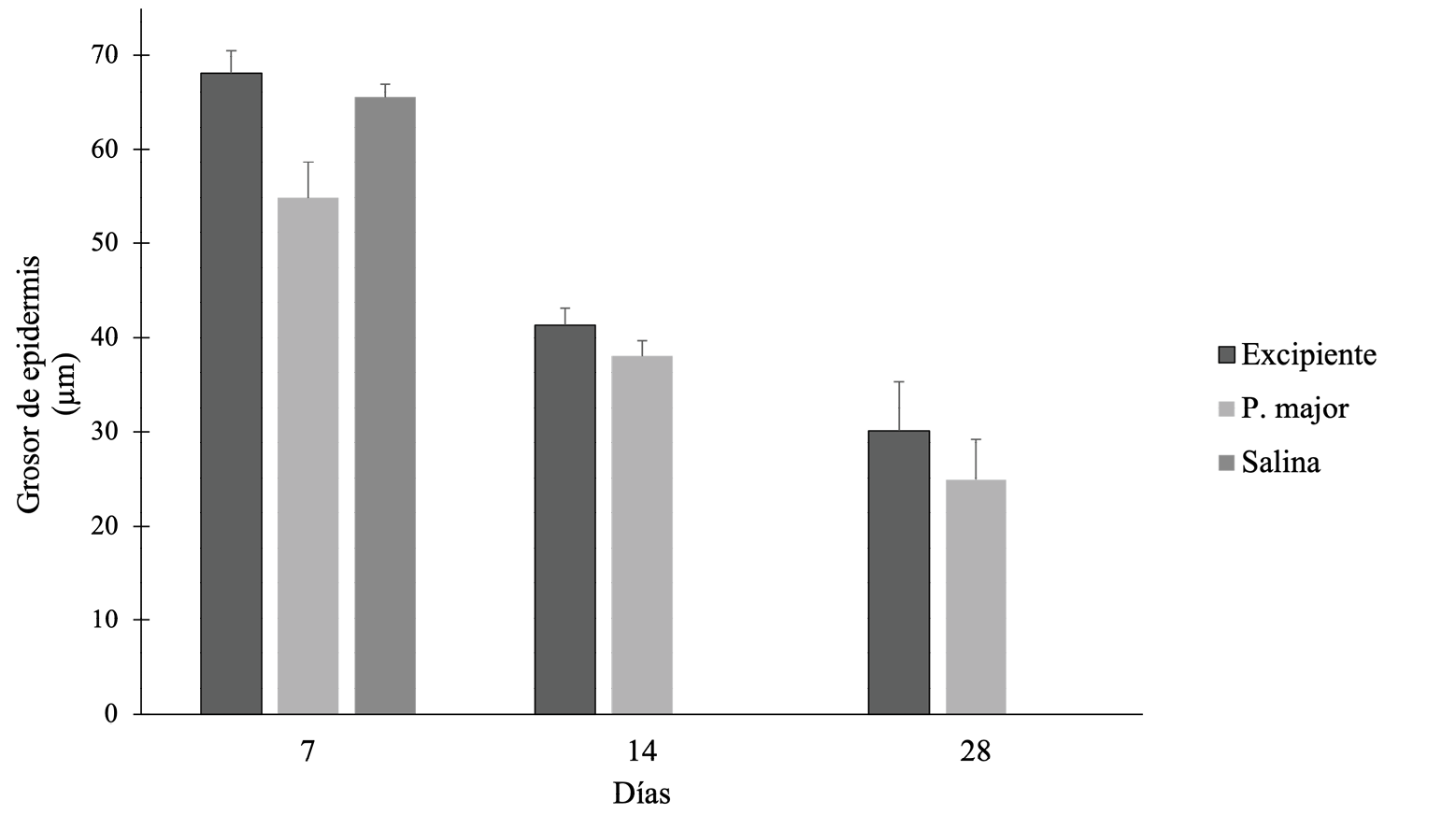
Figura 8. Grosor de la epidermis regenerada bajo los diferentes tratamientos
Se realizó un conteo de vasos sanguíneos presentes en el tejido formado bajo las condiciones de los diferentes tratamientos (figura 9). En este caso, se observa que para el día 7 es donde se contabiliza la mayor cantidad de vasos sanguíneos, lo cual es consecuente para la etapa de regeneración en la que se encuentra, sin embargo, no hay diferencia significativa entre ellos (ANOVA, ρ = 0,668). Al día 14 y 28, se observa que aquellos animales tratados con llantén si presentan mayor cantidad de vasos de manera significativa (T-student, ρ <0,05).
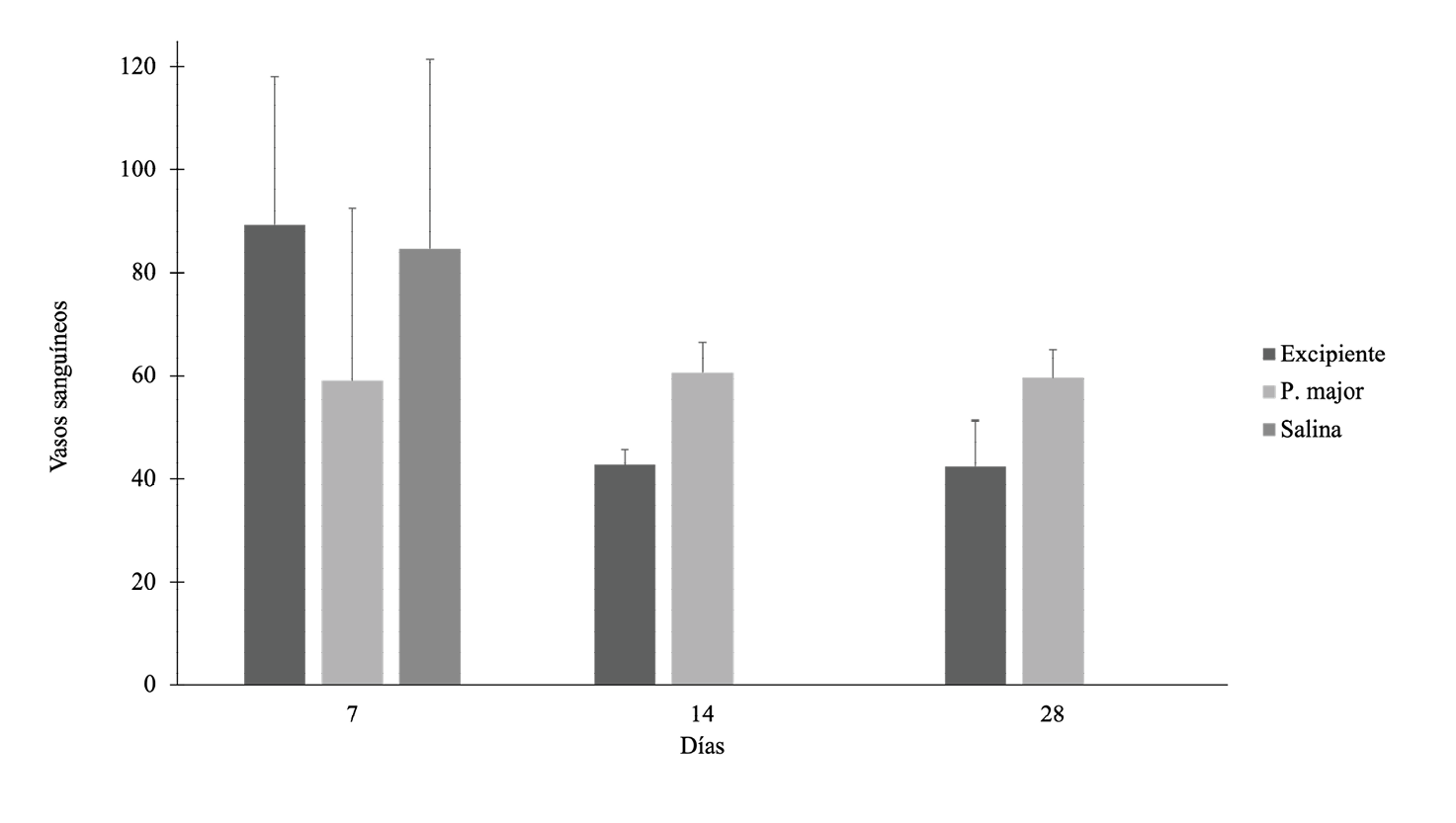
Figura 9. Cantidad de vasos sanguíneos presentes en el tejido regenerado.
Discusión
El uso de plantas medicinales es una práctica que se ha venido haciendo desde hace miles de años en las diferentes culturas. Sin embargo, no siempre se respalda con evidencia científica. Para esta investigación, el medio de cultivo M27.7 50S generó callos friables de llantén a partir de segmentos de hoja de vitroplanta. El momento óptimo de colecta de material celular para su liofilización y elaboración de extractos se encuentra entre la semana 6 y la 8. No se recomienda realizar más de un subcultivo de callos para esta especie, ya que no se logró evitar la oxidación de los mismos en medios con carbón activado, ni mediante el uso de soluciones antioxidantes, en subcultivos posteriores. Callos procedentes incluso de un mismo explante difieren en su morfología y características intrínsecas como color, friabilidad, dureza, tamaño, grado de diferenciación y producción de metabolitos, es entonces cuando las condiciones fisicoquímicas y nutricionales actúan sobre los cultivos callogénicos para orientar la expresión genética de las células a diversos grados de diferenciación, que proporciona a los cultivos características propias y únicas, aun cuando éstos provengan de una misma planta y todavía más, de un mismo explante [9]. Entre los reguladores de crecimiento más usados en cultivos de células vegetales están las auxinas y citocininas [9]. El tidiazurón o TDZ (citocinina), ha sido reportado en diversas publicaciones científicas relacionadas con el cultivo de tejidos vegetales para la inducción de callogénesis a través de la promoción de la proliferación celular [10]. El medio del cultivo M27.7 50S contiene una concentración baja del regulador de crecimiento TDZ (2,5 mg/l), lo evita la exposición prolongada a este compuesto, ya que se conoce que algunos reguladores de crecimiento sintéticos en plantas, puede tener efectos adversos como la variabilidad genética no deseada [11]. Esta investigación contempló el porcentaje de formación de callo, el color y la friabilidad, como parámetros de referencia de la idoneidad del proceso de inducción de callogénesis, siendo los valores óptimos de inducción un 100% de formación de callos amarillo-cremosos y friables [12].
Tal y como se mencionó al inicio, está reportado que extractos de hoja así como de raíz de P. major favorece la regeneración de heridas. Estudios in vitro han mostrado que esta planta favorece la migración y la proliferación de las células epiteliales y los fibroblastos de la dermis, aspecto clave durante el proceso regenerativo [1][13]. Consistente con lo observado en este estudio, Zubair y colaboradores en 2016, encontraron que una concentración de 0.1 mg/mL presentaba un efecto biológico importante, pero a una concentración de 10 mg/mL mostraba efectos negativos en la proliferación/migración, lo que es también presentado en los resultados. Por su parte, Velasco y colaboradores observaron este mismo efecto en otro tipo de células cuando eran expuestas a extractos hidroalcohólicos de Plantago major en dosis de 0,4 y 0,2 mg/mL. A pesar de estos hallazgos in vitro, hay que considerar que la regeneración de las heridas es un proceso dinámico que consiste en cuatro fases que se sobreponen: hemostasis, inflamación, proliferación y remodelación y que involucra la participación del sistema inmune, así como del circulatorio, por lo que es necesario analizar este mismo efecto en un organismo vivo [14]. De manera general, dentro de los componentes que se asocian a un efecto en la regeneración estan: polisacáridos, lípidos, derivados de ácido cafeico, flavonoides, glicósidos iridoides y terpenoides proveen actividad biomédica en diversos tejidos del organismo pero, el mecanismo preciso por el cual se da las propiedades aún no está del todo claro [1][14].
Tal y como se pudo ver en los resultados, el porcentaje de cierre es mayor para el grupo experimental durante la fase aguda de la regeneración (primeros 7 días). Esto puede deberse a que se ha identificado que en las hojas de P. major hay moléculas bioactivas que tienen actividad antiinflamatoria [15]. Dicha propiedad, acorde Adom et al. (2017) puede deberse a la presencia de glucósidos iridoides como la aucubina y los flavonoides como la baicaleína y la hispidulina [16]. Sin embargo, a partir del día 7 hasta el 28 se observa que la ventaja que tenía el porcentaje de cierre sobre los otros dos grupos ya no está presente. Esto pudo haberse debido a que solamente durante los primeros 7 días se aplicó el extracto y que era necesario aplicarlo durante todos los 28 días o bien era necesario incrementar la concentración del extracto. También, Ashkani et al, 2019 aplicaron extractos hidroalcholólicos al 5% en carboximetilcelulosa sobre una lesión inducida en ratas Sprague Dawley y probaron que estos extractos generaron un efecto antiinflamatorio e incrementaron el colágeno, vascularizacion y la proliferación de fibroblastos [5]. Por otro lado, en otros ensayos se han utilizado concentraciones considerablemente mayores de P. major, las cuales van en un rango de concentración desde un 20% como mínimo hasta un 50% como máximo donde se han obtenido diferencias significativas en comparación con los controles [17][18][19][20][21]. El conteo de PMN se realizó solo para las muestras colectadas el día 3 debido a que para ese momento es cuando se espera el infiltrado de PMN, en la fase de inflamación. La presencia de una menor cantidad de PMN/mm2 en las áreas analizadas sugiere que el tratamiento experimental tiene un efecto sobre el infiltrado inflamatorio. Nuevamente se hace una atribución a los compuestos con actividad antiinflamatoria que se ha reportado se encuentran presentes en las hojas de P. major como el posible motivo de un menor infiltrado inflamatorio [1][16]. Las medidas de la epidermis se realizaron a partir del día 7 debido a que para ese momento ya se puede evidenciar la presencia de esta capa. En todos los grupos fue posible observar la reepitelialización en día 7, lo que indica el inicio de la etapa proliferativa de la regeneración [22] Conforme avanza el tiempo, la epidermis se vuelve más delgada, lo cual es lo esperado ya que en la fase proliferativa el tejido se contrae de manera más pronunciada y la epidermis se reestructura de tal manera que pierde su grosor [23]. Para el día 7, puede notarse que el grosor de la epidermis de los animales tratados con el extracto de P. major es más delgada, lo que puede deberse al efecto de los compuestos bioactivos cuya acción deriva en una aceleración del proceso de regeneración y el incremento de la proliferación de los fibroblastos, actividad atribuida a los taninos [20]. Sin embargo, cuando se llega al día 14 no se observan diferencias en el grosor de la epidermis de los grupos en estudio. Lo anterior sugiere que probablemente, era necesario continuar la aplicación del gel/crema con el extracto durante más tiempo o bien, incrementar la concentración. La misma situación ocurre para el día 28, donde ya se encuentra el tejido en la etapa de maduración / remodelación [24] donde no se observan diferencias significativas entre los grupos en estudio. Por otro lado, el conteo de vasos sanguíneos se realizó a partir del día 7 debido a que como el tejido se encuentra en fase proliferativa es a partir de este momento que se da la angiogénesis, es decir, la formación de vasos sanguíneos [25]. En el día 14 y 28, parece la vascularización es significativamente superior en el grupo experimental. Sin embargo, es necesario buscar otro método de conteo para los futuros ensayos, donde se utilice un marcador específico para ser detectado por inmunohistoquímica y utilizar un sistema de conteo automatizado. A pesar de ello, parece indicar que hay posibilidad de que sus compuestos ayuden al proceso de angiogénesis en la regeneración tisular. De manera general, los efectos favorecedores en el proceso de regeneración de la piel al usar el extracto de P. major se observan principalmente en las primeras etapas del proceso, esto podría deberse a varias causas; primero, la concentración usada del extracto, de acuerdo a lo reportada en otros estudios, podría considerarse estudiar diferentes concentraciones, además de aplicar por más días el tratamiento tópico.
Conclusiones
Los efectos benéficos en el proceso de regeneración de la piel al usar el extracto de P. major se observan principalmente en las primeras etapas del proceso, y se sugiere continuar la aplicación del gel/crema con el extracto durante más tiempo o bien, incrementar la concentración.
Fue posible además observar que la vascularización es significativamente superior en el grupo experimental, indicando con ello que hay posibilidad de que los compuestos de llantén, ayuden al proceso de angiogénesis en la regeneración tisular.
Agradecimientos
A la empresa Laboratorios Lisan S.A y su personal, que a través de su sección de Investigación y Desarrollo de Procesos (I+D), contribuyó al desarrollo de este proyecto, con ejecución de actividades concretas para el alcance de los objetivos, así como mediante apoyo financiero.
A la Dra. Marietta Flores y Dr. Alberto Alape del Instituto Clodomiro Picado (UCR) por su colaboración en el estudio del efecto de la regeneración en piel del modelo murino
Referencias
[1] M. Zubair, H. Nybom, C. Lindhol, J. Brandner y K. Rumpunen, «Promotion of wound healing by Plantago major L. leaf extracts-ex-vivo experiments confirm experiences from traditional medicine.,» Natural products reseachs, vol. 30, nº 5, pp. 622-624, 2016.
[2] M. Alam, «The National Institute of Health and Family Welfare,» Zahid, 20 May 2016. [En línea]. Available: https://www.nhp.gov.in/introduction-and-importance-of-medicinal-plants-and-herbs_mtl. [Último acceso: 16 May 2021].
[3] B. Abd, H. Hasan y M. Murtadha, «Study of antibacteral activity of Plantago major and Ceratonia siliqua,» The Iraqi Postgraduate Medical Journal, vol. 11, nº 1, pp. 130-135, 2021.
[4] U. Harput, Y. Genc y I. Saracoglu, «Cytotixic and antioxidative activities of Plantago lagopus L. and characterization of its bioactive compounds,» Food and Chemical Toxicology, nº 50, pp. 1554-1559, 2012.
[5] F. Fons, D. Tousch, S. Rapior, A. Gueiffier, J. Roussel, A. Gargadennec y C. Andary, «Phenolic profiles of untrasformed and hairy root cultures of Plantago lanceolata, » Plant Physiology Biochemestry, vol. 37, nº 4, pp. 291-296, 1999.
[6] Z. Ru, L. Mao y J. Zheng, «Rehmannia glutinosa: Review of botany chemistry and pharmacology,». Journal of Ethnooharmacology, vol. 117, pp. 199-214, 2008.
[7] G. Garro y S. Alvarenga, «Un protocolo para el cultivo in vitro y la micropropagación masiva de llantén (Plantago major), » Tecnología en Marcha, vol. 22, nº. 3, pp. 25-33, 2009.
[8] T. Murashige, y F. Skoog, «A revised medium for rapid growth and bio assays with tobacco tissue cultures, » Physiologia plantarum, vol 15, nº3, pp. 473-497, 1962.
[9] G. Calva y J. Pérez, «Cultivo de células y tejidos vegetales: fuente de alimentos para el future, » Revista Digital Universitaria, vol. 6, nº11, pp. 1-16, 2005.
[10] T, Pérez, «Multiplicación in vitro de brotes de guayaba (Psidium guajava L.) var. Enana Roja Cubana EEA 18-40 obtenidos a partir de semillas, » Cultivos Tropicales, vol. 23, nº 3, pp. 57-61, 2013
[11] M. Danaee, R. Farzinebrahimi, M. Kadir, U. Sinniah, R. Mohamad y R. Taha, «Effects of MeJA and SA elicitation on secondary metabolic activity, antioxidant content and callogenesis in Phyllanthus pulcher,» Braz. J. Bot, DOI10.1007/s40415-015-0140-3, 2015.
[12] R. Chitra, K. Rajamani y E. Vadivel, «Regeneration of plantlets from leaf and internode explants of Phyllanthus amarus Schum. and Thonn, » African Journal of Biotechnology, vol. 8, nº 10, pp. 2209-2211, 2009.
[13] R. Velasco, R. Tapia, R. Roman, E. Vega y M. Perez, «Effect of Plantago major on cell proliferation in vitro,» J Ethonopharmacology, vol. 103, pp. 36-42, 2006.
[14] S. Ashkani, M. Khoshneviszadeh, A. Noorafshan, R. Miri, S. Rafiee, K. Hemyari, S. Kardeh, O. Koohi, D. Fani y E. Faridi, «The Healing Effect of Plantago Major and Aloe Vera Mixture in Excisional Full Thickness Skin Wounds: Stereological Study,» World J Plast Surg, vol. 8, nº 1, pp. 51-57, 2019.
[15] M. Zubair, H. Nybom, C. Lindholm y K. Pumpunen, «Major polyphenols in aerial organs of greater plantain (Plantago major L.) and effects of drying temperature on polyphenol contents in the leaves,» Scientia Horticuturae, vol. 128, pp. 523-529, 2011.
[16] M. Adom, M. Taher, D. Mutalabisin, M. Amri, M. Abdul, M. Wan, P. Sengupta y D. Susanti, «Chemical constituents and medical benefits of Plantago major.,» Biomedicine & Pharmacotherapy, vol. 96, pp. 348-360, 2017.
[17] M. Amini, M. Kherad, D. Mehrabani, N. Azarpira, M. Panjehshahin y N. Tanideh, «Effect of Plantago major on burn wound healing in rat.,» Journal of Applied Animal Research, vol. 37, nº 1, pp. 53-56, 2010.
[18] N. Moradi, F. Shafie, M. Moeni, S. Kashfi, M. Rashidipour, F. Chehelcheraghi, S. Ali y B. Rasoulian, «The Wound Healing Effect of Plantago major Leaf Extract in a Rat Model: An Experimental Confirmation of a Traditional Belief in Persian Medicine,» Herbal Medicines Journal, vol. 3, nº 1, pp. 26-30, 2018.
[19] K. Reyes, «Elaboración de una crema cicatrizante a base de romero (Rosmarinus oficinalis) y llantén (Plantago major).,» Tesis de grado para la obtención de título de Bioquímica Farmaceútica. Universidad Técnica de Machala., 2014.
[20] D. Rondo, «Eficacia de Plantago major “llantén” en cicatrización y calidad de cicatriz en quemadura comparado con alantoína en Rattus rattus.,» Tesis para obtener el título profesional de Médico Cirujano. Universidad César Vallejo., 2019.
[21] P. Yambay, «Elaboración y control de calidad de una crema a base de extractos hidroalcohólicos de berro (Nasturtium officinalis) y llantén (Plantago major) y comprobación de su actividad cicatrizante en heridas inducidas en ratones,» Tesis de grado para la obtención de título de Bioquímica Farmaceútica. Escuela Superior Politécnica de Chimborazo, 2013..
[22] E. Gantwerker y D. Hom, «Skin: Histology and Physiology of Wound Healing.,» Clinics in Plastic Surgery., vol. 39, nº 1, pp. 85-97, 2012.
[23] O. González, T. Costa , Z. Andrade y A. Medrado, «Wound healing - A literature review,» Anais Brasileiros de Dermatologia, vol. 91, nº 5, pp. 614-620, 2016.
[24] H. Wallace y P. Zito, «Wound Healing Phases., » NCBI Bookshelf, 2019.
[25] G. Schultz, G. Chin, L. Moldawer y R. Diegelmann, «Principles of wound healing. Mechanisms of Vascular Desease: A Reference Book for Vascular Specialists, » Adelaide: University of Adelaide Press, 2011.
1 Instituto Tecnológico de Costa Rica. Costa Rica, Escuela de Biología. Correo electrónico: scastro@itcr.ac.cr
https://orcid.org/0000-0003-0689-8336
2 Instituto Tecnológico de Costa Rica. Costa Rica. Correo electrónico:
daniporras400@gmail.com
https://orcid.org/0000-0002-2034-9926
3 Instituto Tecnológico de Costa Rica. Costa Rica, Escuela de Biología. Correo electrónico: kjimenez@itcr.ac.cr
https://orcid.org/0000-0002-0162-9279
4 Instituto Tecnológico de Costa Rica. Costa Rica, Escuela de Biología. Correo electrónico: ggarro@itcr.ac.cr
https://orcid.org/0000-0001-7578-1938