Evaluación de TiO2 sensibilizado con tintes de trímeros de cobalto como fotocatalizador para la producción de hidrógeno a partir de la separación de agua
Evaluation of TiO2 sensitized with cobalt trimer dyes as photocatalyst for water-splitting hydrogen production
Daniela Camacho-Ureña1, Leslie W. Pineda2, J. Esteban Durán-Herrera3
Fecha de recepción: 7 de marzo, 2023
Fecha de aprobación: 11 de junio, 2023
Camacho-Ureña, D; Pineda, L.W; Durán-Herrera, J.E. Evaluación de TiO2 sensibilizado con tintes de trímeros de cobalto como fotocatalizador para la producción de hidrógeno a partir de la separación de agua. Tecnología en Marcha. Vol. 37, No 1. Enero-Marzo, 2024. Pág. 17-26. https://doi.org/10.18845/tm.v37i1.6472
https://doi.org/10.18845/tm.v37i1.6472
Palabras clave
Hidrógeno; dióxido de titanio; trímeros de cobalto; fotocatálisis; separación del agua.
Resumen
En esta investigación se sintetizaron fotocatalizadores de TiO2 basados en la funcionalización de su superficie con moléculas orgánicas (glicina y ácido aminocaproico) y un trímero de cobalto en su forma molecular [Co3(dpa)4Cl2], (dpa=2,2’-dipiridilamina), utilizando dos métodos de calentamiento (reflujo y microondas) para realizar las respectivas reacciones de anclaje. Estos fotocatalizadores fueron evaluados en su capacidad de producción de hidrógeno a partir de la reacción de separación del agua, utilizando una lámpara de Hg de mediana presión (125 W) y metanol como agente de sacrificio. Además, para fines de comparación, también se sintetizaron y evaluaron fotocatalizadores de CuO-TiO2 y CoO-TiO2. El fotocatalizador que presentó el mejor rendimiento fue el catalizador de TiO2 sensibilizado con el trímero de cobalto con glicina como molécula de anclaje, preparado utilizando calentamiento por microondas, el cual generó hidrógeno a una tasa promedio de 1887 mmol g-1 h-1. Se observó que la longitud de la cadena de la molécula de anclaje tiene un efecto sobre la actividad fotocatalítica, conforme aumenta el largo de la cadena, la producción de hidrógeno disminuye. Además, que el método de calentamiento por microondas es el que produce catalizadores con mejores resultados en la generación de hidrógeno.
Keywords
Hydrogen; titanium dioxide; cobalt trimers; photocatalysis; water splitting.
Abstract
In this research, sensitized TiO2 photocatalysts were synthesized based on the functionalization of their surface with organic molecules (glycine and aminocaproic acid) and a cobalt trimer in its molecular form [Co3(dpa)4Cl2], (dpa = 2,2’-dipyridylamine), using two different heating methods (reflux and microwave) to carry out the anchoring reactions. The capacities of the photocatalysts for producing hydrogen from the water-splitting reaction were evaluated using a medium-pressure Hg lamp (125 W) and methanol as a sacrificial agent. Also, CuO-TiO2 and CoO-TiO2 photocatalysts were synthesized and evaluated for comparison purposes. The photocatalyst that presented the best performance was TiO2 sensitized with the cobalt trimer, using glycine as an anchoring molecule, and prepared with microwave heating; this photocatalyst generated hydrogen at an average rate of 1887 mmol g-1 h-1. It was observed that the chain length of the anchoring molecule affects the photocatalytic activity, as the chain length increases, the production of hydrogen decreases. Last, microwave heating produced the photocatalyst with the best performance on hydrogen generation.
Introducción
Durante muchos años, los combustibles fósiles como el carbón, el petróleo y el gas natural han sido la fuente principal de energía para la producción industrial, calefacción, transporte, entre otros. La inclusión de nuevas fuentes de energía renovables ha sido mínima, principalmente debido al alto costo e insuficiente desarrollo de estas tecnologías. Sin embargo, la concienciación de los efectos ambientales dañinos que genera la excesiva dependencia de los combustibles fósiles, la preocupación cada vez mayor por la disponibilidad de algunos de estos combustibles y la creciente demanda de energía a nivel mundial, han aumentado el interés en modificar y diversificar a fuentes de energía menos contaminantes [1].
El hidrógeno es considerado por muchos el combustible del futuro, el cual sería capaz de contribuir significativamente en el reemplazo de los combustibles fósiles, la disminución de las emisiones de dióxido de carbono a la atmósfera y con ello, el calentamiento global. No obstante, en la actualidad, aproximadamente el 96% del hidrógeno producido en el mundo se obtiene del proceso de reformado de gas natural con vapor de agua y de la gasificación de coque [2], procesos que dependen de combustibles fósiles y de igual forma producen gases de efecto invernadero. Por lo tanto, desarrollar procesos renovables para la producción de hidrógeno se convierte en uno de los principales desafíos tecnológicos en la actualidad, siendo el proceso de generación de hidrógeno a partir de la separación del agua mediante el uso de energía solar uno de los más estudiados [3].
De acuerdo con publicaciones realizadas en los últimos años, la fotocatálisis, con su potencial de utilizar la luz solar para generar hidrógeno, representa una de las tecnologías limpias y amigables con el medio ambiente más prometedoras para realizar este proceso [3]-[6]. La fotocatálisis utiliza materiales semiconductores que a diferencia de otras tecnologías renovables de producción de combustibles, posee la ventaja de operar a condiciones ambientales, sin requerimientos complejos de transformación [7].
La estructura electrónica de un semiconductor juega un papel clave en la fotocatálisis. A diferencia de un conductor, un semiconductor consiste de una banda de valencia (BV) y una banda de conducción (BC). La diferencia de energía entre estos dos niveles es conocida como banda prohibida. Sin excitación, los electrones se encuentran en la BV, pero cuando los semiconductores son excitados por fotones con energía igual o superior al nivel de energía de la banda prohibida, los electrones son trasladados de la BV a la BC dejando un hueco de carga positiva en la BV. Los electrones y huecos fotogenerados pueden recombinarse tanto en el seno como en la superficie del semiconductor en un tiempo muy corto, liberando energía en forma de calor o fotones; los electrones y huecos que migren hacia la superficie del semiconductor sin recombinarse, pueden inducir reacciones de reducción y oxidación, respectivamente. Para la producción de hidrógeno a partir de la separación del agua vía fotocatálisis, el nivel de la BC debe ser más negativo que el nivel de producción de hidrógeno mientras que el de la BV debe ser más positivo que el nivel de oxidación del agua [8].
El semiconductor más estudiado como fotocatalizador para este proceso ha sido el TiO2; sin embargo, este presenta la desventaja que requiere, debido al valor de su banda prohibida, luz ultravioleta para la excitación de sus electrones. Por esta razón, se han desarrollado técnicas de modificación de los fotocatalizadores para propiciar el mejoramiento de la producción de hidrógeno utilizando radiación solar, entre ellas, el dopaje y la sensibilización son ampliamente utilizadas, ya que estas favorecen tanto la separación de los pares electrón/hueco como la inyección de electrones a la partícula del TiO2 [9]-[10].
En esta investigación se sintetizaron fotocatalizadores de TiO2 basados en la funcionalización de su superficie con moléculas orgánicas (glicina y ácido aminocaproico) y un trímero de cobalto en su forma molecular [Co3(dpa)4Cl2], donde dpa = 2,2’-dipiridilamina, utilizando dos métodos de calentamiento (reflujo y microondas). Estos fotocatalizadores fueron evaluados en su capacidad de producción de hidrógeno a partir de la reacción de separación del agua utilizando una lámpara de Hg de mediana presión.
Materiales y métodos
Materiales
Todas las sustancias químicas utilizadas fueron de grado reactivo y el agua destilada. Se utilizó TiO2 en forma de anatasa nanoparticulado (Sigma-Aldrich) como fotocatalizador de base y como agente de sacrificio se usó metanol (Fisher Scientific).
Preparación de los fotocatalizadores
Se preparó TiO2-CuO como fotocatalizador de referencia para su comparación con los otros fotocatalizadores, ya que éste ha sido anteriormente investigado y sus resultados han sido reportados ampliamente en la literatura [11]-[14]. Este fotocatalizador se preparó por medio de una impregnación húmeda convencional seguida de calcinación, lo anterior según la metodología descrita por Xu et al. [11] y Yu et al. [12]. En breve, el TiO2 se trató térmicamente por 4 h a una temperatura de 500 °C, esto con el fin de aumentar la cristalinidad del compuesto y hacerlo más activo. Se agregó 1,0 g del TiO2 en 80 mL de agua destilada y 35 mL de una disolución acuosa de Cu(NO3)2 (0,05 M); se sonificó por 15 min y se dejó en agitación por 2 h. Seguidamente se filtró al vacío y se calcinó en aire a una temperatura de 350 °C por 4 h. Con este procedimiento la cantidad de cobre que se obtuvo en el fotocalizador fue de 1,3 % m/m (determinado mediante espectroscopia de absorción atómica con llama).
El resto de los fotocatalizadores sintetizados son TiO2 funcionalizado con moléculas orgánicas y trímeros de cobalto, los cuales se sintetizaron mediante un anclaje molecular de dos pasos: primero se ancla la molécula orgánica (glicina o ácido 6-aminocaproico) a la superficie del TiO2 y luego se adiciona el trímero de cobalto [Co3(dpa)4Cl2] a la molécula orgánica previamente anclada. En la figura 1 se muestran las estructuras químicas de cada uno de los dos fotocatalizadores de TiO2 sensibilizado sintetizados.
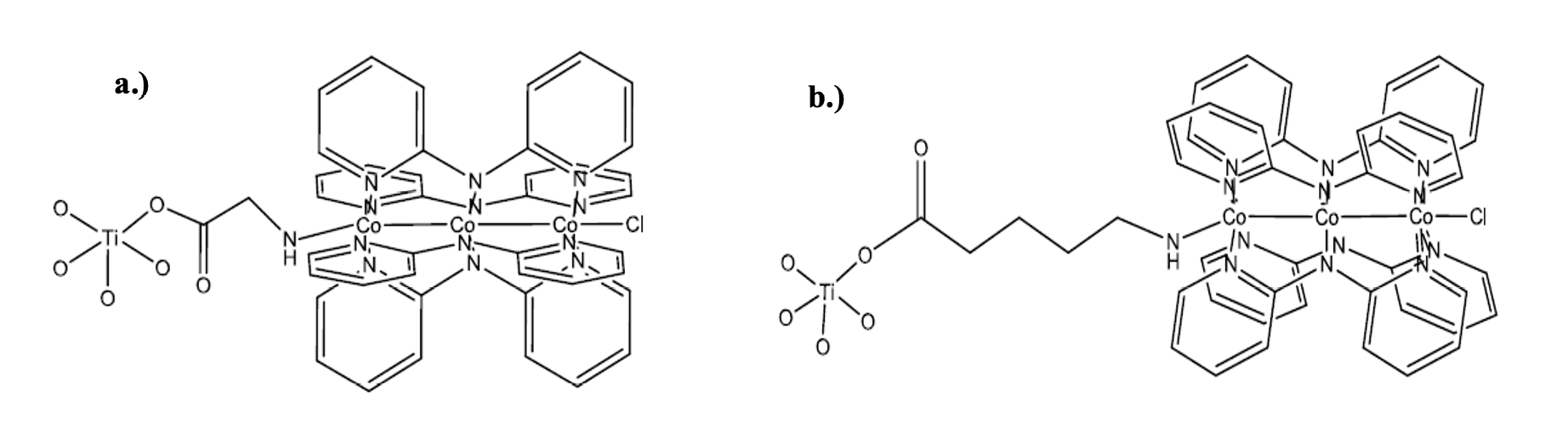
Figura 1. Estructuras químicas de TiO2 sensibilizado con trímero de cobalto usando como molécula de anclaje a.) glicina y b.) ácido 6-aminocaproico.
En primer lugar, se sintetizó el trímero de cobalto de acuerdo con la metodología descrita por Rivera [15], en la cual se parte de CoCl2 anhidro, 2,2’dipiridilamina y tetrahidrofurano (THF). Seguidamente se realizó la modificación del TiO2 con las moléculas de anclaje (glicina y ácido 6-aminocaproico) utilizando dos métodos de calentamiento diferentes, por reflujo y por microondas, para fines de comparación. Para ello se preparó una disolución del compuesto orgánico (5 mL, 10 % m/m) en metanol y se mezcló con el TiO2 (0,3 g). En el caso de calentamiento por reflujo se calentó por 18 h con agitación constante y para el caso del microondas, la reacción se realizó a 80 °C por un tiempo de 7 min con potencia del microondas de 150 W y agitación alta. Por último, se realizó la adición del trímero de cobalto para lo cual se preparó una disolución del trímero de cobalto en THF (0,5 g en 90 mL) y se le agregó el TiO2 modificado con las moléculas de anclaje (0,3 g). De igual forma, la suspensión se somete dos procesos de calentamiento diferentes, para el caso de reflujo, la suspensión se calentó por 18 h, mientras que con el microondas, la suspensión se hace reaccionar a las siguientes condiciones: 90 °C, 12 min, potencia 150 W y agitación alta.
También se preparó CoO-TiO2 para comparar su desempeño, para lo cual simplemente se calcina, a 300 °C, uno de los fotocatalizadores de TiO2 sensibilizado preparados. En el cuadro 1 se presenta el porcentaje de cobre medido por Rivera [15] para cada uno de los fotocatalizadores evaluados.
Cuadro 1. Porcentaje de Co medido en cada uno de los fotocatalizadores evaluados [15].
|
Muestra |
Porcentaje de Co (% m/m) |
|
TiO2 + glicina + trímero de Co (reflujo) |
1,190 |
|
TiO2 + glicina + trímero de Co (mw) |
0,104 |
|
TiO2 + ácido 6-aminocaproico + trímero de Co (reflujo) |
1,040 |
|
TiO2 + ácido 6-aminocaproico + trímero de Co (mw) |
0,027 |
|
TiO2- CoO |
3,078 |
Producción fotocatalítica de hidrógeno
La producción fotocatalítica de hidrógeno se llevó a cabo en un fotorreactor con pozo de inmersión de doble pared de cuarzo con una capacidad de 425 mL (SAIC, QW2 + B/400). Los experimentos se realizaron a temperatura ambiente y presión atmosférica y como medio de irradiación se utilizó una lámpara de Hg de mediana presión de 125 W (SAIC, MVL 3). Para mantener la temperatura constante dentro del reactor, se hizo circular agua del grifo por la chaqueta de enfriamiento. Los gases producidos durante la reacción eran recolectados y cuantificados en una bureta con sello de agua, la cual se mantenía a presión atmosférica.
En un experimento típico de fotocatálisis, 0,3 g del fotocatalizador se agregaron a 300 mL de una disolución de metanol/agua (10% v/v). Antes de empezar la irradiación, la suspensión del fotocatalizador se dispersó a través de un proceso ultrasónico por 10 min y después se burbujeó nitrógeno a través del reactor por 20 min para remover el oxígeno disuelto. Para mantener la suspensión homogénea durante la reacción, se utilizó agitación magnética en el fondo del reactor. Una vez iniciada la reacción, aproximadamente cada 30 min se tomó una muestra de 300 mL del gas producido y se analizó mediante cromatografía de gases. El método cromatográfico programado para llevar a cabo la determinación de los gases es el siguiente: columna Supelco Carboxen-1010 Plot (30 m x 0,53 mm I.D), detector TCD, horno a 100 °C por 4 min y luego se calienta hasta 230 °C a 15 °C/min, temperatura de inyección 200 °C, temperatura del detector 230 °C, gas de arrastre nitrógeno a 4,0 mL/min.
Resultados
Previo a iniciar la evaluación de los diferentes fotocatalizadores sintetizados, se realizaron pruebas de control para determinar los elementos necesarios para que la reacción de separación fotocatalítica del agua se produzca. En experimentos en los que se combinaron únicamente agua destilada y la fuente de radiación (sin catalizador) o agua destilada y el catalizador (sin la lámpara), no se presentó una producción cuantificable de hidrógeno u otro gas. En estas pruebas se demostró que era necesario combinar el agua destilada, el fotocatalizador, la fuente de radiación para poder producir hidrógeno.
Se realizaron algunas pruebas con el catalizador de TiO2 (anatasa) y CuO-TiO2, cuyos resultados se presentan en el cuadro 2. Se puede observar que al utilizar únicamente el TiO2, no se obtuvo generación de hidrógeno, mientras que al usar el CuO-TiO2 sí se produce la descomposición del agua en hidrógeno y oxígeno, lo que evidencia el efecto co-catalizador del CuO en la actividad fotocatalítica. Cuando el catalizador se somete a radiación, tanto el TiO2 como el CuO se activan al mismo tiempo, por lo que, durante el proceso fotocatalítico, los electrones fotogenerados se transfieren de la banda de conducción del TiO2 hacia las agrupaciones de CuO y se acumulan en sus bandas de conducción más bajas, mientras que los huecos se acumulan en la banda de valencia del TiO2 y CuO; como consecuencia, los electrones fotogenerados en las agrupaciones del CuO pueden efectivamente reducir el H+ para producir H2.
Cuadro 2. Producción promedio de hidrógeno obtenida con los catalizadores de TiO2 (anatasa) y CuO-TiO2.
|
Sistema |
Producción de hidrógeno (µmol h-1 gcat-1) |
|
TiO2 suspendido en agua destilada |
No cuantificable |
|
CuO-TiO2 suspendido en agua destilada |
46 |
|
CuO-TiO2 suspendido en solución de metanol al 10 % v/v |
155 |
De los resultados reportados en el cuadro 2 también se puede observar que al llevarse a cabo la reacción en presencia de metanol como agente de sacrificio, se obtuvo una producción 3,20 veces mayor de hidrógeno. En la separación del agua mediante fotocatálisis, la oxidación del agua por medio de los huecos es un proceso mucho más lento que la reducción por parte de los electrones; usualmente, los agentes de sacrificio son introducidos para facilitar el proceso de oxidación, especialmente para prevenir el proceso de recombinación de ambos, electrón y el hueco. Se han realizado varias investigaciones acerca del tipo de alcohol que mejor desempeño tiene como agente de sacrificio en la actividad fotocatalítica. De acuerdo con Sreethawong et al. [16], entre una serie de alcoholes estudiados, se encontró que el metanol era el más eficaz y más fuerte durante la producción de H2. Lo anterior se debe a que compuestos con polaridades más altas, como ácidos y cetonas, son incapaces de suprimir eficientemente la recombinación electrón-hueco, probablemente debido a que su configuración electrónica es más estable.
El cuadro 3 presenta los resultados de producción promedio de H2 obtenidos utilizando los fotocatalizadores de TiO2 sensibilizados con el trímero de cobalto y las dos moléculas orgánicas de anclaje, para cada método de calentamiento utilizado. Según estos resultados, se puede observar que el tamaño en la molécula orgánica de anclaje tiene un efecto sobre la producción de H2, conforme aumenta el largo de la cadena, la producción de H2 disminuye. Claramente puede verse que en el caso de la glicina se obtienen mejores resultados de producción de H2 que con el ácido 6–aminocaproico; por ejemplo, la generación aumentó 2,5 veces para el caso en el que se utilizó el método de calentamiento por microondas. Una de las posibles causas de este comportamiento es que el ácido 6-aminocaproico al ser una molécula más larga podría bloquear de forma parcial los sitios activos del TiO2, permitiendo un aumento en la opacidad y dispersión de la luz, dando lugar a una disminución del paso de irradiación a través de la solución en suspensión [12]. El objetivo de la sensibilización del TiO2 es que bajo iluminación con luz visible, el trímero se cobalto se excite y con esto inyecte electrones extra hacia la banda de conducción de TiO2. Por lo tanto, otra de las posibles razones por las cuales se observa diferencia en la generación de H2 entre las dos moléculas ancladas es que, al extenderse la cadena de átomos de carbono, es más difícil para estos electrones generados llegar a la partícula del TiO2.
Cuadro 3. Producción fotocatalítica promedio de H2 obtenidas con los fotocatalizadores de TiO2 sensibilizado en una disolución metanol/agua a una concentración de 10 % v/v.
|
Fotocatalizador |
Método de calentamiento |
|
|
Microondas (mmol h-1 g-1) |
Reflujo (mmol h-1 g-1) |
|
|
TiO2-Glicina-Trímero de Co |
1887 |
340 |
|
TiO2-Ácido 6-aminocaproico-Trímero de Co |
757 |
176 |
De la misma manera se observa que el método de calentamiento utilizado en el proceso de síntesis de los fotocatalizadores es una variable que afecta la generación de H2, siendo el calentamiento por microondas el que genera los catalizadores con mayor actividad. El método de calentamiento por reflujo es una técnica que utiliza un disolvente a ebullición, el cual proporciona altas temperaturas y en la que se desea mantener un volumen constante en la reacción. Este método de calentamiento tradicional se da por medio de conducción desde una fuente externa de calor (en este caso por una plantilla), por lo que el calor es conducido a la sustancia pasando primero a través de las paredes del recipiente para que llegue al disolvente y finalmente a los reactivos. Por el contrario, en la síntesis por microondas se produce un calentamiento molecular, es decir, la transferencia de energía se da directamente a las especies reactivas, por lo que fomenta transformaciones que no serían posibles con calentamiento convencional. Las microondas se acoplan directamente con las moléculas que están presentes en la mezcla de reacción, permitiendo una rápida elevación de la temperatura. Los resultados del análisis termogravimétrico de estos fotocatalizadores realizados por Rivera [15] muestran que se alcanza una mayor eficiencia en el proceso de funcionalización de la glicina y del ácido aminocaproico a través del calentamiento por microondas.
De igual forma, si se comparan los porcentajes de cobalto que se muestran en el cuadro 1, se observa que la cantidad de cobalto para las muestras sintetizadas mediante el calentamiento por reflujo es mayor. Lo anterior se refleja en la coloración intensa de los fotocatalizadores sintetizados por medio de este calentamiento. De acuerdo con los resultados obtenidos, el contenido de cobalto en la muestra afecta la producción de H2 y conforme aumenta este porcentaje, disminuye la actividad fotocatalítica. Este comportamiento concuerda con los resultados obtenidos por Xiao et al. [17], en donde reportan que la presencia de Co3O4 incrementa la actividad fotocatalítica. Sin embargo, el contenido de cobalto en las muestras analizadas disminuye la actividad, en el siguiente orden: 0,2% > 0,4% > 0,6% > 0% > 0,8% > 1%, obteniendo un mejor desempeño la muestra que contenía 0,2 wt% de Co3O4. Han et al. [18] reportaron un resultado similar con el siguiente orden de concentraciones de Co3O4 con g-C3N4: 0,2% > 0,5% > 0,8% > 1.0% > 0,1% > 0% > 1,5% > 2,0%, comentando que la actividad fotocatalítica decrece al incrementar la concentración.
El fotocatalizador de TiO2-CoO se probó con la intensión de comparar el desempeño del cobalto como co-catalizador en forma de óxido o en el trímero. En la figura 2 se observa la evolución de H2 obtenida con el TiO2-CoO y el TiO2-glicina-trímero de cobalto preparado con microondas. Para el caso del fotocatalizador TiO2-CoO se alcanzó una producción de hidrógeno de 6148 μmol g-1 en un tiempo aproximado de 6 h, mientras que con el trímero fue de 11 170 μmol g-1. Además, se puede observar que para el TiO2-CoO la producción fue baja en las primeras 4 h y luego aumentó, mientras que para el trímero de cobalto la producción fue bastante constante en el tiempo.
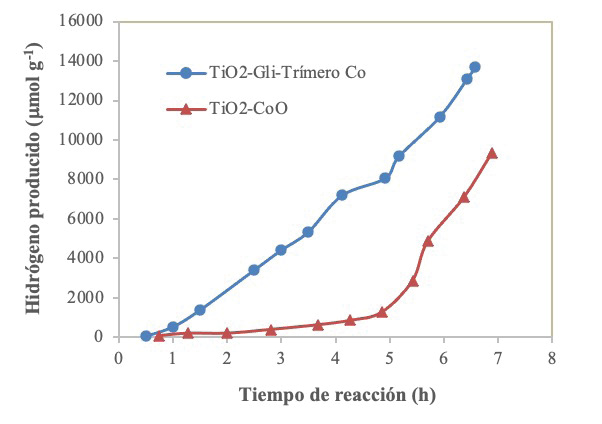
Figura 2. Evolución de H2 obtenida con TiO2-CoO y TiO2-glicina-trímero de cobalto preparado con microondas en una disolución metanol/agua a una concentración de 10% v/v.
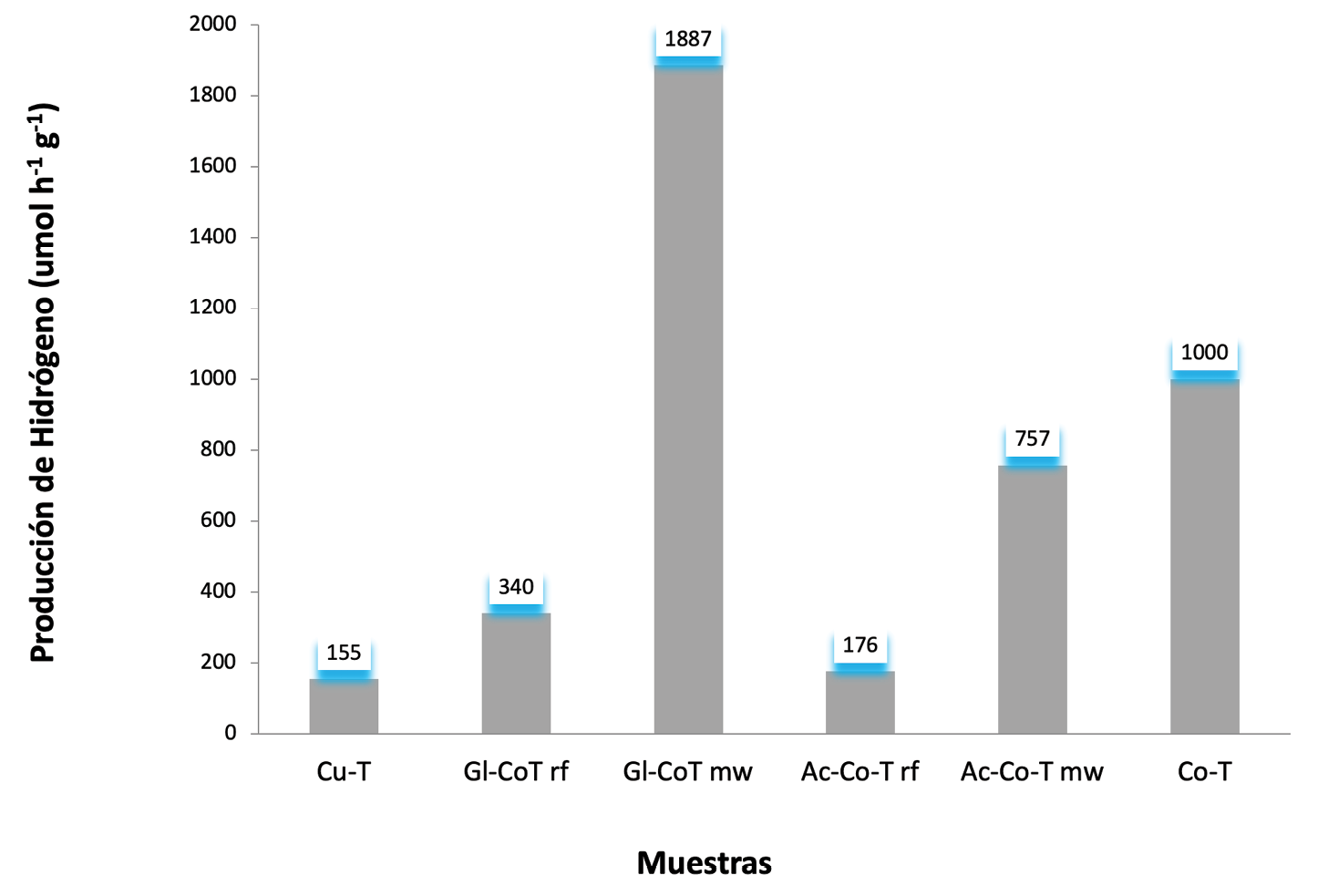
Figura 3. Comparación entre la actividad fotocatalítica del CuO-TiO2, TiO2-Glicina-Trímero de Co por reflujo, TiO2-Glicina-Trímero de Co por microondas, TiO2-Ácido 6-aminocaproico-Trímero de Co por reflujo, TiO2-Ácido 6-aminocaproico-Trímero de Co por microondas y CoO-TiO2, suspendidos en una disolución de metanol/agua al 10% v/v.
Como se puede observar en la figura 3, de manera global, el fotocatalizador con el mejor desempeño para la producción de hidrógeno fue el trímero de cobalto con la glicina funcionalizada a la superficie del dióxido de titanio utilizando el microondas como método de calentamiento durante la síntesis. Por otro lado, el CuO anclado al dióxido de titanio es la muestra que presenta el rendimiento más bajo. Tanto el CuO como el trímero de cobalto son poliatómicos; sin embargo, la primera diferencia que se observa es con respecto a las nuclearidades de ambos compuestos. Por un lado, el CuO-TiO2 tiene un solo átomo de cobre mientras que el trímero está formado por tres átomos de cobalto. El cobre no tiene acceso a los estados de oxidación que presenta cada átomo el cobalto, por lo tanto, su facilidad para la transferencia de electrones no se ve favorecida. De ahí que la presencia del óxido de cobalto (II) como co-catalizador incrementa la producción de H2 en comparación con el óxido de cobre (II). Además, el trímero de Co se ha anclado a la superficie del TiO2 de manera lineal (Co-Co-Co) y en su forma molecular. Mientras más átomos de cobalto estén anclados a la partícula de TiO2, la capacidad de captar fotones es mucho más intensa, lo cual genera un gradiente electrónico. Esto permite canalizar la luz e inyectar los electrones a la banda de conducción de la partícula del TiO2 produciendo una actividad favorable en la producción de H2 ya que se crea una forma más controlada, desde el punto de vista molecular, de modular esta transferencia de electrones.
Conclusiones
•El catalizador con mejor desempeño para la producción de H2 mediante fotocatálisis fue el trímero de cobalto con la glicina funcionalizada a la superficie del dióxido de titanio utilizando el microondas como método de calentamiento, obteniéndose una generación promedio de 1887 mmol g-1 h-1.
•Se logró comprobar que la presencia del trímero de cobalto en el fotocatalizador incrementa considerablemente la actividad fotocatalítica en la producción de hidrógeno.
•Se determinó que la longitud de la cadena de la molécula de anclaje tiene un efecto sobre la actividad fotocatalítica, conforme aumenta el largo de la cadena de esta cadena, la producción de H2 disminuye.
•Se observó que el método de calentamiento por microondas es el que produce catalizadores con mejores resultados en la generación de H2.
•El contenido de cobalto en la muestra afecta la producción de hidrógeno, conforme este porcentaje aumenta, disminuye la actividad fotocatalítica.
Agradecimientos
Los autores agradecen el apoyo del Centro de Investigación en Electroquímica y Energía Química (CELEQ) y de la Escuela de Ingeniería Química de la Universidad de Costa Rica.
Referencias
[1] A. Ochs, A. Dolezal, A. Majano, R. Palencia. (2013). The way forward for renewable energy in Central America, Worldwatch Institute. [En línea] Disponible en: https://cdkn.org/wp-content/uploads/2013/04/The-Way-Forward-for-Renewable-Energy-in-Central-America_english_FINAL.pdf
[2] World Energy Council. (2019). New Hydrogen Economy: Hope or Hype?, World Energy Council. [En línea] Disponible en: https://www.worldenergy.org/assets/downloads/WEInsights-Brief-New-Hydrogen-economy-Hype-or-Hope-ExecSum.pdf.
[3] S. Dutta. “Review on Solar Hydrogen: Its Prospects and Limitations”, Energy & Fuels, 35, pp. 11613–11639, 2021. https://doi.org/10.1021/acs.energyfuels.1c00823
[4] S. Z. Baykara. “Hydrogen: A brief overview on its sources, production and environmental impact”, International Journal of Hydrogen Energy, 43, pp. 10605–10614, 2018. https://doi.org/10.1016/j.ijhydene.2018.02.022
[5] A. A. Ismail, D. W. Bahnemann, “Photochemical splitting of water for hydrogen production by photocatalysis: A review”, Solar Energy Materials and Solar Cells, 128, pp. 85-101, 2014. https://doi.org/10.1016/j.solmat.2014.04.037
[6] L. Sun, L. Han, J. Huang, X. Luo, X. Li, “Single-atom catalysts for photocatalytic hydrogen evolution: A review”, International Journal of Hydrogen Energy, 47, 40, pp. 17583-17599, 2022. https://doi.org/10.1016/j.ijhydene.2022.03.259
[7] R. Ameta, M. S. Solanki, S. Benjamin, S. C. Ameta, “Photocatalysis” in Advanced Oxidation Processes for Waste Water Treatment, Academic Press, 2018, ch. 6, pp. 135–175. https://doi.org/10.1016/b978-0-12-810499-6.00006-1
[8] T. Hisatomi, J. Kubota, K. Domen, “Recent advances in semiconductors for photocatalytic and photoelectrochemical water splitting”, Chem. Soc. Rev., 43, pp. 7520–7535, 2014. https://doi.org/10.1039/c3cs60378d
[9] M. Nasirian, Y. P. Lin, C. F. Bustillo-Lecompte, M. Mehrvar, “Enhancement of photocatalytic activity of titanium dioxide using non-metal doping methods under visible light: a review”, International Journal of Environmental Science and Technology, 15, pp. 2009–2032, 2017. https://doi.org/10.1007/s13762-017-1618-2
[10] M. Ismael, “Latest progress on the key operating parameters affecting the photocatalytic activity of TiO2-based photocatalysts for hydrogen fuel production: A comprehensive review”, Fuel, 303, pp. 121207, 2021. https://doi.org/10.1016/j.fuel.2021.121207
[11] S. Xu, D. D. Sun. “Significant improvement of photocatalytic hydrogen generation rate over TiO2 with deposited CuO”, International Journal of Hydrogen Energy, 34, pp. 6096–6104, 2009. https://doi.org/10.1016/j.ijhydene.2009.05.119
[12] J. Yu, Y. Hai, M. Jaroniec, “Photocatalytic hydrogen production over CuO-modified titania”, Journal of Colloid and Interface Science, 357, pp. 223–228, 2011. https://doi.org/10.1016/j.jcis.2011.01.101
[13] Y. Liu, Z. Wang, W. Huang, “Influences of TiO2 phase structures on the structures and photocatalytic hydrogen production of CuOx/TiO2 photocatalysts”, Applied Surface Science, 389, pp. 760-767, 2016. https://doi.org/10.1016/j.apsusc.2016.07.173
[14] Y. Liu, Z. Ye, D. Li, M. Wang, Y. Zhang, W. Huang, “Tuning CuOx-TiO2 interaction and photocatalytic hydrogen production of CuOx/TiO2 photocatalysts via TiO2 morphology engineering”, Applied Surface Science, 473, pp. 500–510, 2019. https://doi.org/10.1016/j.apsusc.2018.12.177
[15] C. Rivera, “Funcionalización de dióxido de titanio nanoparticulado con diferentes moléculas orgánicas bifuncionales y trímeros de compuestos de transición para la obtención de nuevos materiales”, Tesis de Maestría, Escuela de Química, Univ. de Costa Rica, San José, Costa Rica, 2012.
[16] T. Sreethawong, T. Puangpetch, T. Chavadej, T. Yoshikawa, “Quantifying influence of operational parameters on photocatalytic H2 evolution over Pt-loaded nanocrystalline mesoporous TiO2 prepared by single-step sol–gel process with surfactant template”, Journal of Power Sources, 165, pp. 861–869, 2007. https://doi.org/10.1016/j.jpowsour.2006.12.050
[17] Q. Xiao, J. Zhang, C. Xiao, X. Tan, “Photocatalytic degradation of methylene blue over Co3O4/Bi2WO6 composite under visible light irradiation”, Catalysis Communications, 9, 6, pp. 1247-1253, 2008. https://doi.org/10.1016/j.catcom.2007.11.011
[18] C. Han, L. Ge, C. Chen, Y. Li, X. Xiao, Y. Zhang, L. Guo, “Novel visible light induced Co3O4-g-C3N4 heterojunction photocatalysts for efficient degradation of methyl orange”, Applied Catalysis B: Environmental, 147, pp. 546–553, 2014. https://doi.org/10.1016/j.apcatb.2013.09.038
1 Escuela de Ingeniería Química, Centro de Investigación en Electroquímica y Energía Química (CELEQ),Universidad de Costa Rica. Costa Rica. Correo electrónico: danitis71@gmail.com
https://orcid.org/0000-0002-4632-4137
2 Escuela de Química, Centro de Investigación en Electroquímica y Energía Química (CELEQ), Universidad de Costa Rica. Costa Rica.
Correo electrónico: leslie.pineda@ucr.ac.cr
https://orcid.org/0000-0003-3778-6185
3 Escuela de Ingeniería Química, Centro de Investigación en Electroquímica y Energía Química (CELEQ), Universidad de Costa Rica. Costa Rica. Correo electrónico: esteban.duranherrera@ucr.ac.cr
https://orcid.org/0000-0001-7382-0454