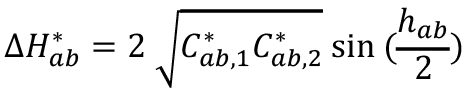Gestión cromática en la evaluación de lesiones melanocíticas
Chromatic management in the evaluation of melanocytic lesions
Mac-Arturo Murillo-Fernández1, Luis-Alexander Calvo-Valverde2, Ernesto Montero-Zeledón3, José-Esteban Pérez-Hidalgo4, Dionisio-Alberto Gutiérrez-Fallas5, Daniel Gutiérrez-Araya6
Fecha de recepción: 4 de octubre, 2022
Fecha de aprobación:13 de febrero, 2023
Murillo-Fernández, M.A; Calvo-Valverde, L.A; Montero-Zeledón, E; Pérez-Hidalgo, J.E; Gutiérrez-Fallas, D.A; Gutiérrez-Araya, D. Gestión cromática en la evaluación de lesiones melanocíticas. Tecnología en Marcha. Vol. 36, No 4. Octubre-Diciembre, 2023. Pág. 107-123. https://doi.org/10.18845/tm.v36i4.6415
https://doi.org/10.18845/tm.v36i4.6415
Palabras clave
Melanoma; gestión del color; CIELAB; lesiones melanocíticas.
Resumen
Uno de los criterios más extendidos en la valoración de imágenes de lesiones melanocíticas pigmentadas es el método ABCDE, en el cual el color (C) es uno de los componentes más relevantes. Sin embargo, la mayor parte de su valoración es subjetiva, raramente toma en cuenta los múltiples factores que pueden afectar la captura, procesamiento u observación de las imágenes, así como las limitaciones y diferencias perceptivas humanas. Esta particularidad puede afectar la detección temprana, el diagnóstico y tratamiento de este tipo de lesiones cutáneas. Con el desarrollo de la Tele- dermatología diagnóstica y los cada vez más sofisticados algoritmos de IA, se hace necesario contar con procedimientos objetivos que optimicen y fidelicen el procesamiento de imágenes y que apoyen a los profesionales de salud con el propósito de incidir positivamente en los índices crecientes de melanomas. El propósito de este artículo es proporcionar una metodología de valoración cromática, sustentada en el sistema CIEL*a*b* y en mejores prácticas de gestión cromática de imágenes, proporcionando a un grupo de profesionales en la salud, que no necesariamente está familiarizado a utilizar el color como herramienta objetiva de diagnóstico.
Keywords
Melanoma; color-management; CIELAB; melanocytic-lesions.
Abstract
One of the most widespread criteria in the assessment of images of pigmented melanocytic lesions is the ABCDE method, in which color (C) is one of the relevant issues. However, most of its assessment is subjective, rarely considering the multiple factors that may affect image capture, processing, or observation, as well as human limitations and perceptual differences. This particularity can affect the early detection, diagnosis, and treatment of this type of skin lesions. With the development of diagnostic tele-dermatology and increasingly sophisticated AI algorithms, there is a need for objective procedures that optimize image processing so, it supports health professionals and effectively impact the increasing rates of melanomas. The purpose of this study is to provide a chromatic assessment methodology based on the CIEL*a*b* system and, better practices in image chromatic management, simplifying the procedures to a group of healthcare professionals who are not necessarily familiar with using color as an objective diagnostic tool.
Introducción
El cáncer de piel es un tipo frecuente de cáncer de origen multifactorial. Estadísticas recientes, muestran que en Costa Rica su incidencia ha sido de alrededor de un 23 % en la última década, dónde aproximadamente, uno de cada cuatro casos de cáncer diagnosticados corresponde a cáncer de piel [1]. Según el Registro Nacional de Tumores, del Ministerio de Salud en Costa Rica7, por ejemplo, en el año 2014, de 4850 casos, 1399 correspondían a casos en piel, principalmente por la exposición prolongada a los rayos UV (del sol y las cámaras de bronceado) y por las mutaciones genéticas, entre otros factores de riesgo [2].
Las lesiones melanocíticas pigmentadas, comúnmente denominadas melanomas, son uno de los principales y más peligrosos cánceres de piel. Se originan en los melanocitos, las células dendríticas oriundas de la cresta neural8, que se encuentran en la capa de células basales en la parte más profunda de la epidermis, encargadas de producir la melanina (pigmento clave en la protección solar de la piel).
La detección temprana, un diagnóstico acertado y unas adecuadas estrategias de prevención de este tipo de lesiones, son los principales factores que permiten mantener la tasa de mortalidad en números relativamente bajos con respecto a otros tipos de cánceres [3]. A pesar de ello, la alta incidencia mundial de melanomas, la rapidez con que evolucionan y el descuido de los pacientes, han sido elementos de preocupación creciente entre los especialistas. Actualmente, se buscan métodos más eficientes de valoración, diagnóstico y tratamiento, incluso en estadios más tempranos, cuando la persona detecta por primera vez alteraciones sospechosas en su piel.
En años recientes, con el auge de la telemedicina [4], equipos de valoración y diagnóstico de lesiones melanocíticas, están incorporando dermatoscopios con aplicaciones (AP’s) [5] de Inteligencia Artificial (IA) [6] que facilitan el diagnóstico temprano de este tipo de lesiones.
Las lesiones melanocíticas pigmentadas se pueden confundir con otro tipo de lesiones cutáneas, e incluso entre melanomas de distinto tipo [7], lo que puede llevar a diagnósticos errados, sub- o sobrestimar su malignidad y llevar a tratamientos inapropiados o tardíos.
La valoración objetiva de las lesiones cutáneas, en especial las lesiones melanocíticas pigmentadas han sido objeto de muchos estudios científicos por décadas, sin embargo, no es hasta el año 2000, en un encuentro de especialistas9 y un congreso del 2006 [8] que comenzaron a unificarse los múltiples criterios de evaluación y diagnóstico.
A partir de este congreso, el método ABCDE, fue catalogado como un método objetivo expedito de diagnóstico óptico-visual [9]. El método ABCDE alude a las características de A= Asimetría; B= Borde; C= Color; D= Diámetro y E= Evolución del melanoma. De todas ellas, quizás el color es de las peculiaridades objetivas en las cuales hay mayor nivel de sofisticación, y menor conocimiento entre los dermatólogos, pues la determinación de las características cromáticas de un melanoma implica cierto grado de conocimiento de los fundamentos teóricos y la aplicación práctica del color.
El análisis cromático de imágenes tomadas a través de dermatoscopios profesionales, cámaras fotográficas o teléfonos inteligentes, e incluso en imágenes disponibles en los grandes data sets y diccionarios de imágenes, carecen de datos relacionados a su captura y procesamiento, que limitan su valoración objetiva. Son múltiples los factores que pueden distorsionar los colores que se observan después de una captura o extracción de una base de datos, entre ellas el tipo de iluminante, la contaminación cromática circundante, la geometría de la captura de la imagen o las características y las condiciones del equipo de captura de la imagen, entre otros factores. entonces no es de extrañar que la valoración sigue siendo en gran medida subjetiva, sujeta a errores interpretativos.
El presente artículo se propone, exponer los fundamentos teóricos del color, y un método objetivo y eficaz de gestión del color en la valoración de lesiones melanocíticas.
Valoración cromática de lesiones cutáneas pigmentadas
El sistema neuro-senso-visual de captura y procesamiento de la información cromática del ser humano es un mecanismo altamente sofisticado, cuyo funcionamiento y grado de sensibilidad están influenciados por múltiples factores que raramente coinciden exactamente con otro ser humano [10]. De hecho, en la práctica, no hay dos personas que “perciban” los colores de la misma forma. Algunos factores internos que afectan la forma en que las personas perciben el color tienen que ver con la nutrición, el estado anímico psicológico o mental [11], la salud, la genética, la fatiga visual, la memoria cromática, la edad o los estados alterados por efectos traumáticos, por consumo de sustancias psicotrópicas e ingesta de ciertos medicamentos o alimentos; sin contar las características y estado de la red neuronal de cada individuo [12]. Otros factores externos, que afectan severamente la capacidad de las personas de percibir los colores, tienen que ver con el grado de intensidad, orientación y tipo de iluminación circundante, los efectos de fondo o contraste, el tipo de materiales, el tiempo, la forma de la observación y múltiples factores ambientales [13].
Adicionalmente, un dispositivo de captura de imágenes como un dermatoscopio o una cámara digital, tienen la particularidad que sus fuentes de luz (iluminantes) son de muy diversos tipos y calidad, la mayoría no reúnen requisitos de estandarización u homologación. Cuando se observan las data-sets de fotografías dermatológicas, en su gran mayoría omiten referencias a los equipos o la forma en que fueron capturadas las imágenes. Si finalmente se integran en el proceso a los monitores donde se evalúan las imágenes, raramente se encuentran monitores calibrados o se tiene el control de los efectos circundantes que también afectan su apreciación visual.
Toda esta gama de factores subjetivos de quien valora una lesión cutánea pigmentada hace que sea necesario establecer métodos objetivos de captura, procesamiento y valoración de imágenes, que permitan una comunicación de la información cromática adecuada. Esto es lo que se conoce comúnmente como un Sistema de Gestión del Color (SGC). Una de las principales fuentes de solución proviene de la estandarización del observador, y las convenciones establecidas por la Comisión Internacional sobre la Iluminación (CIE: Comission Internationale de l´Eclairage), que desde 1931 viene desarrollando todo un conjunto de normas, estándares y conceptos para lograrlo. También, es importante reconocer los esfuerzos de la industria, como por ejemplo en la de reproducción gráfica, que lleva muchos años lidiando con este tipo circunstancias.
La percepción visual cromática primaria ocurre en la retina, donde tres tipos de fotorreceptores son estimulados por la “luz” en distintos rangos del espectro [14], a partir de la cual se formula la teoría triestímulo del color, de donde surgieron los estándares RGB (R: Red; G: Green; B: Blue); de ahí que se formulara la convención del “Observador Estándar”, que reúne un conjunto de datos de observaciones que identifican a un observador promedio. A partir de los datos de los tres distintos fotorreceptores se estableció el espacio de color CIE-1931, con 2° de observación y más tarde, en 1964 con 10° de observación (esto es la amplitud del ángulo de observación). Con los datos recopilados de iluminantes estándar y otros datos radiométricos, se desarrolló la fórmula triestimulante (XYZ) del color, base para la construcción de los denominados espacios de color, un concepto fundamental para la comprensión espacial de las características del color. En 1976 se introdujeron los espacios de color uniforme CIE-L*a*b*, y CIE-L*u*v*, los más aceptados para la valoración cromática actual, de tal manera que entre los distintos espacios de Color (sRGB; rgb; XYZ; xyz; L*a*b*; etc.) se pueden hallar conversiones matemáticas precisas para las igualaciones cromáticas respectivas [15].
El espacio CIE-L*a*b*, debido a su adaptación intuitiva con la percepción visual, ha sido el de mayor difusión, de ahí que la propuesta desarrollada en este artículo se fundamenta en este sistema. La coordenada de la Claridad (L* del inglés Luminosity) establece la dimensión del eje Blanco-negro (escala entre 0 y 100), donde todos los valores de gris se hallan ubicados. Mientras que las coordenadas a+-a- establecen el eje Rojo-Verde, y las coordenadas b+-b-, el eje amarillo azul. Cada color específico (por ejemplo, en una lesión melanocítica pigmentada) podrá ser ubicado en el espacio de color CIE-L*a*b*. De estas coordenadas del espacio de Color CIE-L*a*b* se derivan los atributos cromáticos característicos a saber: Valor o Claridad (L*), Tono o Saturación [h*= 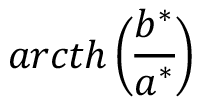 ] y el Matiz o Croma (pureza o intensidad del color) (
] y el Matiz o Croma (pureza o intensidad del color) (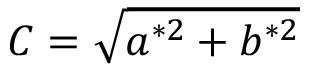 ). En la actualidad, la mayor parte de los estándares definidos por la CIE, han sido establecidos como normas por la Organización Internacional para la Estandarización (ISO: International Organization for Standardization)10, y cada día es más frecuente su aplicación en la segmentación de lesiones melanocíticas [16].
). En la actualidad, la mayor parte de los estándares definidos por la CIE, han sido establecidos como normas por la Organización Internacional para la Estandarización (ISO: International Organization for Standardization)10, y cada día es más frecuente su aplicación en la segmentación de lesiones melanocíticas [16].
Lo anterior implica que, al caracterizar el color de una lesión melanocítica pigmentada (o cualquier otra lesión cutánea), cada punto o pixel de la imagen puede ser claramente identificado por sus coordenadas cromáticas (RGB, XYZ o L*a*b*), y de ahí que se puedan (a) establecer áreas de color uniforme, donde los valores cromáticos se mantienen más o menos en un mismo rango; (b) determinar diferencias entre las distintas partes de la lesión; (c) distinguir “bordes” o “límites” entre las intersecciones de las distintas partes de la lesión, e inclusive con las partes de la piel sana; (d) identificar, mediante un seguimiento a las lesiones, cambios cromáticos en el tiempo [E: evolución en la clasificación ABCDE], que pueden coincidir con los cambios morfológicos de la lesión que a su vez pueden ser un indicativo del incremento dimensional e intensificación de la malignidad; (e) identificar dentro de una misma lesión, áreas sospechosas que puedan señalar distintos estadios, extensión, o profundidad del melanoma y (f) establecer comparaciones con imágenes de una base de datos11.
Para identificar áreas de color uniforme, es necesario establecer un mínimo de variabilidad entre las distintas áreas cromáticas. Para ello es necesario recurrir a la Desviación Estándar entre los distintos puntos de medición aplicados a la fórmula triestimulante, mediante una única medida estadística conocida como el MCDM (MCDM: Mean Color Differences from the Mean), así que para cada imagen se obtendrá un único valor MCDM, como medida de variabilidad entre los puntos de una misma área (Ecuación 1).
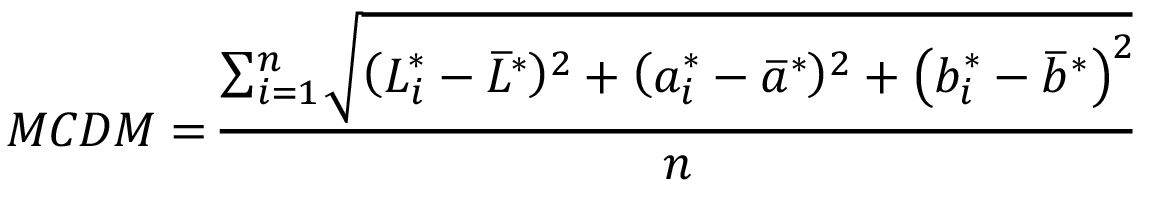 (1)
(1)
Donde: L*: Claridad; a*: Coordenadas cromáticas en el eje rojo-verde; b*: Coordenadas cromáticas en el eje azul-Amarillo; n: Número de muestras.
La medida del MCDM permite establecer no solo distinciones entre áreas de color uniformes, sino que se constituye en una medida práctica de evaluación de las posibles variaciones en una misma área, un control cruzado para determinar puntos homogéneos y una medida de control de calidad de los datos.
Para distinguir las diferencias entre dos puntos cromáticos (∆E) en una misma lesión, es necesario recurrir a las fórmulas diferenciales más reconocidas de la CIE. Hasta hace unas décadas la distinción entre dos puntos cromáticos, por ejemplo, en el espacio CIE-L*a*b*, bastaba con establecer la diferencia euclidiana entre dos puntos del espacio de color (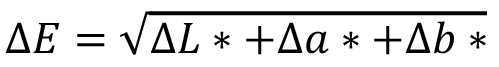 )12 o su diferencial de atributos (
)12 o su diferencial de atributos (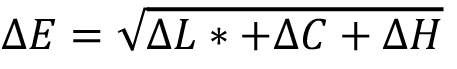 )13. Sin embargo, en años recientes, se ha demostrado que existen una cantidad de factores que es necesario tomar en cuenta para precisar mejor las diferencias entre dos puntos cromáticos, de ahí que la más reciente fórmula de diferencial cromático, denominada CIEDE2000 (∆E00) sea la fórmula más adecuada, recomendada por la CIE para establecer diferencias cromáticas (Ver Apéndice 1).
)13. Sin embargo, en años recientes, se ha demostrado que existen una cantidad de factores que es necesario tomar en cuenta para precisar mejor las diferencias entre dos puntos cromáticos, de ahí que la más reciente fórmula de diferencial cromático, denominada CIEDE2000 (∆E00) sea la fórmula más adecuada, recomendada por la CIE para establecer diferencias cromáticas (Ver Apéndice 1).
La fórmula del diferencial cromático CIEDE2000, tiene la particularidad de que es sensible a elementos recién descubiertos relativamente, como lo es el decaimiento en ciertos tonos azules que la forma euclidiana no contemplaba, aspecto que resulta de suma utilidad para distinguir los tonos azulados de los nevus melanocíticos, por ejemplo. Además, la fórmula CIEDE2000 mejora sustancialmente la precisión de las diferencias cromáticas entre dos puntos, y con base en la experiencia, se pueden definir niveles en distintos grados de tolerancia, a partir de los cuales se pueden establecer parámetros de diagnóstico vinculados a niveles de malignidad, riesgo y otros parámetros de control y apoyo diagnóstico al profesional dermatólogo, sobre todo muy apropiado en el desarrollo de la Teledermatología Diagnóstica.
Análisis de imágenes de lesiones melanocíticas: principios y práctica
La imagen de una lesión melanocítica obtenida en cualquier dispositivo implica que la imagen fue capturada bajo ciertas condiciones de iluminación con las características paramétricas del dispositivo. Sin embargo, para determinar la fidelidad de los colores y visualizarlo en un monitor o reproducirlo en una revista especializada, por ejemplo, hace falta algo más que la imagen en sí, pues es necesario disponer de colores de referencia, balancear los blancos (evitar los colores dominantes en el blanco y el negro), procesar las imágenes bajo estándares reconocidos y ajustar los perfiles de color entre los diferentes dispositivos de salida cuando de reproducirlos se trata.
Los colores de referencia son parches, escalas o patrones de color estándar de valores RGB conocidos, que son colocados junto al objeto, en este caso la lesión, y que al ser capturada la imagen quedan formando parte de la fotografía. Una vez que es capturada una imagen con las escalas de referencia, no es necesario seguir colocando los parches en las siguientes tomas fotográficas, si las condiciones no varían. En el proceso de captura de la imagen, un paso importante es el balance de blancos que en síntesis quiere decir que las partes más brillantes de la fotografía coincidan con el blanco neutro, y las partes más oscuras con el negro neutro, sin ninguna dominancia cromática. El formato en que las fotografías son archivadas debe ser tal que guarden la mayor cantidad de información posible de las mismas, es lo que se conoce como formato RAW (cruda), sin comprimir. Estos archivos por lo general son bastante más pesados que un formato JPG, Tif o Pdf, pues almacenan los datos RGB sin compresión de pixel a pixel.
Al tener los valores RGB de la escala o cartilla, un software especializado puede ajustar las diferencias cromáticas, de tal forma que la imagen “procesada” refiera a una imagen fiel del original, creando un perfil de la imagen de referencia, y al ser aplicada a todas las demás fotografías que son tomadas bajo las mismas condiciones, las imágenes fotográficas serán ajustadas y fieles al original. Las imágenes así procesadas podrán ser abiertas, analizadas o reproducidas con gran fidelidad. Ahora bien, los dispositivos periféricos de salida como los monitores, pantallas táctiles de teléfonos inteligentes, impresoras de oficina, y otros sistemas de reproducción gráfica, tienen sus propios perfiles cromáticos de salida, los cuales hay que ajustar. Estos se ajustan de acuerdo con el tipo de dispositivo o sustratos (en el caso de las impresoras), y constituyen archivos de “entendimiento” entre dispositivos para fidelizar los colores de reproducción. Son los llamados perfiles ICC (ICC: International Color Consortium) que son archivos que comparan y uniformizan los colores de salida.
Para efectos del estudio que nos ocupa, los más importantes podrían ser quizás, los perfiles de los monitores, que deben ser calibrados para poder visualizar los colores de las lesiones melanocíticas pigmentadas que han de ser analizados por el experto dermatólogo.
Ahora bien, los datos de las coordenadas (RGB, XYZ o L*a*b*) al ser almacenadas, guardan la información independientemente de la valoración subjetiva que puede hacerse de la lesión melanocítica pigmentada. Esta información puede ser analizada por diferentes algoritmos o aplicaciones informáticas, de tal manera que la información digital puede ser procesada fácilmente y quizás lo más importante es que los resultados de las mediciones pueden ser reproducibles.
La información de la captura de la imagen por un dispositivo fotográfico como el DigiEye©, cumple exactamente las mismas funciones que cualquier otro dispositivo de captura de imágenes. Al realizar un análisis comparativo entre las imágenes procesadas del DigiEye© y las procesadas por el software, se pueden evaluar la forma en que se podrían agrupar por zonas homogéneas aplicando criterios cromáticos.
Captura y procesamiento de imágenes
Las fotografías realizadas para este estudio fueron obtenidas con una cámara digital de la marca Canon, modelo EOS Revel T7©, con una resolución de 24 megapíxeles y mediante el uso de un objetivo Lente Macro Canon© EFS 60 mm para fotografías cercanas, a una distancia estándar de 10 cm Las condiciones de iluminación se mantuvieron constantes mediante un aro de luz provisto con un iluminante LED S20Beauty Live a 5600 K de temperatura correlativa de color. Todas las imágenes fueron obtenidas en el formato RAW, en condición semi automática. Para la manipulación primaria de los archivos se utilizó la aplicación RawTherapee© 5.8.
Para realizar el equilibrio de blancos, corregir la exposición de la imagen y asegurar la fidelidad de los colores, se utilizó el patrón de colores Color Checker Nano X-Ride© (4X6 cm). El procesamiento digital de las fotografías se realizó mediante las herramientas de Adobe (PhotoShop©, Lightroom© y Camera RAW©).
Mediante PhotoShop© se transforma los archivos CR2, provenientes de la cámara, al formato DNG (Digital Negative Image), el cuál es el estándar para los programas de Adobe. Para la corrección de la exposición y el ajuste de blancos de la imagen del Colorchecker© se utiliza el programa Lightroom©. El ajuste de blancos es importante para eliminar cualquier dominante de color propio de las características del objetivo y la cámara. En este caso se realizó con el gris neutro de la escala de grises del color de la Carta de Color. La corrección de la exposición asegura condiciones de iluminación estándar entre las diversas fotografías de la misma sesión, para que la temperatura de color sea semejante a la obtenida con el iluminante estándar D65. Esto se realizó mediante el ajuste de la exposición (Exposure) en el blanco de la escala de grises de la carta de color con respecto a las mediciones obtenidas utilizando el equipo VeriVide© DigiEye©, con un iluminante D65 a 10°. Incluyendo el ajuste en el negro (Blacks) de la escala de grises.
Procesamiento de imágenes digitales
En el caso de imágenes procedentes de una base de datos, por ejemplo, donde no se tiene control sobre los elementos de captura, estas pueden ser analizadas mediante un algoritmo especialmente diseñado. En este caso la fuente de datos de las imágenes puede provenir de distintas partes, que es el caso más común. Mediante la estandarización de los procedimientos para adquirir las imágenes, éstas ya vendrían debidamente calibradas y ajustadas, por lo que una aplicación informática común lo que haría es básicamente tomar los valores cromáticos (RGB, XYZ, L*a*b*) y realizar, en el caso del análisis de las imágenes de lesiones melanocíticas, las respectivas valoraciones comparativas entre las distintas partes de la lesión.
La diferencia frente a una medición directa de la lesión es que un algoritmo podría aplicarse a toda el área, incluso pixel a pixel, incluir bordes y partes que anteriormente no se han medido en una mezcla complicada de colores. Una cantidad grande de tonos en una misma lesión puede ser relativamente fácil de analizar, y se podrían establecer zonas homogéneas más dispersas o pequeñas.
En la literatura existen múltiples propuestas para la estimación de las coordenadas cromáticas [17], para el caso que nos ocupa, en el algoritmo se utilizó el método de análisis para la concentración de valores mediante histogramas [18].
El procesamiento de imágenes mediante los histogramas se realiza en tres partes principales. Primero se aplica un umbral a las imágenes para obtener una máscara binaria (representación) de la lesión. Aquí se utiliza el llamado umbral de Otsu. Una vez calculada la máscara, en el siguiente paso se aplica nuevamente la imagen original. En el último paso se utiliza un histograma y se calcula el cambio. Esto aplica para todos los colores presentes en la lesión. Cuanto mayor sea la variación, mayor será el valor que se devuelve.
A partir de los datos estimados de esta manera, se pueden establecer múltiples valoraciones, inclusive como elementos de diagnóstico avanzado. Por ejemplo, para el análisis propiamente de las lesiones melanocíticas, en los tonos más oscuros y los azules, que según la literatura tienen una mayor implicación en el melanoma, el algoritmo cuenta con un peso. Cuanto más oscuro sea el tono, mayor valor representa para el resultado general. Sin embargo, un algoritmo como el mencionado, que no contemple los ajustes de grises y blancos, solo analizará los datos crudos de la imagen, de ahí que los resultados contemplarían el error de origen por falta de corrección.
Medición comparativa de imágenes
Para identificar algunos de las dificultades de análisis mencionadas, se introdujeron las imágenes capturadas en el DigiEye© sin procesar, y se analizaron mediante el algoritmo desarrollado (ver tabla 1), comparando los datos con los analizados con el DigiPig©.
La imagen utilizada fue la de una carta de Color (Figuras 1.a) y 1.b) Colorchecker©, para ajustar los valores en cada uno de los parches de color. La salida de este programa es la creación de un perfil en donde se encuentran los valores de referencia de cada uno de los colores en las condiciones de iluminación establecidas. El perfil de color se utiliza en el programa Lightroom© para el análisis de cada una de las fotografías de las muestras pertenecientes a la misma sesión.

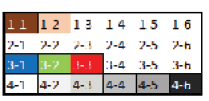
Figura 1. a) Checker Nano X-Ride© (4X6 cm) y b) clasificación numérica de los parches.
En esta serie de mediciones se realizaron cuatro lecturas por cuadro de color con cuadrados independientes de 1 mm por 1 mm. Empezando en el cuadro superior izquierdo y avanzando hacia la derecha en cada fila, hasta completar las cuatro filas de los cuadros de color, que posteriormente se guardaron en un archivo de Excel en formato “csv”.
Los parches 1-1 y 1-2 son colores piel (importantes para la valoración de lesiones en la piel) los parches 3-1, 3-2 y 3-3 corresponden a los parches puros de RGB (se justifican porque el análisis se realiza en un monitor o dispositivo electrónico), y finalmente, los seis colores en escala de grises (para el ajuste de blancos y la exposición) (cuadro 1).
Cuadro 1. Cuadro comparativo entre las mediciones cromáticas realizadas con el DigiEye© y mediante un algoritmo en parches seleccionadas de un ColorChecker© Classic.
|
Mediciones mediante algoritmo |
Mediciones DigiEye© Classic (5xC) |
||||||||
|
Cuadro |
L* |
a* |
b* |
MCDM |
L* |
a* |
b* |
MCDM |
DE00 |
|
NF1-1 |
33,65 |
9,77 |
13,64 |
2,43 |
37,39 |
13,32 |
12,02 |
0,36 |
4,92 |
|
NF1-2 |
65,34 |
10,88 |
13,44 |
2,03 |
65,69 |
16,37 |
14,77 |
0,38 |
4,21 |
|
NF3-1 |
30,86 |
25,61 |
-52,53 |
2,24 |
51,65 |
-3,08 |
-21,30 |
19,68 |
6,38 |
|
NF3-2 |
59,74 |
-32,25 |
37,58 |
1,86 |
54,94 |
-31,66 |
33,32 |
4,30 |
2,81 |
|
NF3-3 |
50,80 |
38,54 |
12,14 |
2,03 |
40,79 |
45,95 |
24,01 |
13,99 |
3,54 |
|
NF4-1 |
87,61 |
-0,88 |
1,51 |
1,91 |
95,63 |
-0,77 |
2,38 |
0,88 |
5,88 |
|
NF4-2 |
78,37 |
-0,94 |
-0,33 |
1,94 |
81,15 |
-0,77 |
0,05 |
0,42 |
3,08 |
|
NF4-3 |
68,58 |
-0,61 |
-0,41 |
1,95 |
67,47 |
-0,61 |
-0,06 |
0,35 |
6,58 |
|
NF4-4 |
53,55 |
-0,54 |
0,12 |
2,16 |
51,31 |
0,34 |
0,07 |
0,89 |
2,06 |
|
NF4-5 |
32,76 |
-0,50 |
-0,62 |
2,53 |
36,37 |
0,57 |
-0,57 |
1,08 |
4,38 |
|
NF4-6 |
9,28 |
-0,07 |
-0,32 |
2,80 |
19,92 |
1,74 |
-0,99 |
1,93 |
2,46 |
En el cuadro 1, se introdujeron los valores MCDM para cada método de análisis, así como los valores del cálculo de las diferencias de color mediante la fórmula CIEDE2000 (∆E00), cuya escala de valoración permite establecer las diferencias entre los diferentes tonos de los parches seleccionados en ambos métodos.
Metodología de detección cromática de lesiones melanocíticas
En forma general, la detección de lesiones melanocíticas pigmentadas a partir de lecturas exclusivamente cromáticas se lleva a cabo en tres grandes fases que se detallan a continuación:
Fase 1: Identificación de segmentos homogéneos de lesiones pigmentadas de referencia
Una vez que se han obtenido las imágenes debidamente calibradas y ajustadas de lesiones pigmentadas, es necesario identificar áreas o secciones homogéneas dentro de ellas para el posible establecimiento de patrones que puedan asociarse con un tipo de clasificación específica, y que pueda brindar una mejor idea del tipo, extensión, severidad y otras características, de tal modo que pueda desembocar en un diagnóstico acertado (Figura 2).
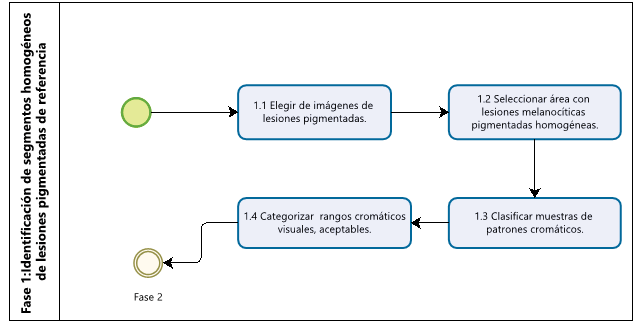
Figura 2. Diagrama de la Fase 1: Identificación de segmentos homogéneos en lesiones pigmentadas de referencia.
El proceso de identificación de segmentos homogéneos en las imágenes pasa por un proceso de tres etapas principales, en donde se puedan establecer los patrones básicos de identificación y caracterización de las imágenes.
La primera etapa dentro de esta fase (1.1) lo constituye la Selección y clasificación de segmentos homogéneos de lesiones pigmentadas, incluyendo rangos aceptables de evaluación, en un proceso de cuatro pasos:
1.Elegir imágenes de lesiones pigmentadas que muestren patrones cromáticos típicos: se identifican y seleccionan imágenes que previamente valoradas y clasificadas como lesiones típicas. El objetivo es crear las imágenes patrón donde los colores son claramente identificados en ellos.
2.Seleccionar el área de las lesiones melanocíticas pigmentadas que muestran homogeneidad cromática: las imágenes son segmentadas en áreas homogéneas con características similares. En una misma imagen pueden seleccionarse varias secciones con distintos estadios y tipos de lesiones.
3.Clasificar muestras de patrones cromáticos: se toman muestras de color homogéneo de distintas lesiones melanocíticas y se clasifican por familias, las cuales representan un mismo tipo de lesión y su estadio. Se calcula el tamaño de la muestra representativa, con mayor uniformidad de las mediciones.
4.Categorizar bajo criterio experto, los rangos cromáticos visuales, aceptables bajo una misma categoría: Expertos dermatólogos deberán clasificar los “rangos cromáticos” bajo los cuales se podría decir que corresponden a un mismo tipo de lesión melanocítica, en un “estadio similar”. Esta primera clasificación es una clasificación visual con criterio experto, cuyas muestras deberán ser validadas por expertos independientes.
La segunda etapa de esta fase (1.2), es la caracterización de segmentos cromáticos homogéneos de lesiones pigmentadas, mediante histogramas de dispersión y lecturas estadísticas a partir de las coordenadas cromáticas. En un proceso en tres partes:
5.Determinación de coordenadas CIELAB de las secciones homogéneas: aquí cada sección es medida en al menos 20 puntos distintos (i) de la superficie, aproximadamente equidistantes entre sí, de tal manera que puedan determinarse las coordenadas L*, a*, b* promedio.
En la figura 3 se han seleccionado como ejemplo áreas de segmentos homogéneos. En cada uno de los tres puntos se han determinado las coordenadas cromáticas L*a*b*. En la tabla 2 se presentan los valores promedio determinados en una pequeña área de 1 mm2 que se muestran en el plano cartesiano de la figura 4.

Figura 3. Tres puntos seleccionados para la medición de las coordenadas de color L*a*b*. Fuente de la fotografía de la lesión: Tschandl, Philipp, 2018.
Cuadro 2: Valores promedio de las coordenadas L*a*b* en tres regiones homogéneas de una imagen de una lesión melanocítica.
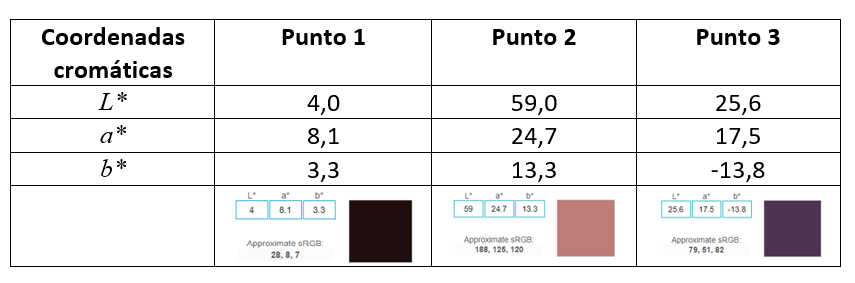
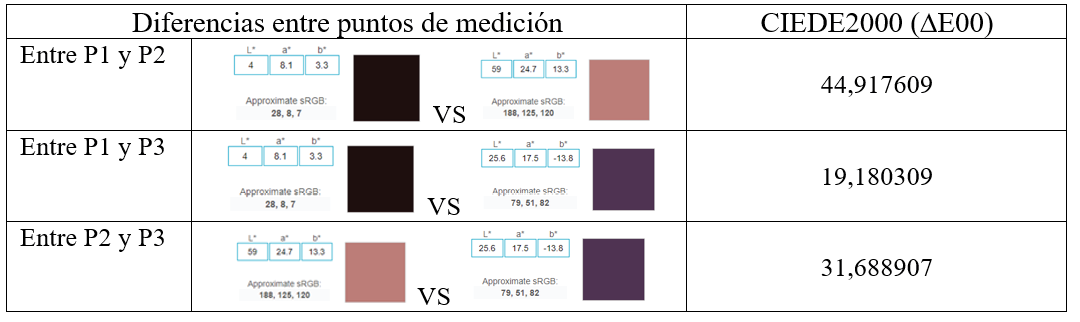
Obsérvese que el punto 2 presenta un mayor valor de la coordenada L*, pues es un punto más claro. Con respecto a la coordenada a*, el punto 2 presenta una coordenada positiva y mayor que en el punto 1, pues tiene un alto componente del color rojo. En el punto 3, la coordenada es negativa porque en la lesión se aprecia una coloración azulada. Las diferencias de color entre los puntos 1, 2 y 3 se determinan con la fórmula CIEDE2000 (cuadro 3).
Cuadro 3. Mediciones de las diferencias de color entre los puntos seleccionados
6.Determinación de las lecturas cromáticas a partir de histogramas: Esta sección permite validar las lecturas anteriores y establecer un único valor cromático (y eventual tolerancia) al menos con 4 σ, para cada imagen de referencia. Los histogramas se pueden realizar a partir de las lecturas R, G, B de las diferentes áreas de las imágenes seleccionadas, esto ayudará a establecer la lectura característica de cada una de ellas, y a partir de esta lectura se determina la coordenada en el espacio de color CIELAB (figura 4).
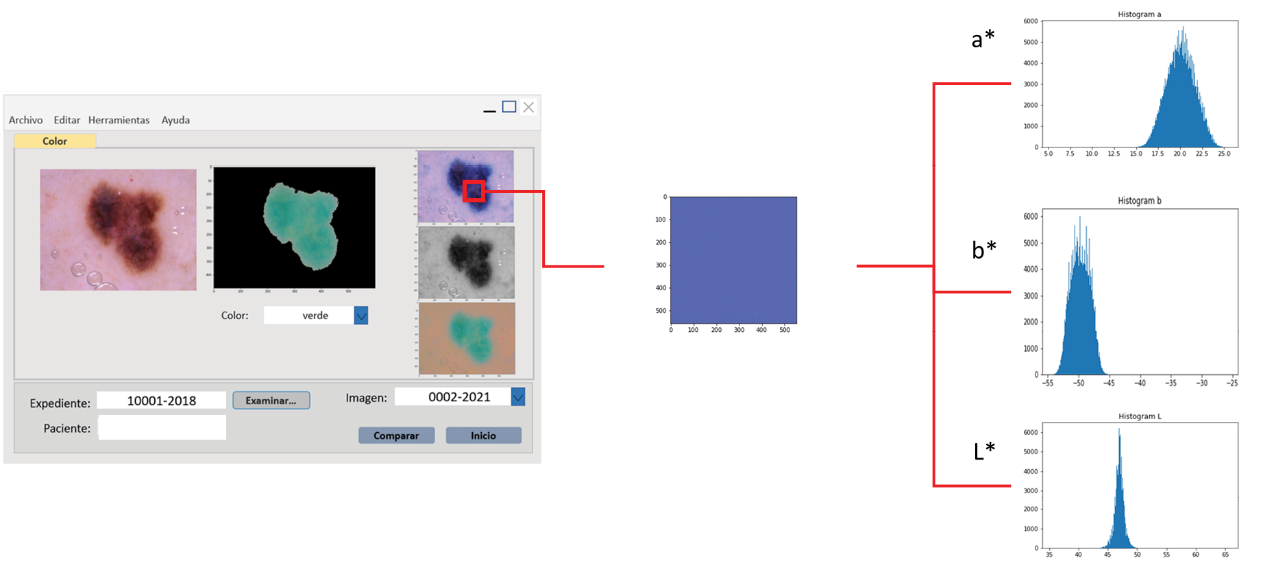
Figura 4. Histogramas de las coordenadas L*a*b* de un parche de color extraído de un filtro de una imagen de una lesión melanocítica (imagen con fines ilustrativos).
7.Establecimiento del método de lectura comparativa con distintas muestras: Para determinar la comparación de muestras se utiliza la fórmula diferencial cromática CIEDE2000 (∆E00), para obtener las diferencias y tolerancias (Tabla 3, columna CIEDE2000).
Fase 2: Asociación de segmentos homogéneos con tipos de lesiones pigmentadas
La segunda fase, que permite propiamente la asociación de segmentos homogéneos con los distintos tipos de lesiones pigmentadas, está dividida en tres procesos:
1.Identificación de lesiones pigmentadas: En esta etapa se seleccionan lesiones pigmentadas reales (distintas a las utilizadas en la sección anterior), que serán sometidas a las valoraciones comparadas cromáticas. Se deberá seleccionar con base en una muestra significativa, para determinar la validez del mecanismo de identificación. Se pretende que sean adquiridas mediante condiciones controladas establecidas en la primera sección (aunque las pruebas iniciales podrán ser seleccionadas a partir de bases de datos predeterminadas).
En este caso, la muestra significativa deberá ser calculada, a fin de establecer la validez del experimento. En caso de ser necesario (cuando son bases de datos no públicas, o pacientes de algún experto) se recurre a los protocolos establecidos para tal situación.
2.Caracterización de lesiones pigmentadas con base en la identificación de secciones homogéneas: Las imágenes de lesiones pigmentadas son seccionadas en secciones homogéneas, y comparadas con las bases de datos de colores homogéneos. Podrán realizarse estudios con base al criterio experto, ajeno a los utilizados en la fase anterior. La comparación se realiza para establecer el tipo, estadio y severidad de las lesiones.
3.Una vez que están debidamente identificadas, sus coordenadas cromáticas son medidas en puntos equidistantes. A partir de esta lectura son comparadas con las imágenes de muestra establecidas en el proceso 1.1. y 1.2, mediante la fórmula CIEDE2000 (∆E00). Con base en estas lecturas, se establece su pertenencia a la categoría específica.
4. Determinación del grado de malignidad con base en las características pigmentadas en secciones homogéneas: En este punto del proceso, basándose en la determinación cromática de las secciones homogéneas, se identifican las lesiones pigmentadas con diferentes grados de malignidad, y se validan con expertos.
5. Aplicación de la metodología a la caracterización de secciones heterogéneas: En esta última fase de la segmentación se someten a pruebas diagnósticas, las lesiones melanocíticas con características cromáticas múltiples, cuya heterogeneidad permite establecer diferencias por secciones y hacer una valoración amplia de las lesiones pigmentadas a fin de validar el método.
Fase 3: Integración
En esta fase se pretende asociar los resultados de la anterior fase con características del sistema ABCDE (especialmente al color) con otros mecanismos para identificación y clasificación de melanomas; prácticamente, en todas ellas de alguna manera está involucrado el color. La integración combinada de características morfológicas, dimensionales y de aspecto, seleccionadas a partir de una identificación metodológica paralela, junto con la caracterización cromática permite establecer el diagnóstico apropiado.
Los valores cromáticos extraídos de las fases anteriores pueden servir de insumo para realizar análisis comparativos y establecer similitudes entre distintos métodos de valoración que utilicen el color como base para sus análisis.
Conclusiones
El análisis clínico por parte de los especialistas en dermatología cuenta con técnicas instrumentales y metodológicas que, sobre todo en las últimas dos décadas, viene desarrollando importantes progresos, mejorando el diagnóstico clínico significativamente. Sin embargo, la caracterización cromática de las lesiones melanocíticas y su valoración experta sigue siendo en gran medida subjetiva.
La valoración cromática de las lesiones melanocíticas es determinante en la identificación del tipo de melanoma y su malignidad en toda consulta dermatológica, de ahí que la determinación precisa de sus coordenadas, así como las diferencias que presenta dentro de la misma lesión y la piel circundante puede resultar de mucha ayuda al profesional en dermatología para establecer las patologías asociadas, los grados de avance en periodos determinados y los registros para interconsultas específicas.
Las coordenadas cromáticas de las distintas tonalidades de una lesión melanocítica, indistintamente del método que se utilice, serán prácticamente las mismas, siempre que utilicemos en lo posible los mismos instrumentos, y el mismo sistema de gestión cromática como el propuesto, es decir, las mediciones son reproducibles.
A partir de los estándares desarrollados por la CIE, es posible establecer con precisión, las coordenadas cromáticas de cada uno de los puntos dentro de una lesión melanocítica, de tal forma que pueden establecerse diferencias entre sus distintas partes, asociar tonalidades con grados de malignidad e incluso abrir la posibilidad de observar su evolución mediante los resultados diferenciales y su variabilidad a través del tiempo.
Para desarrollar un adecuado análisis cromático de las lesiones melanocíticas es necesario establecer las condiciones de captura y procesamiento de las imágenes que nos permitan ajustar los parámetros de iluminación y observación, así como ajustar los perfiles de los distintos dispositivos para evitar distorsiones, que puedan incidir en un diagnóstico errado.
La medición comparativa de datos cromáticos realizada mediante el cálculo de variables mediante un algoritmo especialmente diseñado, en contraposición de las mediciones directas en un dispositivo como el DigiEye©, permite establecer las diferencias de distintos métodos objetivos de análisis cromático, que pueden ser utilizados en la valoración profesional de lesiones melanocíticas pigmentadas.
La detección cromática de lesiones melanocíticas en tres fases establece una metodología objetiva que puede aplicarse a todo tipo de dispositivos, permitiendo la eliminación de distorsiones procedentes de las condiciones de iluminación, y a su vez asociar segmentos homogéneos con tipos específicos de lesiones pigmentadas. Sus resultados permiten integrar distintos sistemas de identificación y clasificación de melanomas, facilitando su caracterización y diagnóstico.
Discusión
La profesionalización de la valoración cromática objetiva de lesiones pigmentadas requiere por parte del profesional en dermatología, la adquisición de competencias que normalmente no son parte de su formación profesional. Pensar en términos cromáticos es pensar en tres dimensiones a la hora de ubicar las coordenadas cromáticas, y analizar sus diferencias. También, requiere el desarrollo de destrezas para asociar tonos y combinaciones de tonos con características típicas de los melanomas.
Adicionalmente, será importante el desarrollar habilidades para determinar las posibles distorsiones, desviaciones o errores que pueden derivarse de un análisis subjetivo de imágenes que no han sido procesadas o referenciadas adecuadamente.
Los algoritmos de análisis de datos procedentes de imágenes, así como la Inteligencia Artificial, se vislumbran como uno de los pilares de la medicina del futuro, sin duda serán un apoyo importante al profesional dermatólogo. Sin embargo, imágenes no ajustadas pueden llevar, al igual que si se realizara en forma subjetiva, a conclusiones erradas que pueden derivar en diagnósticos con consecuencias indeseadas.
Referencias
[1] Ureña Vargas, M. J., Sánchez Carballo, R., Kivers Bruno, G. Cerdas Soto, D., & Fernández Angulo V. “Cáncer de piel: revisión bibliográfica” Revista Ciencia Y Salud Integrando Conocimientos, Vol. 5, Num. 5 (2021), Pág. 85-94. https:// doi.org/10.34192/ciencia y salud.v5i5.347
[2] Zekayi K., Burhan E., Server S. and Yalçın T. “Current Management of Malignant Melanoma: State of the Art”; Chapter 4; IntechOpen Books Series pp. 69 (2013).
[3] Glenn Merlino et. All. “The state of melanoma: challenges and opportunities”; Journal of Pigment Cell & Melanoma Research, Vol. 29 Issue 4; pp. 404-416, (2016).
[4] Naomi Ch. Et all. “Teledermatology for diagnosing skin cancer in adults”; The Cochrane Library Collaboration. Published by John Wiley & Sons, Ltd. (2018)
[5] A.P. Kassianos,J.D. Emery,P. Murchie,F.M. Walter; “Smartphone applications for melanoma detection by community, patient and generalist clinician users: a review”. British Journal of Dermatology, BJD. 172, pp. 1507-1518, (2015).
[6] Titus J. Brinker et all. “Deep learning outperformed 136 of 157 dermatologists in a head-to-head dermoscopic melanoma image classification task”. European Journal of Cancer 113; 47-54(2019).
[7] David E. Elder et all. “The 2018 World Health Organization Classification of Cutaneous, Mucosal, and Uveal Melanoma” College of American Pathologists, “Archives of Pathology & Laboratory Medicine” Review (2020)
[8] H.P. Soyer, R.P. Braun, G. Argenziano. “First Congress of the International Dermoscopy Society (IDS)” Dermatology Journal pp. 212:265–320, (2006).
European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics e Update European Journal of Cancer (2019)
[9] European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics e Update European Journal of Cancer (2019)
[10] John D. Mollona , Jenny M. Bostenb , David H. Peterzellc , Michael A. Webster. “Individual differences in visual science: What can be learned and what is good experimental practice?” Visión Research. Vol. 141, (2017) Pages 4-15.
[11] Pasmanter N, Munakomi S. Physiology, Color Perception. [Updated 2021 Sep 18]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK544355/
[12] Ellen J. Gerl & Molly R. Morris. “The Causes and Consequences of Color Vision” Evo Edu Outreach (2008) 1:476–486.
[13] Mike Webster. “Environmental Influences on Color Vision” Encyclopedia of Color Science and Technology. Springer Science+Business Media NY (2015) p. 1-6.
[14] Andrew Stockman, “Cone fundamentals and CIE standards”; Behavioral Sciences, 30:87–93 (2019).
[15] P. Capilla, J.M. Artigas, J. Pujol. “Fundamentos de colorimetría”. Ed. Universitat de Valencia, (2002).
[16] O. O. Olugbara, T. B. Taiwo, and D. Heukelman. “Segmentation of Melanoma Skin Lesion Using Perceptual Color Difference Saliency with Morphological Analysis”. Hindawi Mathematical Problems in Engineering Vol. (2018).
[17] Annaby, M.H., Elwer, A.M., Rushdi, M.A. et al. Melanoma Detection Using Spatial and Spectral Analysis on Superpixel Graphs. J Digit Imaging 34, 162–181 (2021). https://doi-org.ezproxy.itcr.ac.cr/10.1007/s10278-020-00401-6
[18] Soumya, R. S., Neethu, S., Niju, T. S., Renjini, A., & Aneesh, R. P. (2016, July). Advanced earlier melanoma detection algorithm using colour correlogram. In 2016 International Conference on Communication Systems and Networks (ComNet) (pp. 190-194). IEEE.
Apéndice 1: Fórmula diferencial CIEDE2000 (∆E00)
La fórmula CIEDE2000 (∆E00) [ver ecuación 2] es una fórmula evolucionada de la fórmula ∆E, y actualmente es reconocida como una norma ISO (ISO/CIE 11664-6:2014)
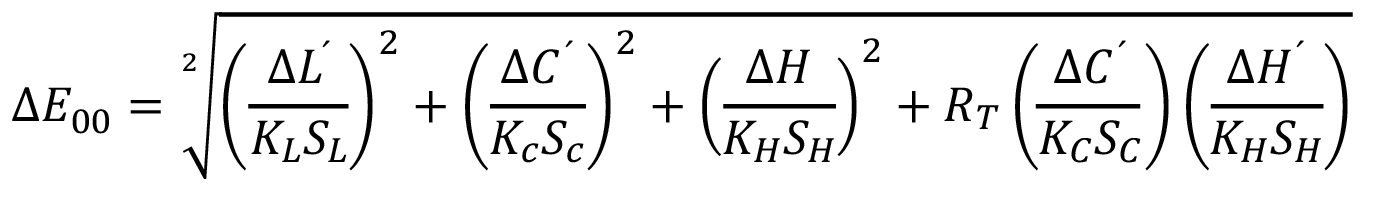 (2)
(2)
Donde:
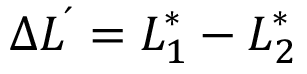 y
y 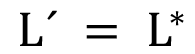 (3)
(3)
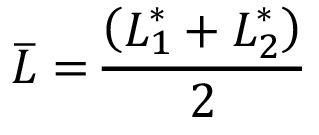 y
y 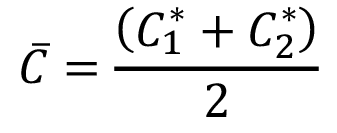 (4)
(4)
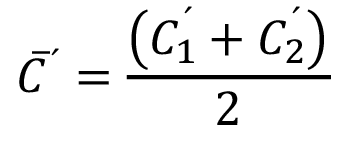 y
y 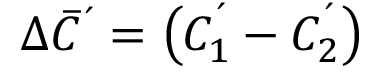 (5)
(5)
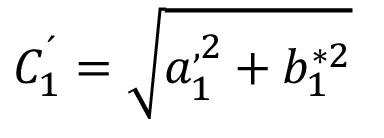 y
y 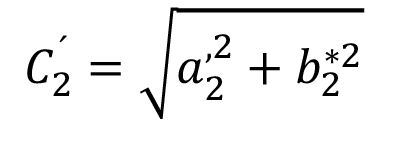 (6)
(6)
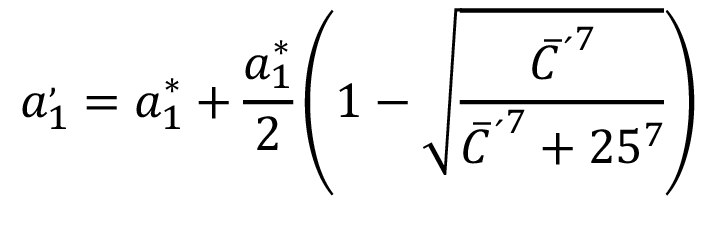 (7)
(7)
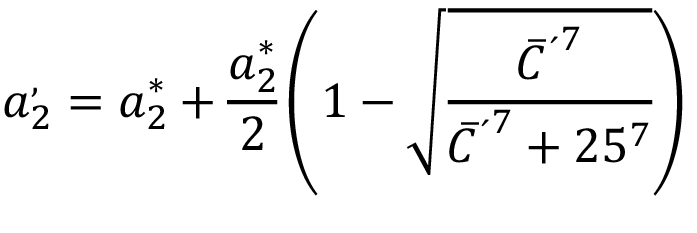 (8)
(8)
Los factores paramétricos bajo condiciones de referencia en los que usualmente adquieren los valores de 1 (Ecuación 9).
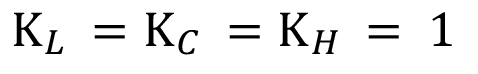 (9)
(9)
El Índice de compensación de la Claridad (SL)
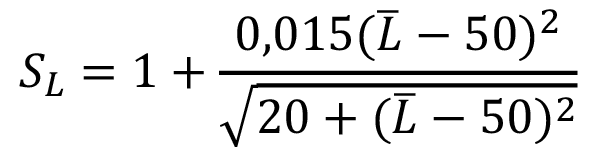 (10)
(10)
Índice de compensación del Croma (SC)
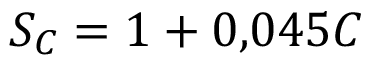 (11)
(11)
Índice de compensación del Matiz (SH)
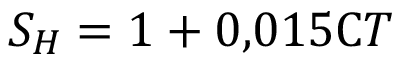 (12)
(12)
Donde:
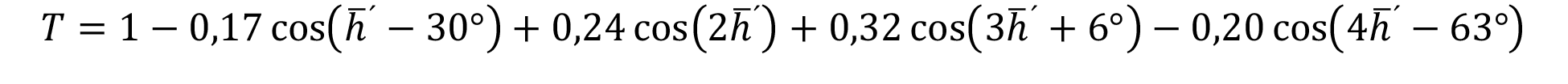
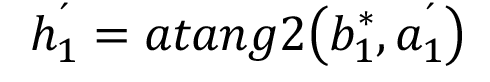 mod 360o (13)
mod 360o (13)
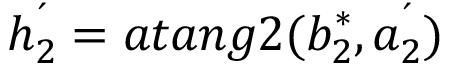 mod 360o
mod 360o
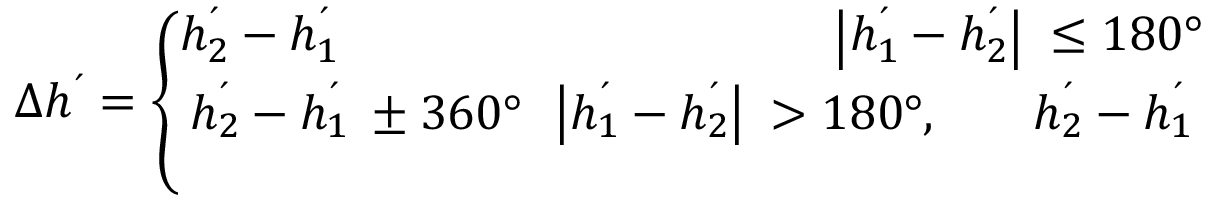
Nota: Cuando C1´o C2´ son cero, ∆h también es irrelevante ya que tiende a cero.
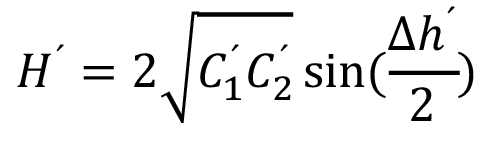
Nota: Cuando C1´o C2´ son cero, 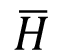 también ∆h´ no se divide entre 2 (Ecuación 2).
también ∆h´ no se divide entre 2 (Ecuación 2).
1 Escuela de física Instituto Tecnológico de Costa Rica.
Correo electrónico: mamurillo@tec.ac.cr  https://orcid.org/0000-0002-6913-3472
https://orcid.org/0000-0002-6913-3472
2 Escuela de Computación Instituto Tecnológico de Costa Rica.
Correo electrónico: lcalvo@tec.ac.cr  https://orcid.org/0000-0003-3802-9944
https://orcid.org/0000-0003-3802-9944
3 Escuela de física Instituto Tecnológico de Costa Rica. Correo electrónico: emontero@tec.ac.cr  https://orcid.org/0000-0002-4545-5805
https://orcid.org/0000-0002-4545-5805
4 Escuela de física Instituto Tecnológico de Costa Rica. Correo electrónico:
jose.perez@tec.ac.cr  https://orcid.org/0000-0001-7184-9974
https://orcid.org/0000-0001-7184-9974
5 Escuela de física Instituto Tecnológico de Costa Rica.
Correo electrónico: dgutierrez@itcr.ac.cr https://orcid.org/0000-0001-7190-8858
https://orcid.org/0000-0001-7190-8858
6 Hospital San Juan de Dios, Servicio de Anatomía Patológica. Correo electrónico: danielgutiear@gmail.com
7 Ver Registro Nacional de Tumores, MS; https://www.ministeriodesalud.go.cr/index.php/vigilancia-de-la-salud/estadisticas-y-bases-de-datos/estadisticas/estadistica-de-cancer-registro-nacional-tumores
8 Células de la Cresta Neural (CCN), son células pluripotenciales efímeras que emergen en las primeras semanas del embrión, en el proceso del desarrollo neuronal (neurulación) y pueden migrar a casi todos los tejidos del embrión, tienen la particularidad que pueden derivar en otros tipos de células.
9 The consensus net meeting on dermoscopy (CNMD) in 2000.
10 Ver serie ISO 11664; https://www.iso.org/committee/55238/x/catalogue/.
11 En nuestro caso se utilizó la base de datos: “HAM10000_images_part_1.zip”, The HAM10000 dataset, a large collection of multi-source dermatoscopic images of common pigmented skin lesions, https://doi.org/10.7910/DVN/DBW86T/XJZSQ6, Harvard Dataverse, V3
12 Donde: 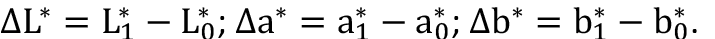
13 Donde: La diferencia del croma es: 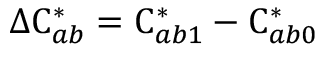 ; la diferencia del ángulo de tono es:
; la diferencia del ángulo de tono es: 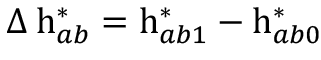 ; la diferencia de tono es:
; la diferencia de tono es: