Remoción de parámetros fisicoquímicos y microbiológicos de plantas de tratamiento de aguas residuales del Gran Área Metropolitana, Costa Rica
Remotion of physicochemical and microbiological parameters on wastewater treatment plants in Costa Rica’s Great Metropolitan Area
Luz María Chacón-Jiménez1, Eric Morales-Mora2, Ernesto Alfaro-Arrieta3, Carmen Valiente-Alvarez4, Liliana Reyes-Lizano5, Kenia Barrantes-Jiménez6
Fecha de recepción: 23 de septiembre, 2022
Fecha de aprobación: 28 de enero, 2023
Chacón-Jiménez, L.M; Morales-Mora, E; Alfaro-Arrieta, E; Valiente-Alvarez, C; Reyes-Lizano, L; Barrantes-Jiménez, K Remoción de parámetros fisicoquímicos y microbiológicos de plantas de tratamiento de aguas residuales del gran área metropolitana, costa rica. Tecnología en Marcha. Vol. 36, No 4. Octubre-Diciembre, 2023. Pág. 94-106. https://doi.org/10.18845/tm.v36i4.6398
https://doi.org/10.18845/tm.v36i4.6398
Palabras clave
Agua residual; virus; saneamiento; vigilancia ambiental; higiene ambiental.
Resumen
Las aguas residuales inadecuadamente tratadas son un factor de riesgo para la salud pública dado que son un vehículo de diseminación de microorganismos patógenos como virus entéricos. Sin embargo, la circulación de patógenos virales en esta matriz ha sido poco estudiada en la región. El objetivo de este trabajo fue describir la presencia de cinco virus enteropatógenos y parámetros operativos básicos, en afluentes y efluentes de cinco plantas de tratamiento de aguas residuales (PTAR) con sistemas de lodos activados, ubicadas en el Gran Área Metropolitana de Costa Rica durante el 2013. Los patógenos virales estudiados fueron: enterovirus, virus de hepatitis A, rotavirus A, norovirus G1 y norovirus G2 (determinados por PCR punto final); mientras que los parámetros de control de rendimiento analizados incluyeron disponibilidad bioquímica de oxígeno, disponibilidad química de oxígeno, sólidos suspendidos, sólidos sedimentables, grasas y aceites, sustancias activas al azul de metileno y coliformes fecales. A nivel fisicoquímico todas las plantas mostraron un rendimiento aceptable, caso contrario a los parámetros microbiológicos, todos los virus investigados fueron detectados en aguas tratadas y no tratadas durante todo el año, siendo más frecuentes durante la época seca. El virus más frecuente fue rotavirus, seguido por norovirus G1. En conclusión, este estudio describe que durante el periodo estudiado las PTAR fueron eficientes en la remoción de parámetros fisicoquímicos, y que la circulación de virus entéricos es común en las PTAR estudiadas. Por ello, es necesaria la inclusión de procesos de desinfección adicionales para una descarga segura de las aguas tratadas.
Keywords
Wastewater; virus; sanitary engineering; environmental monitoring; environmental health
Abstract
Inefficient treated wastewaters are a critical factor for public health due to can be a dissemination vehicle for pathogens such as enteric viruses; nevertheless, the enteric viral circulation has been poorly studied in our region. This work aims to study the presence of five enteric virus, in parallel with operative parameters, in affluents and effluents of five wastewater treatment plants (WWTP) located in the Greater Metropolitan Area of Costa Rica in 2013. The viral pathogens studied were enterovirus, hepatitis A virus, rotavirus A, and norovirus GI and GII (determined by end point PCR technique); since basic control parameters analyzed were biochemical oxygen demand, chemical oxygen demand, suspended solids, settable solids, fats and oils, blue methylene active substances, and fecal coliforms. All wastewater treatment plants showed acceptable removal of physicochemical parameters, but with microbial parameters, its efficiency was low; all enteric viruses were detected year-round at effluents and influents of the WWTP, with a predominance during the dry season. The most frequently detected virus was rotavirus, followed by norovirus G1. In conclusion, the studied wastewater treatment plants are efficient to remove physicochemical parameters; the year circulation of enteric virus in Costa Rica was demonstrated, and finally, a wastewater treatment plant improvement it is necessary to achieved treated waters safety discharges.
Introducción
El agua residual se define, de acuerdo con Reglamento de Vertido y Reuso de Aguas Residuales N°33601-MINAE-S, como aquella que ha recibido un uso y cuya calidad ha sido modificada por la incorporación de agentes contaminantes de origen antropogénico; se reconocen dos tipos: agua residual tipo ordinario generado por actividades domésticas (uso de inodoros, duchas, lavatorios, lavado de ropa, etc.) y aguas de tipo especial que incluyen aguas de uso diferente al ordinario (industriales, pluviales e infiltraciones de origen desconocido) [1]. Distintos agentes químicos y biológicos causantes de enfermedad en poblaciones humanas son trasmitidos por aguas residuales. Las sustancias tóxicas pueden ser de origen antropogénico, por ejemplo: hidrocarburos, plaguicidas o naturales como metales pesados [2]. Mientras que entre los microorganismos patógenos se encuentran bacterias como Escherichia coli diarrogénica [3], parásitos como Cryptosporidium sp. y Ascaris sp., y virus patógenos como rotavirus, norovirus y más recientemente SARS-CoV-2 [4]–[8].
Las aguas residuales no tratadas o tratadas de manera inadecuada, son un importante vehículo de diseminación de virus entéricos al ambiente por varias de las características inherentes de éstos patógenos, entre las más importantes destacan las altas concentraciones virales en la materia fecal (105 a 1011 por g de heces), sus bajas dosis infectantes (por ejemplo para rotavirus es 5,6 partículas virales), su resistencia parcial a las concentraciones de cloro normalmente utilizadas en las plantas de tratamiento, su estabilidad en un extenso rango de pH, y finalmente, las plantas de tratamiento por sí mismas, tienen una eficiencia parcial en la reducción de éstos patógenos [9]–[11].
En el año 2013 el Laboratorio Nacional de Aguas (LNA) del Instituto costarricense de Acueductos y Alcantarillados realizó controles operacionales en 16 sistemas de tratamiento de aguas residuales, de los cuales cinco utilizan el sistema de lodos activados y se localizan en el Gran Área Metropolitana (GAM) [12], éstas fueron incluidas en el presente estudio. Para el año 2019 el LNA realizó vigilancia en 26 plantas de tratamiento de aguas residuales, siete con sistema de lodos activados y las restantes son lagunas facultativas o de oxidación [13]. El proceso de lodos activados consiste en un tanque con agitación continua, de un cultivo microbiano disperso en forma de flóculo, los virus se adhieren a estos flóculos, se sedimentan y da paso a un proceso de predación activa, vía microorganismos protistas capaces de metabolizar, de manera parcial, los contaminantes biológicos (virus, bacterias o levaduras) presentes en el agua [14]. Sin embargo, la eficiencia de las plantas puede disminuir por factores como diseño de la planta, tipo de comunidad microbiana residente, alta carga microbiana y ausencia de tratamientos terciarios, siendo posible la descarga de virus patógenos en los efluentes lo que representa un peligro para la salud pública [4].
Con base en lo anterior, el propósito de este estudio fue describir durante el año 2013, en afluentes y efluentes de PTAR ubicadas en la GAM y que utilizan lodos activados como sistema de depuración, la posible presencia de cinco virus entéricos (rotavirus, norovirus GI y norovirus GII, hepatitis A y enterovirus) junto con el análisis de los parámetros de control básicos establecidos por la legislación costarricense para el monitoreo de éstas: demanda bioquímica de oxígeno (DBO), demanda química de oxígeno (DQO), sólidos suspendidos, sólidos sedimentables, grasas y aceites, sustancias activas al azul de metileno y coliformes fecales.
Materiales y métodos
Muestreo
Se analizaron 119 muestras de 1,5 L (n=60 entrada y n=59 salida) provenientes de cinco plantas de tratamiento de aguas residuales ubicada en el Gran Área Metropolitana de Costa Rica. Las plantas reciben aguas de tipo doméstico proveniente de entre 123 y 1033 personas y consisten en un tratamiento primario seguido de uno biológico de lodos activados, las aguas tratadas descargan en la cuenca del Río Virilla sin desinfección posterior al tratamiento (Figura 1).
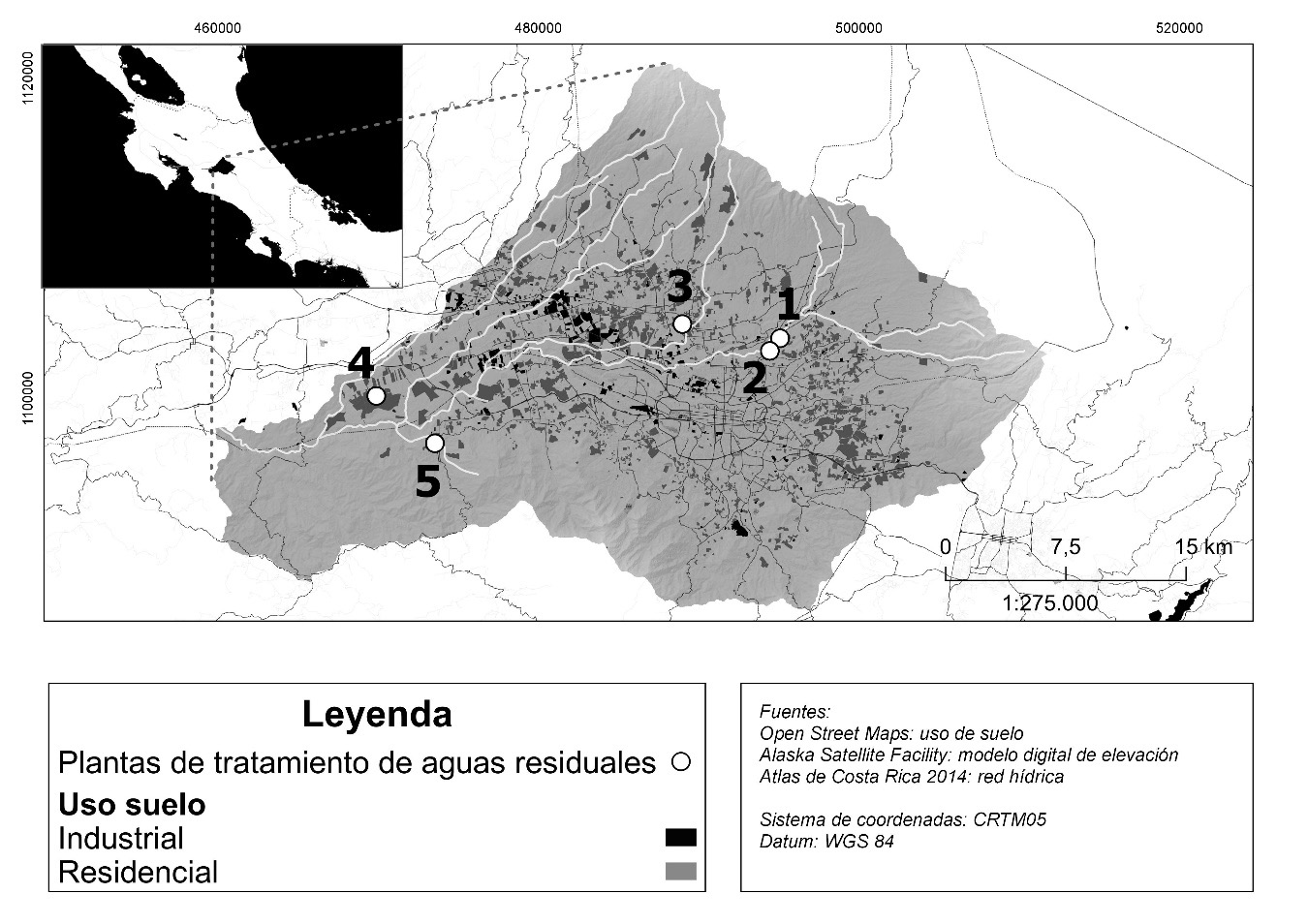
Figura 1. Delimitación de la cuenca del río Virilla y ubicación geográfica de las PTAR incluidas en el estudio.
La toma de muestras se realizó a lo largo de un año, a fin de incluir muestras de época seca (marzo y diciembre) y época lluviosa (mayo y octubre) del 2013, en todas las plantas de tratamiento de aguas residuales que utilizaban lodos activados, estaban administradas por el Instituto Costarricense de Acueductos y Alcantarillados y se localizaban en el Gran Área Metropolitana. El muestreo fue de tipo simple instantáneo, entre 9:00 a.m. y 12:00 p.m. Para el análisis fisicoquímico se analizó una muestra por planta por periodo. Para el análisis microbiológico se tomaron muestras tres días consecutivos, por periodo. Todas las muestras se colectaron en recipientes ámbar estériles y se transportaron a 4 °C.
Análisis de parámetros fisicoquímicos
La toma de muestras fisicoquímicas y sus respectivos análisis se realizaron de acuerdo con lo establecido en los Métodos Estandarizados para la Examinación de Agua y Agua Residual (Standard Methods for the Examination of Water and Wastewater [SMEWWW]) [15]. El muestreo se realizó con botellas de plástico de alta densidad previamente lavadas; las muestras se mantuvieron en refrigeración durante el transporte y fueron analizadas en el Laboratorio Nacional de Aguas para los parámetros obligatorios del Reglamento de Vertido y Reuso de aguas Residuales N°33601-MINAE-S (1) (Cuadro 1).
Cuadro 1. Parámetros Obligatorios según Reglamento de Vertido y Reuso de aguas Residuales N°33601-MINAE-S (1).
|
Análisis |
Método de referencia [15] |
|
Demanda Química de Oxígeno (DQO) |
5220D |
|
Demanda Bioquímica de Oxígeno (DBO) |
5210B |
|
Potencial de Hidrógeno |
4500H |
|
Temperatura |
2550B |
|
Sólidos Sedimentables |
2540F |
|
Coliformes Fecales |
9221E |
|
Grasas y Aceites |
5520 B |
|
Sólidos Suspendidos Totales |
2540 B |
|
Sustancias Activas al Azul de Metileno (SAAM) |
5540 C |
Análisis de coliformes fecales
Para el análisis de coliformes fecales se utilizó la técnica de fermentación de tubos múltiples (número más probable) de acuerdo con el método 9221E del SMEWW [15]. Para esto se inocularon diluciones seriadas hasta 1:1 000 000 para las entradas y 1:100 000 para las salidas en series de 5 tubos de caldo lauril sulfato (Oxoid®, Estados Unidos). Después de 48 ± 4 h de incubación a 35 ± 0,5 °C se analizó presencia de turbidez y gas en la muestra, todos los tubos que cumplieran estas características se inocularon en caldo EC-MUG (Oxoid®, Estados Unidos) y se incubaron por 24 ± 2 h a 44,5 ± 0,5 °C, todos aquellos tubos que presentaron turbidez y gas se consideraron positivos. La concentración final se estableció de acuerdo con la tabla de NMP escrita en SMEWWW [15]. Para estos ensayos se utilizaron los siguientes controles: Escherichia coli ATCC 25922 control positivo, Salmonella spp. ATCC 13076 control negativo y solución amortiguadora de dilución como control de reactivos.
Concentración de virus patógenos
Todas las muestras fueron prefiltradas con un tamiz metálico de 0,15 mm de poro con el fin de romper partículas orgánicas grandes. Posteriormente se siguió el protocolo 9510C del SMEWW [15] con modificaciones [16]. Brevemente, se realizó una una filtración consecutiva de la muestra por filtros con diferente tamaño de poro, pretratados con extracto de carne al 3% (pH 7,2; Oxoid®, Reino Unido). La filtración inició con filtros de fibra de vidrio, 47 mm de diámetro y un poro de 80 µm (13400-47-Q; Sartorius®, Alemania), después con filtros de nitrato de celulosa de 47 mm y 1,2 µm de poro (11303-47-N; Sartorius®, Alemania); posteriormente con filtros de acetato de celulosa de 47 mm y 0,4 µm de poro (11106-47-ACN; Sartorius®, Alemania). Finalmente, se ajustó el pH del filtrado a 3,5 y se filtró con un filtro de 0,2 µm y diámetro de 47 mm de acetato de celulosa (1110tr-47N Sartorius®, Alemania), utilizando aproximadamente 3 filtros por cada muestra. Los filtros fueron eluidos utilizando 15 mL de extracto de carne pH 9,0 al 3%. Los eluídos fueron precipitados con PEG8000 y 17,5 g/L de NaCl después de una agitación a 4 ºC durante toda la noche. El volumen final (0,5 mL) se almacenó a -70 °C hasta la purificación del ARN.
Detección de virus patógenos
Se realizó una extracción del ARN utilizando el kit NucleoSpin RNA Virus (Macherey Nagel®, Alemania) de acuerdo las instrucciones del fabricante, posteriormente 8 µL de ARN se usaron en la síntesis de ADNc con el kit RevertAidTM H Minus Strand cDNA Synthesis con iniciadores de hexámeros aleatorios (Thermo Scientific®, Estados Unidos de Norte América).
Los análisis de presencia/ausencia de virus se realizaron por/con PCR punto final y PCR tiempo real, de acuerdo con lo publicado previamente [16]. Se analizaron 117 muestras por Enterovirus, 117 muestras por virus de la hepatitis A, 72 muestras por Norovirus GI, 72 muestras por Norovirus GII y 79 muestras por Rotavirus Grupo A. Para todos protocolos de amplificación molecular se utilizó el Master Mix 2X (Fermentas®, Estados Unidos) con un volumen final de reacción de 25 µL.
Los PCR de punto final (EV y HAV) se realizaron utilizando el termociclador Applied BioSystem® Veriti 9902 y los productos se visualizaron en un gel de electroforesis de agarosa al 2% teñido con GelRed®, los productos esperados fueron de 113 pb y 266 pb para EV y HAV, respectivamente. La cepa vacunal Sabin 1 (NIBSC 1/528) y la cepa HAX-70, se utilizaron como control positivo de EV y HAV, respectivamente, ambas suministradas por la Sección de Virología de la Facultad de Microbiología de la Universidad de Costa Rica. Los virus RV, NoVGI y NoVGII se determinaron por medio de RT-qPCR utilizando un termociclador StepOne Real-Time PCR (Applied Biosystems®) en el que una muestra se consideró positiva si su Cq fue menor de 35, como control positivo se utilizaron muestras de heces positivas donadas por el Hospital Nacional de Niños. Como control negativo se utilizó agua.
Análisis de datos
El porcentaje de remoción para cada parámetro fisicoquímico y para coliformes fecales se estimó utilizando la siguiente fórmula:
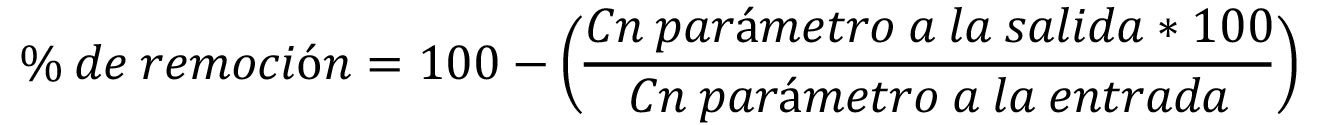
El logaritmo de reducción de coliformes fecales se estimó mediante la siguiente fórmula:
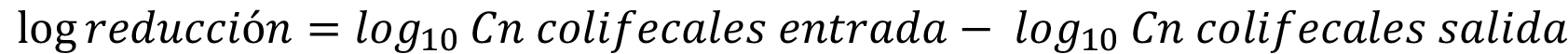
Resultados
Indicadores básicos de rendimiento de la planta
Con respecto a las entradas de aguas residuales en las PTAR los parámetros coliformes fecales, temperatura y, grasas y aceites presentaron valores más altos en la estación seca, mientras que los siete parámetros restantes fueron más altos en estación lluviosa. A pesar de estas diferencias, en promedio, los parámetros fisicoquímicos de los afluentes se presentaron valores dentro de los límites permitidos, con excepción de las sustancias activas al azul de metileno en cuyo caso todos los afluentes se encontraron fuera del valor máximo permisible (Cuadro A1). Por último, la concentración de coliformes fecales en las entradas a las PTAR no está normada en la legislación costarricense; sin embargo, se observa que en estación lluviosa las concentraciones son un poco menores que en estación seca.
Con respecto a las aguas de salida de las PTAR, las cuales vierten directamente en cuerpos receptores, el pH y la temperatura muestran valores más altos en época lluviosa, mientras que el resto de los parámetros analizados presentan valores más altos en época seca. Con respecto a los niveles de descarga, todos los parámetros fisicoquímicos, en promedio, tienen valores dentro de los parámetros establecidos, a diferencia de los coliformes fecales que presentaron valores superiores al máximo permisible (3 log10 NMP/100 mL) para la descarga durante todo el año (cuadro A2).
En relación con el porcentaje de remoción de cada indicador (Figura 2) se observó que los parámetros fisicoquímicos presentan altos porcentajes de remoción entre un 74,5% a un 91,8% independientemente de la estación climática, siendo las sustancias activas al azul de metileno el parámetro que presentó mejor remoción (más de un 90% en las dos épocas climáticas) y las grasas y aceites fue el parámetro fisicoquímico con menor remoción, con un promedio de 74,9%. Por el contrario, la remoción de coliformes fecales fue poco eficiente: 9,6% en estación seca y de 21,7% en época lluviosa.
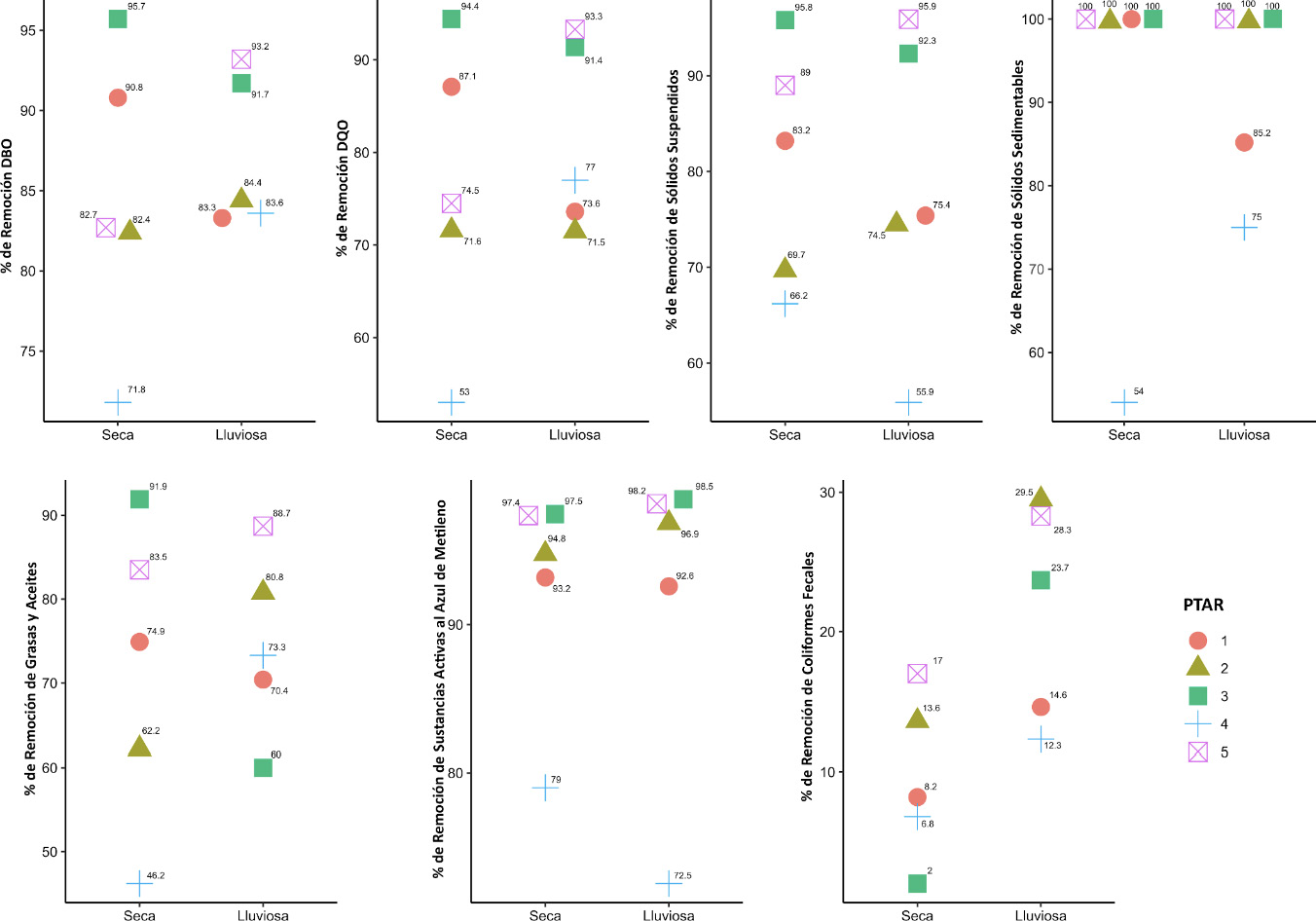
Figura 2. Porcentaje de remoción obtenido para cada uno de los parámetros de control obligatorio incluidos en el Reglamento de Vertido y Reuso de aguas Residuales N°33601-MINAE-S (1), por época climática.
Determinación de la circulación de virus patógenos en aguas residuales
En las entradas a las cinco PTAR, Rotavirus y Norovirus GI fueron los dos virus entéricos de más alta circulación en el año. De acuerdo con la época, Rotavirus fue el virus entérico más frecuente en época seca (13/24 muestras, 54,2%) mientras que en época lluviosa fue Norovirus GI (8/19 muestras, 38,9%). Por otro lado, hepatitis A fue el virus menos detectado a lo largo de este estudio (5/59 muestras, 8,5%). Es importante mencionar que el mayor número de positivos por virus entéricos patógenos se observó en época seca 30% contra un 24% en la época lluviosa (Cuadro 2).
Cuadro 2. Frecuencia de detección de virus entéricos humanos en las entradas de cinco plantas de tratamiento de aguas residuales durante el 2013.
|
PTAR |
Enterovirus |
Virus de Hepatitis A |
Rotavirus |
Norovirus GI |
Norovirus GII |
|||||
|
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
|
|
1 |
2/6 |
2/6 |
0/6 |
1/6 |
3/5 |
0/3 |
0/3 |
2/5 |
0/3 |
1/4 |
|
2 |
1/6 |
1/6 |
0/6 |
0/6 |
2/6 |
1/5 |
3/5 |
1/5 |
2/5 |
2/5 |
|
3 |
2/5 |
1/6 |
0/5 |
0/6 |
3/5 |
1/3 |
3/4 |
3/3 |
1/4 |
2/3 |
|
4 |
2/6 |
0/6 |
1/6 |
0/6 |
1/2 |
1/1 |
1/2 |
0/1 |
2/2 |
0/1 |
|
5 |
2/6 |
0/6 |
0/6 |
3/6 |
4/6 |
3/4 |
1/5 |
1/4 |
0/5 |
0/4 |
|
Total |
9/29 |
4/30 |
1/29 |
4/30 |
13/24 |
6/16 |
8/19 |
7/18 |
5/19 |
5/14 |
ES: Época Seca. EL: Época lluviosa.
En las salidas de las cinco PTAR, la presencia de virus entéricos fue muy homogénea con las siguientes excepciones: Norovirus GI es el de más alta positividad en época seca (7/14, 50%) y época lluviosa (6/20, 30%) y hepatitis A es el de menor positividad (época seca 2/28 7,1% y época lluviosa 1/30 3,3%). El resto de los virus tienen porcentajes de positividad que oscilan entre un 10% y un 30% aproximadamente (Cuadro 3). Con respecto a las entradas de las PTAR la detección de positivos fue de un 30% (36/120) en época seca y 24% (36/108) de la época lluviosa (Cuadro 3).
Cuadro 3. Frecuencia de detección de virus entéricos humanos en las salidas de cinco plantas de tratamiento de aguas residuales durante el 2013.
|
PTAR |
Enterovirus |
Virus de Hepatitis A |
Rotavirus |
Norovirus G1 |
Norovirus G2 |
|||||
|
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
|
|
1 |
2/5 |
1/6 |
1/5 |
1/6 |
1/4 |
2/3 |
1/2 |
0/4 |
1/2 |
0/3 |
|
2 |
0/6 |
0/6 |
0/6 |
0/6 |
3/4 |
3/6 |
0/1 |
3/4 |
0/2 |
1/4 |
|
3 |
2/5 |
2/6 |
1/5 |
0/6 |
1/3 |
0/4 |
4/4 |
1/4 |
1/4 |
0/4 |
|
4 |
1/6 |
2/6 |
0/6 |
0/6 |
0/3 |
2/3 |
0/2 |
2/3 |
0/2 |
1/3 |
|
5 |
3/6 |
0/6 |
0/6 |
0/6 |
3/5 |
1/6 |
2/5 |
0/5 |
0/5 |
0/5 |
|
Total |
8/28 |
5/30 |
2/28 |
1/30 |
5/19 |
7/22 |
7/14 |
6/20 |
2/15 |
2/19 |
ES: Época Seca. EL: Época lluviosa.
Discusión
En este estudio se observó que la calidad del agua a la entrada de las PTAR varía de acuerdo con la época climática del año y que a pesar de ser domiciliares y ubicadas dentro de la Gran Área Metropolitana se reportan variaciones entre sí, por ejemplo, en la PTAR1 se encontró durante época seca valores de DBO y DQO más elevados que el resto de las PTAR, mientras que la PTAR2, ubicada en el mismo cantón, se observó valores más bajos. Con respecto a las salidas, todas las plantas en cualquier época del año presentaron valores por debajo de los máximos establecidos por la legislación costarricense [1], lo cual indica que, a pesar de las variaciones en las cargas de las entradas, las PTARs son muy eficientes en la depuración de compuestos fisicoquímicos y que las aguas descargadas no afectan, en términos generales, el ecosistema acuático del cuerpo receptor.
Por el contrario, la carga microbiana de la entrada de las PTARs, estimada a través de la determinación de coliformes fecales, es muy estable a lo largo del año, teniendo como máximo concentraciones de 7,4 log10 NMP/100 mL en época seca y 6,6 log10 NMP/100 mL en época lluviosa, coincidiendo con el metaanálisis realizado por McMinn et al., que informa concentraciones de coliformes fecales en afluentes entre 6,5 y 7,3 log10/100 mL [17].
En el caso de la concentración de coliformes fecales en las salidas de las PTAR se observa que en ninguna de las muestras analizadas se cumplió con el parámetro establecido por la legislación nacional para la descarga de coliformes fecales (3 log10/100 mL) [1], siendo las concentraciones entre 2 y 3 log (100 a 1000 veces) superiores al límite establecido. Esto provoca que las descargas de aguas residuales contaminen los cuerpos receptores de estas, induciendo la disminución en la calidad del agua y afectando directamente al ecosistema. Por ejemplo se da un aumento neto de materia orgánica en los cuerpos de agua que puede afectar el oxígeno disuelto y la sobrevivencia de ciertos grupos microbianos y el aumento de amonio y cloruros, ambos potencialmente tóxicos. Por último, las descargas de aguas residuales pueden promover procesos de eutrofización, capaces de inducir floraciones de algas y crecimiento de plantas en el ecosistema acuático, lo cual, a su vez, genera cambios en la turbidez del agua, aumentos en la biomasa, incrementos en las tasas de sedimentación y la consecuente disminución en la diversidad de especies residentes en el cuerpo de agua [18], [19].
Adicionalmente, la reducción de estos indicadores durante el proceso de tratamiento debe ser al menos de 3,0 ± 2,1 log10 [17]. Mientras que en este estudio la remoción fue 1,1 ± 0,6 log10, muy por debajo de lo documentado. Los lodos activados en condiciones óptimas logran reducir la carga de microorganismos en 3 logs, por lo cual, la Organización Mundial de la Salud recomienda agregar procesos adicionales de desinfección, como cloración o luz ultravioleta, antes de la descarga a los cuerpos receptores [4], [20]. De acuerdo al último informe de “Evaluación de Eficiencias de los Sistemas de Tratamiento de Aguas Residuales 2021”, los valores de remoción para parámetros fisicoquímicos son superiores al 80% en las plantas incluidas en el estudio, mientras que la remoción en coliformes fecales es nula [21]; lo cual indica que a situación observada en el año 2013 sigue siendo vigente en la actualidad.
Es importante destacar la presencia de virus entéricos en los afluentes de las PTAR durante todo el año, lo cual indica que éstos circulan de forma regular en la población servida. Este comportamiento de virus entéricos es común en países tropicales, donde se ha informado de la circulación anual de rotavirus, norovirus GI y GII, virus de hepatitis A y enterovirus [22]–[26]. Otro aspecto relevante es la mayor circulación de virus en época seca, lo cual coincide con el periodo de mayor número de casos de diarrea en el país [27]–[29], sin embargo es importante considerar que se ha descrito que las detecciones virales dependen en gran medida del volumen de material que ingresa a las PTAR, por lo que la estación lluviosa podría aumentar el caudal y generar una dilución de los microorganismos presentes, por el contrario, en la estación seca, los caudales son menores y facilitan la concentración de patógenos [30].
Por otro lado, en este estudio se detectaron virus entéricos en alrededor del 20% de las muestras analizadas después del tratamiento, independientemente de la época del año. Esta situación es preocupante dado que los virus son muy persistentes en el ambiente, por ejemplo, para disminuir 1 log10 de un enterovirus como polio, en un afluente secundario, como las aguas descargadas por las PTAR en estudio, se requieren al menos 20 días a 15 °C y para remover adenovirus, se requiere 45 días a 15 °C [31], [32]. Esto indica que la descarga de estos virus al ambiente podría implicar un grave peligro para la salud pública, máxime si estas aguas son utilizadas para el riego de vegetales crudos, lo cual ha sido demostrado previamente en la región latinoamericana [16], [33].
Conclusiones
Este estudio demostró una diferencia en la eficiencia de las PTAR para remoción de parámetros fisicoquímicos y microorganismos, siendo muy eficientes para los primeros y poco eficientes para los segundos, situación que por la naturaleza misma de la infraestructura de las PTAR sigue ocurriendo a la fecha. Además, se evidenció la persistencia durante todo un año, de virus entéricos en las aguas residuales tratadas, lo que también demuestra la circulación endémica de estos patógenos en la Gran Área Metropolitana costarricense. En vista de esta situación y del riesgo para la salud pública que implica la descarga de microorganismos potencialmente patógenos en el ambiente, se recomienda implementar estrategias de desinfección adicionales, como cloración o exposición a luz ultravioleta, en los efluentes de las plantas, que permitan minimizar la carga microbiana antes de su descarga a los cuerpos receptores. Es importante mencionar que en los últimos años, las autoridades responsables han iniciado a tomar medidas de contención y se ha fomentado el desarrollo de proyectos de saneamiento en los que se incorporen tratamientos terciarios.
Referencias
[1] Ministerio de Ambiente y Energía (MINAE), Reglamento de vertido y reuso de aguas residuales. Costa Rica, 2007, p. 56. [Online]. Available: http://www.digeca.go.cr/sites/default/files/reglamento_vertido_reuso_aguas_residuales_0.pdf
[2] L. Chacón, L. Reyes, L. Rivera-Montero, and K. Barrantes, “Transport, fate, and bioavailability of emerging pollutants in soil, sediment, and wastewater treatment plants: potential environmental impacts,” in Emerging Contaminants in the Environment, vol. 15, no. 2, Elsevier, 2022, pp. 111–136. doi: 10.1016/B978-0-323-85160-2.00020-2.
[3] L. M. Chacón Jiménez, K. Hall Loría, P. C. Rivera Navarro, L. Reyes Lizano, R. Achí Araya, and K. Barrantes Jiménez, “Circulación de genes de virulencia asociados a Escherichia coli diarrogénica en aguas residuales del Gran Área Metropolitana de Costa Rica,” Población y Salud en Mesoamérica, vol. 19, no. 19, Nov. 2021, doi: 10.15517/psm.v19i2.48037.
[4] World Health Organization, “WHO Guidelines for the safe use of wastewater, excreta and greywater in Agriculture,” WHO Library Cataloguing-in-Publication Data, vol. IV. World Health Organization, Geneva, p. 204, 2006. [Online]. Available: https://www.who.int/water_sanitation_health/publications/gsuweg4/en/
[5] Contraloría General de la República, “Informe acerca de la eficacia del Estado para garantizar la calidad del agua en sus diferentes usos,” Costa Rica, 2013. [Online]. Available: https://cgrfiles.cgr.go.cr/publico/jaguar/sad_docs/2013/DFOE-AE-IF-01-2013.pdf
[6] W. Randazzo, P. Truchado, E. Cuevas-Ferrando, P. Simón, A. Allende, and G. Sánchez, “SARS-CoV-2 RNA in wastewater anticipated COVID-19 occurrence in a low prevalence area,” Water Res., vol. 181, 2020, doi: 10.1016/j.watres.2020.115942.
[7] B. Prevost, F. S. Lucas, A. Goncalves, F. Richard, L. Moulin, and S. Wurtzer, “Large scale survey of enteric viruses in river and waste water underlines the health status of the local population,” Environ. Int., vol. 79, pp. 42–50, 2015, doi: 10.1016/j.envint.2015.03.004.
[8] M. Bisseux et al., “Monitoring human enteric viruses in wastewater and relevance to infections encountered in the clinical setting: A one-year experiment in central France, 2014 to 2015,” Eurosurveillance, vol. 23, no. 7, pp. 1–11, 2018, doi: 10.2807/1560-7917.ES.2018.23.7.17-00237.
[9] U.S. Environmental Protection Agency, “Guidelines for Water Reuse,” U.S. Environmental Protection Agency National Risk Management Research Laboratory U.S. Agency for International Development, no. September. Washington, DC, United States of America, p. 643, 2012. [Online]. Available: https://www3.epa.gov/region1/npdes/merrimackstation/pdfs/ar/AR-1530.pdf
[10] T.-T. Fong and E. K. Lipp, “Enteric Viruses of Humans and Animals in Aquatic Environments: Health Risks, Detection, and Potential Water Quality Assessment Tools,” Microbiol. Mol. Biol. Rev., vol. 69, no. 2, pp. 357–371, Jun. 2005, doi: 10.1128/MMBR.69.2.357-371.2005.
[11] C. N. Haas, J. B. Rose, C. Gerba, and S. Regli, “Risk Assessment of Virus in Drinking Water,” Risk Anal., vol. 13, no. 5, pp. 545–552, Oct. 1993, doi: 10.1111/j.1539-6924.1993.tb00013.x.
[12] F. Ruiz Fallas, “‘Gestión de las Excretas y Aguas Residuales en Costa Rica’ Situación Actual y Perspectiva,” San José, 2012. [Online]. Available: https://www.aya.go.cr/centroDocumetacion/catalogoGeneral/Gestión de las Excretas y Aguas Residuales en Costa Rica Situación Actual y Perspectiva.pdf
[13] L. Zúñiga Zúñiga, E. Alfaro Arrieta, and I. Vega Guzmán, “Informe anual Aguas Residuales: Resultados sobre calidad de aguas residuales en los sistemas de tratamiento operados y asministrados por el AyA, aguas superficiales y estudios especiales,” La Unión, 2019. [Online]. Available: http://dspace-aya.eastus.cloudapp.azure.com:8080/xmlui/handle/aya/375
[14] C. Naughton and O. Rousselot, “Activated Sludge,” in Global Water Pathogen Project, 1st ed., J. Mihelcic and M. Verbyla, Eds. Michigan: Michigan State University, 2017. doi: 10.14321/waterpathogens.62.
[15] (American Public Health Asociation) APHA, (American Water Works Association) AWWA, and (Water Environment Federation) WEF, Standard Methods for the examination of water and wastewater, 21st ed. Washington, DC: American Public Health Association, 2005.
[16] L. Chacón et al., “A Somatic Coliphage Threshold Approach To Improve the Management of Activated Sludge Wastewater Treatment Plant Effluents in Resource-Limited Regions,” Appl. Environ. Microbiol., vol. 86, no. 17, pp. e00616-20, Jun. 2020, doi: 10.1128/AEM.00616-20.
[17] B. R. McMinn, N. J. Ashbolt, and A. Korajkic, “Bacteriophages as indicators of fecal pollution and enteric virus removal,” Lett. Appl. Microbiol., vol. 65, no. 1, pp. 11–26, 2017, doi: 10.1111/lam.12736.
[18] R. Sivaraja and K. Nagarajan, “Levels of Indicator Microorganisms (Total and Fecal Coliforms) in Surface waters of rivers Cauvery and Bhavani for Circuitously predicting the Pollution load and Pathogenic risks,” Int. J. PharmTech Res., vol. 6, no. 2, pp. 455–461, 2014, [Online]. Available: http://sphinxsai.com/2014/PTVOL6/PT=07(455-461)AJ14.pdf
[19] J. N. Edokpayi, J. O. Odiyo, and O. S. Durowoju, “Impact of Wastewater on Surface Water Quality in Developing Countries: A Case Study of South Africa,” in Water Quality, vol. 11, no. tourism, InTech, 2017, p. 13. doi: 10.5772/66561.
[20] T. Ito et al., “Evaluation of virus reduction efficiency in wastewater treatment unit processes as a credit value in the multiplebarrier system for wastewater reclamation and reuse,” J. Water Health, vol. 14, no. 6, pp. 879–889, 2016, doi: 10.2166/wh.2016.096.
[21] I. Vega Guzman, E. Arfaro Arrieta, and C. Mora Aparicio, “Evaluación de la Eficiencia de los Sistemas de Tratamiento de Aguas Residuales 2021,” Pavas, 2022.
[22] T. da Silva Poló et al., “Human norovirus infection in Latin America,” J. Clin. Virol., vol. 78, pp. 111–119, May 2016, doi: 10.1016/j.jcv.2016.03.016.
[23] E. M. Kane, R. M. Turcios, M. L. Arvay, S. Garcia, J. S. Bresee, and R. I. Glass, “The epidemiology of rotavirus diarrhea in Latin America: anticipating rotavirus vaccines,” Rev. Panam. Salud Pública, vol. 16, no. 6, pp. 371–377, 2004, doi: 10.1590/s1020-49892004001200002.
[24] P. Arauz-Ruiz et al., “Presumed Common Source Outbreaks of Hepatitis A in an Endemic Area Confirmed by Limited Sequencing Within the VP1 Region,” J. Med. Virol., vol. 65, pp. 449–456, 2001.
[25] L. E. Zambrana et al., “Etiology of Childhood Diarrhea After Rotavirus Vaccine Introduction,” Pediatr. Infect. Dis. J., vol. 33, no. 11, pp. 1156–1163, 2014, doi: 10.1097/inf.0000000000000427.
[26] L. Bourdett-Stanziola, E. Ortega-Barria, F. Espinoza, F. Bucardo, C. Jimenez, and A. Ferrera, “Rotavirus Genotypes in Costa Rica, Nicaragua, Honduras and the Dominican Republic,” Intervirology, vol. 54, no. 1, pp. 49–52, 2011, doi: 10.1159/000318863.
[27] A. Espinoza, “Comportamiento de la enfermedad diarreica en Costa Rica, de 1995 al 2001,” Rev. Costarric. Salud Pública, vol. 13, no. 24, 2004.
[28] L. Chacón Jiménez et al., “Relación entre la presencia de colifagos en agua para consumo humano, las lluvias y las diarreas agudas en Costa Rica,” Rev. Costarric. Salud Pública, vol. 24, no. 2, pp. 161–168, 2015, [Online]. Available: https://www.scielo.sa.cr/scielo.php?script=sci_abstract&pid=S1409-14292015000200160&lng=en&nrm=iso
[29] L. Chacon, E. Morales, C. Valiente, L. Reyes, and K. Barrantes, “Wastewater-Based Epidemiology of Enteric Viruses and Surveillance of Acute Gastrointestinal Illness Outbreaks in a Resource-Limited Region,” Am. J. Trop. Med. Hyg., no. 1, 2021, doi: 10.4269/ajtmh.21-0050.
[30] N. Sims and B. Kasprzyk-Hordern, “Future perspectives of wastewater-based epidemiology: Monitoring infectious disease spread and resistance to the community level,” Environ. Int., vol. 139, no. March, p. 105689, Jun. 2020, doi: 10.1016/j.envint.2020.105689.
[31] M. Rusiñol and R. Girones, “Summary of Excreted and Waterborne Viruses,” in Global Water Pathogen Project, J. S. Meschke and R. Girones, Eds. Michigan State University, 2019, pp. 3–10. doi: 10.14321/waterpathogens.19.
[32] T. Aw, “Environmental Aspects and Features of Critical Pathogen Groups,” in Global Water Pathogen Project, J. Rose and B. Jiménez-Cisneros, Eds. Michigan State University, 2019, pp. 1–22. doi: 10.14321/waterpathogens.2.
[33] E. M. Symonds, M. E. Verbyla, J. O. Lukasik, R. C. Kafle, M. Breitbart, and J. R. Mihelcic, “A case study of enteric virus removal and insights into the associated risk of water reuse for two wastewater treatment pond systems in Bolivia,” Water Res., vol. 65, pp. 257–270, Nov. 2014, doi: 10.1016/j.watres.2014.07.032.
Anexos
Cuadro A1. Valores y promedio de parámetros obligatorios y coliformes fecales en las entradas de cinco plantas de tratamiento de aguas residuales durante el 2013 según el Reglamento de Vertido y Reuso de aguas Residuales N°33601-MINAE-S.
|
PTAR |
DBO mg/L |
DQO mg/L |
Solidos Suspendidos mg/L |
Solidos Sedimentables mL/L |
Grasas Y Aceites mg/L |
pH |
Temperatura °C |
Sustancias Activas al Azul de Metileno |
C. fecales (log10 NMP/100 mL) |
|||||||||
|
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
|
|
1 |
321,5 |
290,5 |
609,5 |
537,0 |
249,5 |
128,0 |
2,3 |
1,4 |
23,5 |
13,9 |
7,5 |
7,8 |
22,4 |
22,8 |
19,5 |
13,9 |
7,4 |
7,1 |
|
2 |
187,0 |
207,5 |
387,5 |
323,0 |
114,0 |
131,5 |
0,7 |
1,3 |
13,5 |
13,0 |
7,0 |
7,8 |
21,4 |
23,5 |
6,7 |
10,7 |
7,2 |
6,6 |
|
3 |
241,5 |
374,5 |
399,0 |
883,5 |
131,0 |
343,5 |
1,3 |
2,3 |
26,0 |
18,0 |
8,1 |
8,4 |
24,0 |
25,3 |
13,5 |
20,5 |
7,4 |
6,9 |
|
4 |
216,5 |
211,0 |
392, |
313,5 |
251,5 |
122,5 |
2,5 |
2,0 |
17,0 |
15,0 |
7,6 |
7,5 |
26,2 |
27,5 |
21,0 |
16,0 |
7,3 |
6,9 |
|
5 |
202,5 |
329,0 |
402,0 |
687,0 |
109,0 |
241,0 |
2,1 |
1,5 |
20,0 |
23,0 |
7,6 |
8,3 |
26,4 |
25,9 |
16,5 |
18,5 |
7,3 |
6,8 |
|
Promedio |
233,8 |
282,5 |
438,1 |
548,8 |
171,0 |
193,3 |
1,8 |
1,7 |
20,0 |
16,6 |
7,6 |
8,0 |
24,1 |
25,0 |
15,4 |
15,9 |
7,3 |
6,9 |
ES: Época Seca. EL: Época lluviosa. Valores máximos permitidos de descarga: DBO 300 mg/L, DQO5 20 750 mg/L, sólidos suspendidos 300 mg/L, sólidos sedimentables 5 mL/L, grasas y aceites 50 mg/L, pH 6-9, temperatura 15 – 40 °C, sustancias activas al azul de metileno 5 mg/L, coliformes fecales no está normado [1].
Cuadro A2. Valores y promedio de parámetros obligatorios y coliformes fecales en las salidas de cinco plantas de tratamiento de aguas residuales durante el 2013 según el Reglamento de Vertido y Reuso de aguas Residuales N°33601-MINAE-S.
|
PTAR |
DBO mg/L |
DQO mg/L |
Solidos Suspendidos mg/L |
Solidos Sedimentables mL/L |
Grasas Y Aceites mg/L |
pH |
Temperatura °C |
Sustancias Activas al Azul de Metileno |
C. fecales (log10 NMP/100 mL) |
|||||||||
|
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
ES |
EL |
|
|
1 |
29,5 |
48,5 |
78,5 |
141,5 |
42,0 |
31,5 |
0,0 |
0,2 |
5,9 |
4,1 |
6,1 |
7,3 |
22,6 |
22,8 |
1,3 |
1,0 |
6,8 |
6,1 |
|
2 |
33,0 |
33,0 |
110,0 |
92,0 |
34,5 |
33,5 |
0,0 |
0,0 |
5,1 |
2,5 |
7,0 |
6,7 |
21,7 |
24,1 |
0,3 |
0,3 |
6,2 |
4,7 |
|
3 |
10,5 |
31,0 |
22,5 |
76,0 |
5,5 |
26,5 |
0,0 |
0,0 |
2,1 |
7,2 |
3,5 |
7,1 |
12,2 |
24,3 |
0,3 |
0,3 |
7,2 |
5,3 |
|
4 |
61,0 |
34,5 |
184,5 |
72,0 |
85,0 |
54,0 |
1,2 |
0,5 |
9,2 |
4,0 |
7,5 |
7,4 |
25,9 |
27,4 |
4,4 |
4,4 |
6,8 |
6,1 |
|
5 |
35,0 |
22,5 |
102,5 |
46,0 |
12,0 |
10,0 |
0,0 |
0,0 |
3,3 |
2,6 |
7,1 |
7,5 |
26,7 |
26,1 |
0,4 |
0,3 |
6,1 |
4,9 |
|
Promedio |
33,8 |
33,9 |
99,6 |
85,5 |
35,8 |
31,1 |
0,2 |
0,1 |
5,1 |
4,1 |
6,2 |
7,2 |
21,8 |
24,9 |
1,4 |
1,3 |
6,6 |
5,4 |
ES: Época Seca. EL: Época lluviosa. Valores máximos permitidos de descarga: DBO 50 mg/L, DQO5 20 150 mg/L, sólidos suspendidos 50 mg/L, sólidos sedimentables 1 mL/L, grasas y aceites 30 mg/L, pH 5-9, temperatura 15 – 40 °C, sustancias activas al azul de metileno 5 mg/L, coliformes fecales 3 log10 NMP/100 mL [1].
1 Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica. Costa Rica. Correo electrónico: luz.chacon@ucr.ac.cr https://orcid.org/0000-0003-2506-0619
https://orcid.org/0000-0003-2506-0619
2 Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica. Costa Rica. Correo electrónico: eric.morales@ucr.ac.cr https://orcid.org/0000-0001-8090-4947
https://orcid.org/0000-0001-8090-4947
3 Laboratorio Nacional de Agua, Instituto Costarricense de Acueductos y Alcantarillados. Costa Rica. Correo electrónico: ealfaro@aya.go.cr https://orcid.org/0000-0002-1317-446X
https://orcid.org/0000-0002-1317-446X
4 Laboratorio Nacional de Agua, Instituto Costarricense de Acueductos y Alcantarillados. Costa Rica. Correo electrónico: civaliente@gmail.com https://orcid.org/0000-0003-3578-8806
https://orcid.org/0000-0003-3578-8806
5 Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica. Costa Rica. Correo electrónico: lilliana.reyes@ucr.ac.cr https://orcid.org/0000-0002-6722-184X
https://orcid.org/0000-0002-6722-184X
6 Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica. Costa Rica. Correo electrónico: kenia.barrantes@ucr.ac.cr https://orcid.org/0000-0002-2673-9220
https://orcid.org/0000-0002-2673-9220