Artículo de revisión. Ácido úsnico: alternativa potencial contra la resistencia bacteriana actual
Review article. Usnic acid: potential alternative against current bacterial resistance
Sharon Juliet Avila-Zamora1, Yessica Dayana Pinzon-Perez2, Jovanna Acero-Godoy3
Fecha de recepción: 13 de abril, 2022
Fecha de aprobación: 2 de septiembre, 2022
Avila-Zamora, S.J; Pinzon-Perez, Y.D; Acero-Godoy, J. Artículo de revisión. Ácido úsnico: alternativa potencial contra la resistencia bacteriana actual. Tecnología en Marcha. Vol. 36, No 3. Julio-Setiembre, 2023. Pág. 145-157. https://doi.org/10.18845/tm.v36i3.6183
https://doi.org/10.18845/tm.v36i3.6183
Palabras clave
Actividad antimicrobiana; simbiosis; liquen; rutas metabólicas.
Resumen
El ácido úsnico (AU) es una sustancia liquénica, que hace parte de los metabolitos secundarios de los líquenes, los cuales son organismos que generan una simbiosis entre un organismo fotosintético y un micobionte, como ejemplo Usnea sp, producidos por diferentes rutas metabólicas, como es el caso del AU sustancia resultante de la vía del acetato-malonato. Por otro lado, la extracción de AU se realiza por medio de solventes orgánicos, maceración y para su identificación se realiza cromatografía líquida de alta eficiencia (HPCL). Las sustancias liquénicas cuentan con características antimicóticas, antivirales, citotóxicas, antimicrobianas, esta última ha sido estudiada contra bacterias patógenas como Staphylococcus sp., Escherichia coli, Streptoccocus sp., entre otros, por considerarse de prevalencia hospitalaria, debido a que han desarrollado resistencia contra los antibióticos comúnmente usados, generando preocupación; por lo que se buscan nuevas alternativas que permitan seguir combatiendo a estos patógenos, se han investigado los mecanismos de acción utilizados por el AU, entre los que se encuentra, la capacidad de inhibir la síntesis de primers bacterianos evitando su replicación, en la literatura ya se ha confirmado su uso a nivel in vitro contra bacterias multirresistentes como en Staphylococcus aureus MRSA demostrando que el AU presenta una concentración mínima inhibitoria (MIC) de 25–50 μg/mL [1]. El mecanismo de inhibición del AU puede generar detención del crecimiento bacteriano; por medio de mecanismos como inhibición de la replicación (ADN-ARN) además de la inhibición genes de resistencia bacteriana blindando así este posible antibiótico frente a cepas bacterianas resistentes encontradas actualmente.
Keywords
Antimicrobial activity; symbiosis; lichen; metabolic pathways.
Abstract
Usnic acid (AU) is a lichen substance, which is part of the secondary metabolites of lichens, which are organisms that generate a symbiosis between a photosynthetic organism and a mycobiont, such as Usnea sp, produced by different metabolic pathways, such as this is the case of the AU substance resulting from the acetate-malonate pathway. On the other hand, the extraction of UA is carried out by means of organic solvents, maceration and for its identification, high efficiency liquid chromatography (HPCL) is carried out. Lichen substances have antimycotic, antiviral, cytotoxic, and antimicrobial characteristics, the latter has been studied against pathogenic bacteria such as Staphylococcus sp., Escherichia coli, Streptoccocus sp., among others, due to antiquity of hospital prevalence, due to the fact that they have developed resistance against used antibiotics, concern; Therefore, new alternatives are being sought that allow us to continue fighting these pathogens. The mechanisms of action used by UA have been investigated, among which are the ability to inhibit the synthesis of bacterial primers, preventing their replication. has confirmed its in vitro use against multiresistant bacteria such as Staphylococcus aureus MRSA, showing that UA has a minimum inhibitory concentration (MIC) of 25–50 μg/mL [1]. The UA inhibition mechanism can lead to bacterial growth arrest; through mechanisms such as replication inhibition (DNA-RNA) in addition to the inhibition of bacterial resistance genes, thus shielding this possible antibiotic against resistant bacterial strains currently found.
Introducción
Los líquenes son organismos compuestos que se pueden localizar en diferentes partes del mundo, se estima que existe un promedio de 15.000 especies siendo el 8% de la cobertura vegetal de la tierra, podemos encontrar 820 especies de género de Xanthoparmelia, 500 de Cladonia, 350 de Usnea, 10 de Evernia [2]. Los líquenes tiene la capacidad de producir compuestos activos como producto de su metabolismo, estos géneros de líquenes son de importancia por sus características y uso como: antimicóticos, antivirales, antiinflamatorios, analgésicos, antipiréticos, antiproliferativos, citotóxicos, antimicrobianos, siendo esta última reportada desde 1944 [3], [4]. Los líquenes han sido utilizados desde tiempos inmemorables por diferentes culturas como fuente de alimento y medicinas, sin embargo, durante varios años no lograron ser estudiados debido a que por sus características son difícil de cultivar en condiciones de laboratorio, limitando así el aislamiento y determinación de actividades de estos metabolitos, gracias al avance tecnológico hoy se puede identificar y aislar algunos metabolitos como es el caso de AU, el cual es el metabolito liquénico más estudiado caracterizado por su capacidad antibacteriana [5]–[7].
El uso de antibióticos se ha implementado desde los años 1900, con el fin de eliminar o inhibir el crecimiento de las bacterias que afectan la salud, sin embargo, el uso inadecuado o disposición inapropiada de los antibióticos es una de las principales razones para que las bacterias adquieren resistencia, que se puede dar la por la transferencia horizontal de genes, modificación de los sitios objetivo, bombas de eflujo (efflux), producción de enzimas, entre otros; además la mitad de los antibióticos administrados a los seres humanos y los animales se excreta en forma activa sin cambios principalmente a través de la orina y heces fecales llegando a acumularse en todas las matrices ambientales, principalmente agua y suelos [8], [9]. Por ello es necesario implementar sustancias antimicrobianas que provengan de productos naturales, como el AU, que proporcionen nuevos mecanismo de acción contra las bacterias para así combatir la actual problemática de resistencia bacteriana que ha aumentado drásticamente con el paso de los años.
Estructura de los líquenes
Los líquenes son una asociación entre un hongo heterótrofo (micobionte) y un microorganismo fotosintético (fotobionte), esta simbiosis fue descrita por el botánico y liquenólogo suizo Simon Schwendener en 1869 [10], el fotobionte que conforma los líquenes se encuentran formado en el 90% de los casos por algas y en un 10% por cianobacterias, en el caso de las algas está encargado de proporcionar carbohidratos a los hongos, posteriormente, para almacenarlo el micobionte lo transforma en manitol, por la vía de pentosa fosfato, en cambio, las cianobacterias son las responsables de la fijación del nitrógeno y del carbono, participando activamente en el proceso de la fotosíntesis. [11]
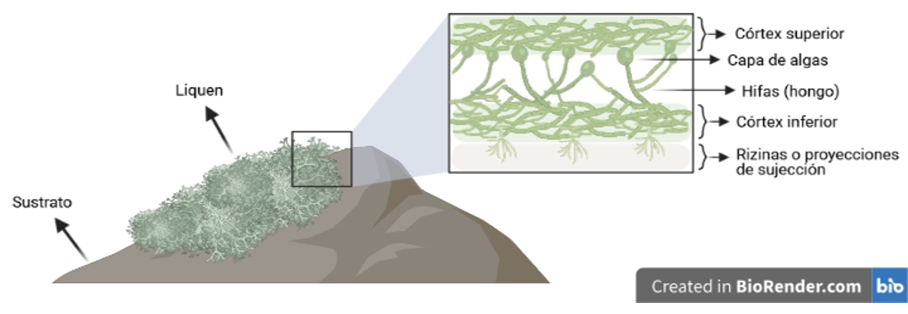
Figura 1. Estructura del talo liquénico.
Los líquenes tienen un aparato vegetativo, también conocido como talo, compuesto por el córtex superior, capa de algas, médula (hifas) y córtex inferior (Figura 1). La médula es hidrófoba, por lo que permite la circulación del aire, dentro de la misma. El talo se puede clasificar según su organización en heterómeros, cuando observan cada una de las capas que lo componen; y homómeros, cuando se encuentran distribuidos de manera uniforme, estos cuentan con la capacidad de absorber más agua y favorecer la fijación del nitrógeno [12]. Por otra parte, los líquenes pueden clasificarse de acuerdo a su forma de crecimiento; la forma foliácea cuenta con cada una de las capas de los líquenes, adicionalmente, tiene rizinas que ayudan en su unión con el sustrato; la crustácea, cuando carece del córtex inferior, por lo que la médula es la que se encuentra en contacto con el sustrato; fruticuloso tiene un solo punto de unión con el sustrato, tienen varias ramificaciones, por lo que pueden ser colgantes o verticales [13].
Para la identificación del género y especie de los líquenes se emplean claves dicotómicas en las que se tienen en cuenta características como el color superficial que presenta el liquen, el tipo de crecimiento que presenta el talo, color de la base, el tipo de ramificaciones, el color de las ramificaciones, el tipo de rizinas, entre otras [14]. Otra parte fundamental que componen los líquenes son los sustratos, que ofrecen como función principal soporte y en algunos casos aportan nutrientes, los sustratos más comunes incluyen rocas, árboles, madera, suelo, exoesqueleto de algunos invertebrados, caparazones de tortugas, entre otros [15]. Las rizinas son un componente fundamental en los líquenes foliáceos que sirven para la fijación al sustrato, pueden ser constituido de hifas prosoplectenquimatosas, integrada por hifas paralelas y radiadas [13].
Ácido úsnico (AU)
El AU (2,6-diacetil-7,9-dihidroxi-8,9b-dimetil-1,3 (2H, 9bH)-dibenzofurandiona) se presenta en dos formas enantioméricas dependiendo de la posición del grupo metilo en el átomo quiral 9b, estas formas se pueden presentar de manera única en una especie liquénica o en algunos casos en ambas formas, esta característica ha revelado diferencias en su actividad biológica y farmacológica, sin embargo en los estudios realizados usualmente no se suele comparar, especificar o caracterizar el enantiómero utilizado, lo cual reduce la información de sus diferencias más específicas; de aquí que algunas características como la propiedad antibiofilm suelen asociarse a (+) - AU, puesto que es el más estudiado, por otra parte podemos ver diferencias entre su actividad antibacteriana como, en donde 6 de las 7 cepas usadas se vio mayor actividad en (+) - AU por el contrario la última cepa presentó el mismo CMI para ambos enantiómeros [16], [17] .
El AU ha sido objeto de varios análisis siendo observado como: parte del extracto de líquenes, como compuesto aislado y sus derivados apuntando en varias ocasiones su capacidad de actividad antimicrobiana contra hongos, parásitos y bacterias. En el caso de las bacterias este ha sido probado contra varias especies como se puede observar en la tabla 1 evidenciado su efecto antibacterial en distintas concentraciones, además, en otros estudios ha demostrado su gran efectividad contra biopelículas. Sin embargo, frente a las múltiples utilidades de AU se encuentra la hepatotoxicidad causada por este durante su administración prolongada y su baja solubilidad en agua delimitando su biodisponibilidad, a causa de esto actualmente el uso de AU se reduce a fármacos tópicos por consiguiente se han evaluado otras formas de aplicación de este metabolito para ser usado en la clínica por medio de derivaciones de AU o emplear nano y microportadores basados en lípidos, poliméricos y no orgánicos, no obstante la evaluación antimicrobiana de estos solo ha sido probada in vitro sin resultados concluyentes debido a variaciones experimentales; se realizó un estudio in vivo en ratones aplicando distintas cantidades de AU, demostrando buena tolerancia sin daño hasta 100 µg/kg en ratones infectados [1], [18], [19].
Ruta metabólica para la formación del AU
Los líquenes producen metabolitos primarios (intracelulares) que incluyen proteínas, aminoácidos, carotenoides, polisacáridos y vitaminas [13] y secundarios (extracelulares), también denominados sustancias liquénicas, de las que se conocen alrededor de 1000 tipos producidas en mayor medida en la médula del liquen, por lo que su origen es fúngico [20], se pueden encontrar en forma de cristales.
Los metabolitos secundarios se producen como respuesta a diferentes factores ambientales: la temperatura, la exposición a luz o radiación ultravioleta; o factores bióticos: competencia con otras plantas, depredación por insectos, mamíferos y demás microorganismos de los que sean fuente de alimentación [20], [21], además, estos metabolitos secundarios le pueden dar características a los líquenes por ejemplo el olor, color y sabor; se conocen tres rutas metabólicas, consideradas las más importantes: la vía del acetato-malonato, del ácido mevalónico y del ácido shikíminico [22].
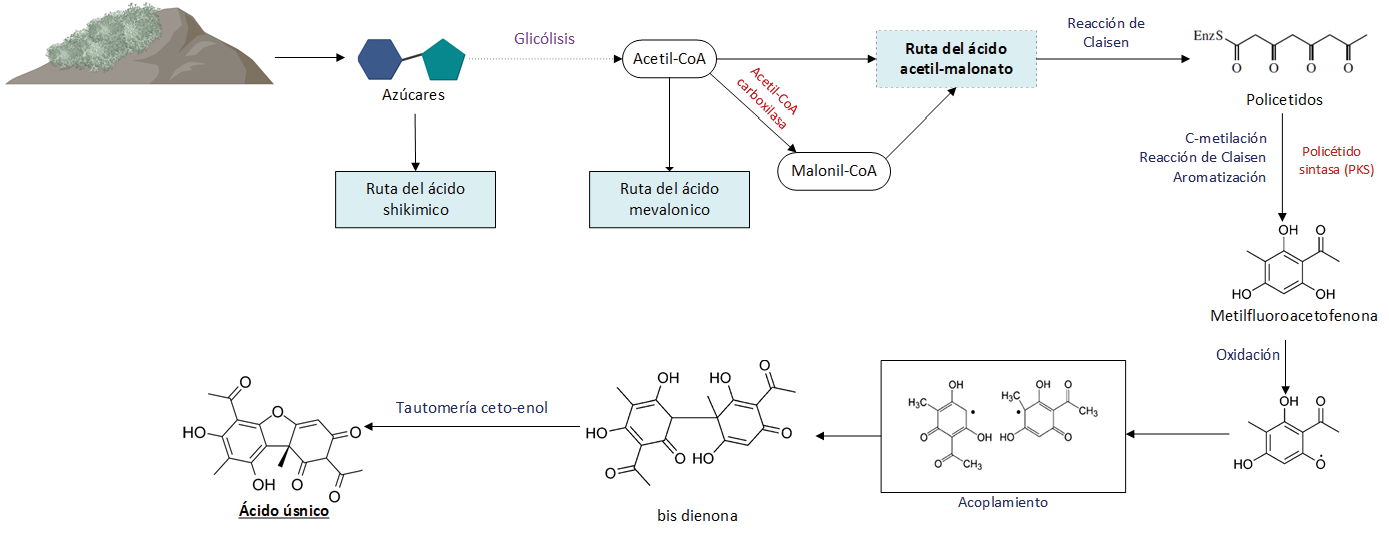
Figura 2. Ruta metabólica del AU.
El AU, es un dibenzofurano que se produce por medio de la vía del acetato-malonato, es la ruta de la que se obtienen una mayor cantidad de metabolitos secundarios y es utilizada por los líquenes cuando su fotobionte está compuesto por algas, se considera parte de la respuesta utilizada por los líquenes al exponerse al estrés oxidativo [4], [23]. La ruta metabólica del acetato-malonato inicia con la obtención de policétidos, por medio de la descarboxilación del malonil CoA y posterior polimerización del acetilo y propionilo, con los policétidos obtenidos se lleva a cabo la reacción de Claisen, metilación y aromatización produciendo metilfluoroacetofenona, que tras el acoplamiento homologo de dos unidades del mismo, da paso al compuesto bis dienona, que tras su tautomería ceto-enol, equilibrio ceto-enólico, forma el AU [21], [24].
Métodos de extracción e identificación de las sustancias liquénicas
Para estudiar las sustancias liquénicas, se debe hacer un aislamiento de las mismas, para ello se pueden emplear diferentes métodos de extracción y solventes orgánicos, ya que según la especie del liquen se obtendrán diferentes sustancias liquénicas, los principales disolventes que se utilizan son la acetona (C3H6O), el etanol (C2H5OH) y el metanol (CH3OH) [25], [6], para ello se toma el liquen, en especial el talo, que es la parte en la que se encuentra una mayor cantidad de la sustancia, representando alrededor del 10% del peso del talo seco [20]. Las sustancias liquénicas denominadas extractos metanólicos, siendo el metanol el solvente utilizado para su extracción, hacen parte de los dépsidos, depsidonas y dibenzofuranos [26].
El procedimiento de extracción inicia con la maceración del liquen, para este proceso es necesario el uso de disolventes, en algunos casos se puede utilizar equipos para la extracción de la sustancia, como lo son el extractor Soxhlet o el rotavapor, los extractos se pueden conservar al disolverse en una pequeña cantidad de dimetilsulfóxido (DMSO) y almacenarlos a 4°C [27]. Para la determinación de las sustancias liquénicas, se utiliza la técnica de cromatografía líquida de alta eficiencia (HPCL), con detectores de espectrofotometría de masas (MS) o ultravioleta (UV), por medio de esta técnica se ha determinado que la especie de Evernia prunastri presenta en mayor cantidad la sustancia liquénica denominada como ácido evernico [28], en Evernia mesomorpha se ha identificado el ácido divaricatico y AU, esta última es la principal sustancia que se encuentre en el género de Usnea spp, en la corteza [29].
Técnicas para el estudio de la actividad antimicrobiana
Por medio del método de difusión en disco o microdilución se evalúa la actividad antimicrobiana de las sustancias liquénicas, por ello se utilizan cultivos bacterianos con una concentración de entre 105 - 108 UFC / mL (unidades formadoras de colonia), equivalente a 0,5 en la escala de McFarland .
En el caso del método de difusión en disco, el agar que se emplea es Mueller Hinton (MH), se utilizan sensidiscos entre 6mm [30] a 8mm [29], como control negativo se puede utilizar la vancomicina, gentamicina, tetraciclina [31] y el dimetilsulfóxido (DMSO) como control positivo; los sensidiscos se impregnan con las sustancias liquénicas, también se puede perforar el agar y depositar el extracto. El resultado se determina por el diámetro del halo de inhibición [32]. Por otro lado, en el ensayo de microdilución, se diluyen las bacterias sembradas en caldo LB (Luria Bertani) para lograr una concentración de 106 UFC, y concentraciones de entre 0,1 a 500 µg/mL distribuidas en la placa que cuenta con 90 pocillos, se incuban a 37°C, con el fin de determinar la concentración mínima inhibitoria (CMI), en µg/mL, por medio de la turbidez de los pocillos [33].
Mecanismos de acción y actividad antimicrobiana del AU
El AU tiene la capacidad de inhibir la síntesis de ADN y ARN de las bacterias, su mecanismo de acción, consiste en su unión con la enzima primasa (DnaG), encargada de la síntesis de las hebras cortas de ARN o también conocidas como primers, necesarias para la replicación del ADN bacteriano, esta enzima es de importancia en la farmacología por presentar un sitio activo para la unión de nucleótidos y un módulo de unión al ADN [34], [35].
También se ha descrito su capacidad de inhibir los genes norA, norB, norC, mepA y mdeA de las bombas de expulsión activa, eflujo o efflux [36], de la que se conocen las superfamilias: ABC (casete de unión al ATP), MFS (superfamilia del facilitador mayor), SMR (resistencia pequeña a multifarmacos), MATE (extrusión de multifarmacos y tóxicos), PACE (eflujo de compuestos antimicrobianos proteobacterianos) y RND (resistencia a división por nodulación) [37].
Se puede observar la actividad antimicrobiana del AU en el cuadro 1, teniendo en cuenta las diferentes especies de líquenes en los que se puede encontrar como metabolito secundario.
La acción antibiótica del AU ha sido señalada en varias ocasiones por su potencial contra bacterias gram positivas con resistencia antibiótica. El género Staphylococcus sp. se suele asociar a esta afirmación, por consiguiente dentro de esta revisión encontramos resultados como los de Moura et al [38] donde en concentraciones bajas de AU de 79.6 µg/mL incluyendo cepas con resistencia antimicrobiana y 250 μg/mL, en contraste con otros estudios donde esta concentración mínima inhibitoria se ve aumentada en cepas no formadoras de biofilm 25-50 μg/mL [1], 21 μg/mL en S. aureus [33], 12.5 μg/mL en S. aureus y S. haemolyticus [46], así mismo encontramos S. epidermidis con 3.12 μg/mL como MIC. Al comparar los resultados con los obtenidos por otras sustancias, como las sustancias liquénicas derivadas de las xantonas, dentro de las que encontramos la esterigmatocistina que suele presentar MIC superior a 100 μg/mL contra S. aureus (MRSA) [48], [49].
Respecto a E. coli, bacilos Gram negativos, se observan valores de MIC de 64 µg/mL y 225 µg/mL, obteniendo mejores resultados en las especies de Usnea sp. (U. filipendula, U. fulvoreagens y U. intermedia) respecto a Evernia prunastri. Estos resultados pueden estar relacionados a la cantidad de AU, que se puede encontrar en cada especie y el solvente utilizado para su extracción, ya que del género Usnea sp. se logra aislar una mayor cantidad del AU, por otro lado, en Evernia sp. este se encuentra en menor cantidad, la sustancia liquénica que predomina es el ácido evérnico [33], [43].
Dentro de las bacterias gram positivas presentes en la literatura encontramos Enterococcus sp. con dos de sus especies más representativas a nivel clínico donde podemos observar resultados similares de MIC en cepas resistentes y susceptibles a antibióticos comúnmente usados, en el caso de E. faecalis obtuvieron un resultado de 9.4 μg/mL tanto en cepas susceptibles como resistentes, aunque en estas últimas se extiende hasta 18.8 μg/mL MIC, sin embargo, en un estudio más reciente el resultado de inhibición del AU aumentó a 50 μg/mL MIC para E. faecalis. Por otro lado, E. faecium en la cepa resistente presentó una concentración inferior a la susceptible con 4.7 μg/mL y 9.4μg/mL según corresponde, se refleja un control de inhibición con ampicilina el cual demuestra mejores resultados a concentraciones de 2 μg/mL [40], [46].
Cuadro 1. Actividad antimicrobiana del AU.
|
Especie liquénica |
Solvente orgánico |
Microorganismo |
Resultados |
Ref. |
|
Cladonia rappii |
Acetona, etanol, cloroformo |
Helicobacter pylori |
0,012-0,026 µg/mL (MIC) |
[17] |
|
Cladonia substellata Vainio |
Éter, cloroformo y acetona. |
Staphylococcus spp |
79.6 µg/mL (MIC) (MBC) |
[38] |
|
Evernia prunastri |
ND |
Staphylococcus aureus |
21 µg/mL (MIC) |
[33] |
|
Pseudomonas aeruginosa |
133 µg/mL (MIC) |
|||
|
Escherichia coli |
225 µg/mL (MIC) |
|||
|
Hexano, éter etílico, cloroformo, acetato de etilo, metanol y agua |
Mycobacterium tuberculosis |
16 µg/mL (MIC) |
[39] |
|
|
El (+)- AU purificado y adquirido de Carl-Roth (Germany) |
ND |
Enterococcus faecium |
9.4 µg/mL (MIC) |
[40] |
|
Enterococcus durans |
37.5 µg/mL (MIC) |
|||
|
El AU purificado y adquirido de Sigma Aldrich, EE. UU. |
Streptococcus mutans |
5 µg/mL (MIC) 10 µg/mL (MBC) |
[41] |
|
|
Streptococcus pyogenes |
16-18 mm (HI) |
[42] |
||
|
Usnea filipendula y Usnea intermedia |
Metanol |
Escherichia coli O157: H7 |
64 µg/mL (MIC) |
[43] |
|
Usnea filipendula, Usnea fulvoreagens y Usnea intermedia |
Escherichia coli E245 |
|||
|
Usnea sp. Usnea sp. |
ND |
Propionibacterium acnes ATCC 6919 |
20–32 mm (HI) |
[44] |
|
Acetona |
Vibrio harveyi |
23.8 mm (HI) |
[45] |
|
|
Usnea steineri |
Staphylococcus epidermidis |
3.12 µg/mL (MIC) 6.25 µg/mL (MBC) |
[46] |
|
|
Staphylococcus aureus |
12.5 µg/mL (MIC) |
|||
|
Staphylococcus haemolyticus |
||||
|
Enterococcus faecalis |
50 µg/mL (MIC) |
|||
|
Mycobacterium avium (ATCC 15769) |
16 μg/mL (MIC) |
[47] |
||
|
Mycobacterium kansasii (ATCC 12478) |
8 μg/mL (MIC) |
|||
|
Mycobacterium tuberculosis (ATCC 27294) |
||||
|
Usnea subfloridana |
Metanol |
Staphylococcus aureus MRSA |
25–50 μg/mL (MIC) |
[1] |
ND: No disponible. MIC: Concentración mínima inhibitoria. MBC: Concentración mínima bactericida. HI: Halo de inhibición
En el caso del género Streptococcus sp. se encuentra dos ensayos con (+)- ácido úsnico de referencia donde se evalúa S. pyogenes y S. mutans, este primero demostró un halo de 16-18 mm con 150 µg/mL en cambio en el segundo podemos observar un MIC de a partir de 5.0 µg/mL actuando como bactericida a partir de 10 µg/mL demostrando mayor efectividad en esta especie, por otro lado en ambos estudios se evaluó la reducción de biopelícula siendo efectivo en ambos casos ya que reduce los ácidos grasos y proteínas en las biopelículas dispersando la adherencia desde bajas concentraciones como 0.25 µg/mL en biopelículas en formacion y 10 µg/mL en biopelículas maduras [41], [42].
El género Mycobacterium sp., divide sus especies entre micobacterias tuberculosas y no tuberculosas (NTM), las primeras pueden causar tuberculosis, las segundas causan enfermedades oportunistas, en personas inmunosuprimidas, de avanzada edad e inmunocompetentes. Se ha descrito el hallazgo de micobacterias en fuentes de agua y suelo; en este caso se puede comparar la actividad antimicrobiana del AU encontrado en las especies liquénicas de U. steineri y E. prunastri frente a M. tuberculosis, con resultados de MIC de 8 μg/mL y 16 μg/mL, respectivamente. De manera análoga, se obtienen resultados del AU contra NTM, como M. avium de 16 μg/mL (MIC) frente al AU de E. prunastri y contra M. kansasii 8 μg/mL (MIC), con AU proveniente de U. steineri [39], [47], [50].
En contraste con lo anterior, encontramos diferentes grupos bacterianos que no han sido estudiados de tal manera que sea posible comparar la efectividad del AU en diferentes especies liquénicas, como es el caso del liquen Cladonia rappii frente a Helicobacter pylori, presentando mejores resultados con el AU, entre 0.012-0.026 µg/mL (MIC), frente al omeprazol 0.046-0.185 µg/mL (MIC). En el caso de Vibrio harveyi, no se observaron valores significativos respecto al control utilizado, con AU fue de 23.8 mm mientras que con cloranfenicol fueron 22.9 mm; similar a los resultados de Propionibacterium acnes 20–32 mm, el control clindamicina con 30 mm (HI) [17], [44], [45].
Conclusiones
Los líquenes son organismos compuestos capaces de producir metabolitos únicos que han demostrado utilidades a nivel médico, sin embargo, se ha visto limitado su uso a causa de falta de ensayos para la evaluación de riesgos y espectro en sus aplicaciones. El AU es un metabolito que actualmente cuentan con protocolos determinación y extracción, se pueden llegar a convertir el AU en un producto industrial, con el cual contar para el avance de nuevas estrategias antibióticas que pueden combatir la actual resistencia bacteriana, igualmente disminuyendo el impacto ambiental causado con antibióticos regulares.
La acción antibacteriana se puede evidenciar en bajas concentraciones de AU con los géneros Gram positivos, además de afectar comúnmente su propiedad de formación de biofilm, así pues, dentro de los resultados podemos encontrar un promedio aproximado de 79.7 µg/mL como CMI encontrándose dentro del rango tolerable para su administración, de modo que es posible su uso como terapia antibiótica, a pesar de esto continúa siendo recomendable el uso de aplicaciones alternativas que mejoren su biodisponibilidad. En pocas palabras, el AU nos puede brindar una opción viable por su variedad de mecanismo de acción a los antibióticos tradicionales, son recomendables más estudios a nivel in vivo para la evaluación de una posible terapia antibacterial con este metabolito.
Referencias
[1] V. K. Gupta et al., «Membrane-damaging potential of natural L-(−)-usnic acid in Staphylococcus aureus», Eur. J. Clin. Microbiol. Infect. Dis., vol. 31, n.o 12, pp. 3375-3383, dic. 2012, doi: 10.1007/s10096-012-1706-7.
[2] R. Lücking, B. P. Hodkinson, y S. D. Leavitt, «The 2016 classification of lichenized fungi in the Ascomycota and Basidiomycota – Approaching one thousand genera», The Bryologist, vol. 119, n.o 4, Art. n.o 4, ene. 2017, doi: 10.1639/0007-2745-119.4.361.
[3] M. Thakur y H. Chander, «Potential of Lichens: A Review of Bioactive Compounds with Biological Activities», p. 10, 2021.
[4] S. Yousuf, M. I. Choudhary, y Atta-ur-Rahman, «Lichens», en Studies in Natural Products Chemistry, vol. 43, Elsevier, 2014, pp. 223-259. doi: 10.1016/B978-0-444-63430-6.00007-2.
[5] W. A. Elkhateeb, G. M. Daba, D. Sheir, T.-D. Nguyen, K. K. Hapuarachchi, y P. W. Thomas, «Mysterious World of Lichens: Highlights on Their History, Applications, and Pharmaceutical Potentials», Nat. Prod. J., vol. 10, ene. 2020, doi: 10.2174/2210315510666200128123237.
[6] R. Sargsyan, A. Gasparyan, G. Tadevosyan, y H. Panosyan, «Antimicrobial and antioxidant potentials of non-cytotoxic extracts of corticolous lichens sampled in Armenia», AMB Express, vol. 11, n.o 1, p. 110, dic. 2021, doi: 10.1186/s13568-021-01271-z.
[7] Devashree, A. Pandey, y A. Dikshit, «Lichens: Fungal symbionts and their secondary metabolites», en New and Future Developments in Microbial Biotechnology and Bioengineering, Elsevier, 2021, pp. 107-115. doi: 10.1016/B978-0-12-821005-5.00007-7.
[8] T. Khare et al., «Exploring Phytochemicals for Combating Antibiotic Resistance in Microbial Pathogens», Front. Pharmacol., vol. 12, p. 720726, jul. 2021, doi: 10.3389/fphar.2021.720726.
[9] D. G. J. Larsson y C.-F. Flach, «Antibiotic resistance in the environment», Nat. Rev. Microbiol., nov. 2021, doi: 10.1038/s41579-021-00649-x.
[10] D. Armaleo et al., «The lichen symbiosis re-viewed through the genomes of Cladonia grayi and its algal partner Asterochloris glomerata», BMC Genomics, vol. 20, n.o 1, Art. n.o 1, dic. 2019, doi: 10.1186/s12864-019-5629-x.
[11] M. Grimm, M. Grube, U. Schiefelbein, D. Zühlke, J. Bernhardt, y K. Riedel, «The Lichens’ Microbiota, Still a Mystery?», Front. Microbiol., vol. 12, p. 623839, mar. 2021, doi: 10.3389/fmicb.2021.623839.
[12] B. Büdel y C. Scheidegger, «Thallus morphology and anatomy», en Lichen Biology, 2.a ed., T. H. Nash, Ed. Cambridge: Cambridge University Press, 2008, pp. 40-68. doi: 10.1017/CBO9780511790478.005.
[13] B. Ranković y M. Kosanić, «Lichens as a Potential Source of Bioactive Secondary Metabolites», en Lichen Secondary Metabolites, B. Ranković, Ed. Cham: Springer International Publishing, 2019, pp. 1-29. doi: 10.1007/978-3-030-16814-8_1.
[14] G. Amo de Paz, A. R. Burgaz, y Editorial Complutense, Líquenes epifíticos del Hayedo de Montejo de la Sierra (Madrid). Madrid: Editorial Complutense, 2009. Accedido: 1 de julio de 2021. [En línea]. Disponible en: http://www.ucm.es/BUCM/editorialucm/36925.php
[15] D. I. V. Flores, «Los líquenes, una alternativa para el control de fitopatógenos», p. 8, 2014.
[16] A. Galanty, P. Paśko, y I. Podolak, «Enantioselective activity of usnic acid: a comprehensive review and future perspectives», Phytochem. Rev., vol. 18, n.o 2, pp. 527-548, abr. 2019, doi: 10.1007/s11101-019-09605-3.
[17] I. M. Walton, J. M. Cox, C. A. Benson, D. (Dan) G. Patel, Y.-S. Chen, y J. B. Benedict, «The role of atropisomers on the photo-reactivity and fatigue of diarylethene-based metal–organic frameworks», New J. Chem., vol. 40, n.o 1, pp. 101-106, 2016, doi: 10.1039/C5NJ01718A.
[18] I. Francolini, A. Piozzi, y G. Donelli, «Usnic Acid: Potential Role in Management of Wound Infections», en Advances in Microbiology, Infectious Diseases and Public Health, vol. 1214, G. Donelli, Ed. Cham: Springer International Publishing, 2018, pp. 31-41. doi: 10.1007/5584_2018_260.
[19] A. Zugic, V. Tadic, y S. Savic, «Nano- and Microcarriers as Drug Delivery Systems for Usnic Acid: Review of Literature», Pharmaceutics, vol. 12, n.o 2, p. 156, feb. 2020, doi: 10.3390/pharmaceutics12020156.
[20] M. J. Calcott, D. F. Ackerley, A. Knight, R. A. Keyzers, y J. G. Owen, «Secondary metabolism in the lichen symbiosis», Chem. Soc. Rev., vol. 47, n.o 5, Art. n.o 5, 2018, doi: 10.1039/C7CS00431A.
[21] M. Goga, J. Elečko, M. Marcinčinová, D. Ručová, M. Bačkorová, y M. Bačkor, «Lichen Metabolites: An Overview of Some Secondary Metabolites and Their Biological Potential», en Bioactive Molecules in Food, J.-M. Mérillon y K. G. Ramawat, Eds. Cham: Springer International Publishing, 2018, pp. 1-36. doi: 10.1007/978-3-319-76887-8_57-1.
[22] Devashree, A. Pandey, y A. Dikshit, «Lichens: Fungal symbionts and their secondary metabolites», en New and Future Developments in Microbial Biotechnology and Bioengineering, Elsevier, 2021, pp. 107-115. doi: 10.1016/B978-0-12-821005-5.00007-7.
[23] Y. Zhao, M. Wang, y B. Xu, «A comprehensive review on secondary metabolites and health-promoting effects of edible lichen», J. Funct. Foods, vol. 80, p. 104283, may 2021, doi: 10.1016/j.jff.2020.104283.
[24] D. C. S. Macedo et al., «Usnic acid: from an ancient lichen derivative to promising biological and nanotechnology applications», Phytochem. Rev., vol. 20, n.o 3, pp. 609-630, jun. 2021, doi: 10.1007/s11101-020-09717-1.
[25] S. Şahin, S. Oran, P. Şahintürk, C. Demir, y Ş. Öztürk, «Ramalina Lichens and Their Major Metabolites as Possible Natural Antioxidant and Antimicrobial Agents», J. Food Biochem., vol. 39, n.o 4, pp. 471-477, ago. 2015, doi: 10.1111/jfbc.12142.
[26] S. S. Charry, «IDENTIFICACION DE LOS METABOLITOS SECUNDARIOS DE LÍQUENES DEL GÉNERO Sticta PROCEDENTES DEL PÁRAMO DE ANAIME (ANAIME- TOLIMA)», p. 94, 2019.
[27] P. S. A. I. Shiromi, R. P. Hewawasam, R. G. U. Jayalal, H. Rathnayake, W. M. D. G. B. Wijayaratne, y D. Wanniarachchi, «Chemical Composition and Antimicrobial Activity of Two Sri Lankan Lichens, Parmotrema rampoddense, and Parmotrema tinctorum against Methicillin-Sensitive and Methicillin-Resistant Staphylococcus aureus», Evid. Based Complement. Alternat. Med., vol. 2021, pp. 1-18, jun. 2021, doi: 10.1155/2021/9985325.
[28] N. Aoussar et al., «Phytochemical Analysis, Cytotoxic, Antioxidant, and Antibacterial Activities of Lichens», Evid. Based Complement. Alternat. Med., vol. 2020, pp. 1-11, dic. 2020, doi: 10.1155/2020/8104538.
[29] J. Oh, Y. Kim, H.-S. Gang, J. Han, H.-H. Ha, y H. Kim, «Antimicrobial Activity of Divaricatic Acid Isolated from the Lichen Evernia mesomorpha against Methicillin-Resistant Staphylococcus aureus», Molecules, vol. 23, n.o 12, p. 3068, nov. 2018, doi: 10.3390/molecules23123068.
[30] P. K. Tr, M. Ar, V. Ks, y D. Sm, «Antimicrobial Activity of Usnea ghattensis G. Awasthi and Usnea undulata Stirt», p. 7, 2016.
[31] L. P. Timbreza, J. L. D. Reyes, y C. H. C. Flores, «Antibacterial activities of the lichen Ramalina and Usnea collected from Mt. Banoi, Batangas and Dahilayan, Bukidnon, against multi-drug resistant (MDR) bacteria», p. 16, 2017.
[32] R. Chauhan y J. Abraham, «In Vitro Antimicrobial Potential of the Lichen Parmotrema sp. Extracts against Various Pathogens», Iran J Basic Med Sci, vol. 16, n.o 7, Art. n.o 7, 2013.
[33] A. Shcherbakova et al., «Antimicrobial and antioxidant activity of Evernia prunastri extracts and their isolates», World J. Microbiol. Biotechnol., vol. 37, n.o 8, p. 129, ago. 2021, doi: 10.1007/s11274-021-03099-y.
[34] K. Victor et al., «Design, synthesis and antimicrobial activity of usnic acid derivatives», MedChemComm, vol. 9, n.o 5, pp. 870-882, 2018, doi: 10.1039/C8MD00076J.
[35] S. Ilic, S. Cohen, M. Singh, B. Tam, A. Dayan, y B. Akabayov, «DnaG Primase—A Target for the Development of Novel Antibacterial Agents», Antibiotics, vol. 7, n.o 3, p. 19, 2018, doi: 10.3390/antibiotics7030072.
[36] S. Sinha et al., «Usnic acid modifies MRSA drug resistance through down‐regulation of proteins involved in peptidoglycan and fatty acid biosynthesis», FEBS Open Bio, vol. 9, n.o 12, pp. 2025-2040, dic. 2019, doi: 10.1002/2211-5463.12650.
[37] D. Du et al., «Multidrug efflux pumps: structure, function and regulation», Nat. Rev. Microbiol., vol. 16, n.o 9, pp. 523-539, sep. 2018, doi: 10.1038/s41579-018-0048-6.
[38] J. B. Moura et al., «In vitro antimicrobial activity of the organic extract of Cladonia substellata Vainio and usnic acid against Staphylococcus spp. obtained from cats and dogs», Pesqui. Veterinária Bras., vol. 37, n.o 4, pp. 368-378, abr. 2017, doi: 10.1590/s0100-736x2017000400011.
[39] M. Barrera Tomas, G. E. Tomas Chota, P. Sheen Cortavarría, P. Fuentes Bonilla, M. A. Inocente Camones, y J. C. Santiago Contreras, «Synthesis of acyl-hydrazone from usnic acid and isoniazid and its anti-Mycobacterium tuberculosis activity», Rev. Colomb. Quím., vol. 46, n.o 3, pp. 17-21, sep. 2017, doi: 10.15446/rev.colomb.quim.v46n3.61980.
[40] R. Kukla et al., «IN VITRO ANTIBACTERIAL ACTIVITY OF USNIC ACID AND OCTYL GALLATE AGAINST RESISTANT ENTEROCOCCUS STRAINS», Mil. Med. Sci. Lett., vol. 83, n.o 3, pp. 104-113, sep. 2014, doi: 10.31482/mmsl.2014.020.
[41] A. Priya, A. Selvaraj, D. Divya, R. Karthik Raja, y S. K. Pandian, «In Vitro and In Vivo Anti-infective Potential of Thymol Against Early Childhood Caries Causing Dual Species Candida albicans and Streptococcus mutans», Front. Pharmacol., vol. 12, p. 760768, nov. 2021, doi: 10.3389/fphar.2021.760768.
[42] P. Nithyanand, R. M. Beema Shafreen, S. Muthamil, y S. Karutha Pandian, «Usnic acid, a lichen secondary metabolite inhibits Group A Streptococcus biofilms», Antonie Van Leeuwenhoek, vol. 107, n.o 1, pp. 263-272, ene. 2015, doi: 10.1007/s10482-014-0324-z.
[43] S. Oran, S. Sahin, P. Sahinturk, S. Ozturk, y C. Demir, «Antioxidant and Antimicrobial Potential, and HPLC Analysis of Stictic and Usnic Acids of Three Usnea Species from Uludag Mountain (Bursa, Turkey)», p. 10, 2016.
[44] L. Fitriani, Afifah, F. Ismed, y A. Bakhtiar, «Hydrogel Formulation of Usnic Acid and Antibacterial Activity Test Against Propionibacterium acne», Sci. Pharm., vol. 87, n.o 1, p. 1, dic. 2018, doi: 10.3390/scipharm87010001.
[45] E. Bachtiar, E. Hermawati, L. D. Juliawaty, y Y. M. Syah, «Antibacterial properties of usnic acid against vibriosis», Res. J. Chem. Environ., p. 3, 2020.
[46] M. G. Tozatti et al., «Activity of the Lichen Usnea steineri and its Major Metabolites against Gram–positive, Multidrug–resistant Bacteria», Nat. Prod. Commun., vol. 11, n.o 4, p. 1934578X1601100, abr. 2016, doi: 10.1177/1934578X1601100419.
[47] Lucarini, Rodrigo et al., «Antimycobacterial activity of Usnea steineri and its major constituent (+)-usnic acid», Afr. J. Biotechnol., vol. 11, n.o 20, mar. 2012, doi: 10.5897/AJB11.3551.
[48] D. R. P. Loureiro et al., «Structures, Activities and Drug-Likeness of Anti-Infective Xanthone Derivatives Isolated from the Marine Environment: A Review», Molecules, vol. 24, n.o 2, p. 243, ene. 2019, doi: 10.3390/molecules24020243.
[49] Resende, Diana I. S. P. et al., «Lichen Xanthones as Models for New Antifungal Agents», Molecules, vol. 23, n.o 2617, 2018, doi: 10.3390/molecules23102617.
[50] A. F. Dávalos et al., «Identification of Nontuberculous Mycobacteria in Drinking Water in Cali, Colombia», Int. J. Environ. Res. Public. Health, vol. 18, n.o 16, p. 8451, ago. 2021, doi: 10.3390/ijerph18168451.
1 Universidad Colegio Mayor de Cundinamarca. Colombia. Correo electrónico: sjavila@unicolmayor.edu.co  https://orcid.org/0000-0002-4345-3793
https://orcid.org/0000-0002-4345-3793
2 Universidad Colegio Mayor de Cundinamarca. Colombia. Correo electrónico: ydpinzon@unicolmayor.edu.co  https://orcid.org/0000-0002-0385-8008
https://orcid.org/0000-0002-0385-8008
3 Universidad Colegio Mayor de Cundinamarca. Colombia. Correo electrónico: jacerog@unicolmayor.edu.co https://orcid.org/0000-0003-1656-6888
https://orcid.org/0000-0003-1656-6888