Germinación in vitro de Calibrachoa thymifolia y Calibrachoa missionica nativas de la Argentina
In vitro germination of Calibrachoa thymifolia and Calibrachoa missionica native to Argentina
Leticia Tombion1, María Andrea Coviella2, María Julia Pannunzio3, María Silvina Soto4, Paula Bologna5
Fecha de recepción: 25 de febrero, 2022
Fecha de aprobación: 23 de junio, 2022
Tombion, L; Coviella, M.A; Pannunzio, M.J; Soto, M.S; Bologna, P. Germinación in vitro de Calibrachoa thymifolia y Calibrachoa missionica nativas de la Argentina. Tecnología en Marcha. Vol. 36, No 3. Julio-Setiembre, 2023. Pág. 127-133. https://doi.org/10.18845/tm.v36i3.6142
https://doi.org/10.18845/tm.v36i3.6142
Palabras clave
Calibrachoa; germinación; in vitro; MS; WPM.
Resumen
Calibrachoa es un género originario de América del Sur que pertenece a la familia Solanaceae. La utilización de semillas de especies de calibrachoa nativas de la Argentina sirve como fuente de variabilidad natural y con fines de investigación, por lo que su germinación in vitro representa una herramienta rápida y confiable frente a otras técnicas de germinación tradicionales. Por ello, en este trabajo se evaluó la germinación in vitro de C. thymifolia y C. missionica bajo los medios de cultivos Murashige y Skoog y Woody plant medium, y se vio que ambos son eficientes para la germinación de estas especies. A su vez, se determinó que, bajo las condiciones de este experimento, C. thymifolia logra germinar una mayor cantidad de semillas en un menor tiempo con respecto a C. missionica.
Keywords
Calibrachoa; germination; in vitro; MS; WPM.
Abstract
Calibrachoa is a genus native to South America wich belongs to the Solanaceae family. The use of seeds of calibrachoa species native to Argentina serves as a source of natural variability and for research purposes, so their in vitro germination represents a fast and reliable tool compared to other traditional germination techniques. Therefore, in this work the in vitro germination of C. thymifolia and C. missionica was evaluated under Murashige and Skoog and Woody plant medium, and it was found that both are efficient for the germination of these species. In turn, it was determined that, under these conditions, C. thymifolia germinates more seeds in a shorter time than C. missionica.
Introducción
Calibrachoa es un género de plantas nativo de Sudamérica perteneciente a la familia Solanaceae Adans, subfamilia Cestroideae Schltdl., tribu Nicotianae G.Don [1]. Abarca 27 especies que se distribuyen desde el Sur de Brasil hasta el Noreste de la Argentina y Uruguay [2]. En la Argentina existen 12 especies nativas de calibrachoa, las cuales son: C. parviflora, C. pygmaea, C. longistyla, C. caesia, C. irgangiana, C. excellens, C. linoides, C. thymifolia, C. missionica, C. humilis, C. pubescens y C. ovalifolia [3]. Estas se pueden encontrar en las llanuras y en los afloramientos rocosos de las regiones subtropicales y templadas del país [1, 2]. Se caracterizan por ser hierbas perennes, menos frecuentemente anuales, o subarbustivas pequeñas, erectas o decumbentes. Poseen tallos cilíndricos de base leñosa, hojas sésiles o subsésiles y flores perfectas, generalmente no aromáticas [4] de una amplia variedad de colores, tales como rosa, violeta, fucsia y amarillo [5]. El lanzamiento de la primera variedad comercial de calibrachoa fue en la década de 1990, por Suntury Ltp (Kanaya et al., 2010) y desde entonces se han registrado numerosos cultivares por diferentes compañías de mejoramiento genético tales como Goldsmith Plants, Ball Flora Plant y Selecta First Class [6]. En la Argentina, el Instituto de Floricultura del Instituto Nacional de Tecnología Agropecuaria (INTA) se dedica actualmente a la domesticación y al mejoramiento genético de calibrachoa con el propósito de obtener, a partir de especies nativas, variedades ornamentales adaptadas a las condiciones del mercado local e internacional, dentro de un marco legal y sustentable del uso de los recursos.
La semilla es un elemento esencial para la supervivencia de las especies [7] y su utilización como fuente de propagación mantiene la variabilidad genética natural, por lo que las plantas obtenidas pueden destinarse a la repoblación de áreas naturales o bien a la investigación [8]. La germinación de semillas se define como un conjunto de procesos metabólicos y morfogenéticos que resultan en la transformación del embrión en una plántula que posteriormente será una planta adulta [7].
El cultivo in vitro constituye una herramienta útil para la germinación de semillas que de otra manera no sería posible [8] y favorece al proceso de mejora porque aumenta la variabilidad y la selección de individuos. Además, ofrece un medio rápido y confiable para la propagación debido a las altas tasas de multiplicación a pesar del reducido material vegetal de partida requerido, lo cual garantiza el establecimiento de plantas ex vitro durante todo el año [9, 10]. Por ello, la germinación in vitro se utiliza con éxito en varias especies y ha demostrado ser superior a otras técnicas, tales como la germinación con papel de filtro o en sustratos [11]. Sin embargo, el éxito de la germinación in vitro depende del medio de cultivo, ya que su composición tiene un rol clave en el desarrollo de las plantas [12] al proporcionar sustancias esenciales para el crecimiento de los explantes. A su vez, la respuesta de crecimiento puede resultar diferente entre los distintos medios que se utilicen. Esta respuesta se basa en la interacción de los explantes con los diferentes componentes minerales y sales, y otros elementos presentes en el medio. Estas diferencias constituyen la razón principal de la búsqueda de alternativas de protocolos basados en ambos medios para determinar las óptimas condiciones in vitro para aquellas especies vegetales que aún no han sido estudiadas [13]. El medio de cultivo utilizado con mayor frecuencia es el Murashige y Skoog (MS) [14], mientras que el Woody plant medium (WPM) [15] ha demostrado también ser un medio útil para el cultivo in vitro [12].
Dado que existe escasa información sobre la germinación de semillas de las especies de calibrachoa nativas de la Argentina, el objetivo de este trabajo fue evaluar la germinación in vitro de C. thymifolia y C. missionica en dos medios de cultivos diferentes (MS y WPM), a modo de que sirva como antecedente para futuras investigaciones.
Materiales y métodos
Material vegetal
Frutos maduros de C. thymifolia y C. missionica fueron colectados de poblaciones naturales del Noreste argentino. Luego fueron llevados al laboratorio donde fueron cortados en forma longitudinal con bisturíes estériles para extraer las semillas. Seguidamente, se realizó su limpieza y posterior almacenamiento en sobres de papel para finalmente almacenarlas a 4º C.
Desinfección de semillas
En primer lugar, las semillas fueron enjuagadas con agua más 500 µL de Tween 20 durante 10 minutos. Posteriormente, fueron inmersas en alcohol 70 % por 1 minuto y transferidas a una solución de hipoclorito de sodio 2,5 % más 500 µL de Tween 20, durante 15 minutos en agitación. Finalmente, se realizaron 3 enjuagues con agua destilada estéril bajo flujo laminar.
Selección de medios de cultivo
Se seleccionaron 2 medios de cultivo: MS y WPM. Se emplearon frascos de vidrio de 55 x 75 mm a los cuales se agregaron 40 mL de medio de cultivo con pH ajustado de 5,6. Posteriormente, fueron esterilizados en autoclave a 121 ºC durante 17 minutos.
Siembra y condiciones de cultivo
Las semillas desinfectadas fueron sembradas en los frascos que contenían los medios de cultivo, bajo flujo laminar. Se sembraron 5 semillas por frasco y, al finalizar la siembra, los recipientes fueron sellados con film plástico e incubados en oscuridad a 24±2 ºC durante 7 días. Luego, los frascos fueron colocados en una cámara de cultivo a 24±2 ºC bajo un fotoperiodo de 16 h y a una intensidad lumínica de 1000 lux.
Transferencia al invernáculo
A los 50 días desde la siembra, las plántulas fueron trasplantadas a macetas de 9 cm de diámetro que contenían sustrato estéril compuesto a base de turba de musgo Sphagnum, compost de corteza fina, perlita y cenizas (tabaco Growmix ®), las cuales fueron cubiertas con bolsas de polietileno transparentes para afrontar el período de adaptación en un invernáculo de aclimatación. Las bolsas fueron retiradas a los 10 días y las plantas fueron llevadas al invernadero de producción.
Variables evaluadas y análisis de datos
Se evaluó la germinación acumulada-en porcentaje-(número de semillas germinadas/total de semillas sembradas) y las mediciones se realizaron cada 10 días hasta los 50 días desde la siembra (dds). Se consideró que las semillas se encontraban germinadas a partir de la aparición de la radícula. A los 60 dds se evaluó la sobrevivencia ex vitro de las plantas (número de plantas que sobrevivieron luego de la aclimatación/total de plantas aclimatadas).
Se utilizó un diseño completamente al azar con dos tratamientos (medios de cultivo) y se realizaron 10 repeticiones para cada especie por cada tratamiento. Los datos obtenidos fueron sometidos a un análisis de varianza mediante el programa Infostat versión 2020 [16].
Resultados y discusión
La germinación in vitro de las semillas de C. thymifolia y de C. missionica se inició a los 10 dds con la presencia de radícula, seguido de un rápido crecimiento y desarrollo de las plantas tanto en MS como en WPM (Figura 1). Investigaciones llevadas a cabo en otras especies también resultaron en una germinación in vitro a los 10 días, como encontraron Martínez-Cruz y otros [17] en semillas de Rubus adenotrichus.

Figura 1. Plántulas de C. missionica a los 15 días desde la siembra en MS (A) y WPM (B).
Realizado el análisis estadístico se observó que no hubo diferencias significativas entre los tratamientos analizados para cada una de las especies de calibrachoa, por lo que el efecto de los medios de cultivo MS y WPM sobre la germinación fue similar. Estos resultados coinciden con los hallados por Urías Valdez [18], quien encontró que las semillas de Lippia palmeri germinaron en cantidades significativamente iguales tanto en MS como en WPM. A su vez, estos óptimos valores coinciden con lo obtenido por Flores García y otros [19], quienes descubrieron una apropiada germinación de Nolina parviflora en MS. Por su parte, Ruíz y otros [8] también lograron una adecuada germinación de semillas de Encyclia adenocaula en este medio de cultivo. Sin embargo, estos hallazgos difieren de los obtenidos por Rodríguez y otros [11] quienes vieron que la germinación in vitro de Ugni molinae en MS se vio afectada, posiblemente, debido a su alto contenido de sales, el cual disminuye el potencial hídrico y provoca una menor disponibilidad de agua para las semillas. También difieren de lo expuesto por Quintero-García y otros [20], que afirman que el medio WPM no tiene la suficiente concentración de nitrógeno para mantener el crecimiento de los embriones y, por tanto, dificulta el proceso de germinación. A diferencia de ello y en concordancia con lo obtenido durante esta investigación, Costa Araruna [13] indica que se han obtenido resultados positivos con el uso de WPM por tener un contenido reducido de macronutrientes.
Por otra parte, los resultados de este trabajo demostraron que, a medida que transcurrió el tiempo (en días), se incrementó la germinación tanto para C. thymifolia como para C. missionica en ambos medios de cultivo (Figuras 2 y 3). Inicialmente, se observó una tendencia exponencial de la germinación en ambos medios de cultivo para las dos especies. Particularmente, en C. thymifolia se observó que la germinación se duplicó a los 20 dds, mientras que en las semillas de C. missionica cultivadas en MS se cuadruplicó y se mantuvo casi constante en WPM. A su vez, se evidenció una diferencia en los tiempos de germinación para cada una de las especies en los distintos medios de cultivo. El 50 % de la germinación de C. thymifolia se dio a los 20 dds, mientras que en C. missionica entre los 40 y los 50 dds. Estas diferencias pueden deberse a que se trata de dos especies distintas, en las cuales el espesor y la composición química de la testa pueden variar e interferir en la permeabilidad del agua en las semillas y, por lo tanto, retrasar la germinación, tal como alegaron Rodríguez-Ruíz y otros [21] en semillas de cactáceas, lo cual pudo haber sucedido en el caso de C. missionica.
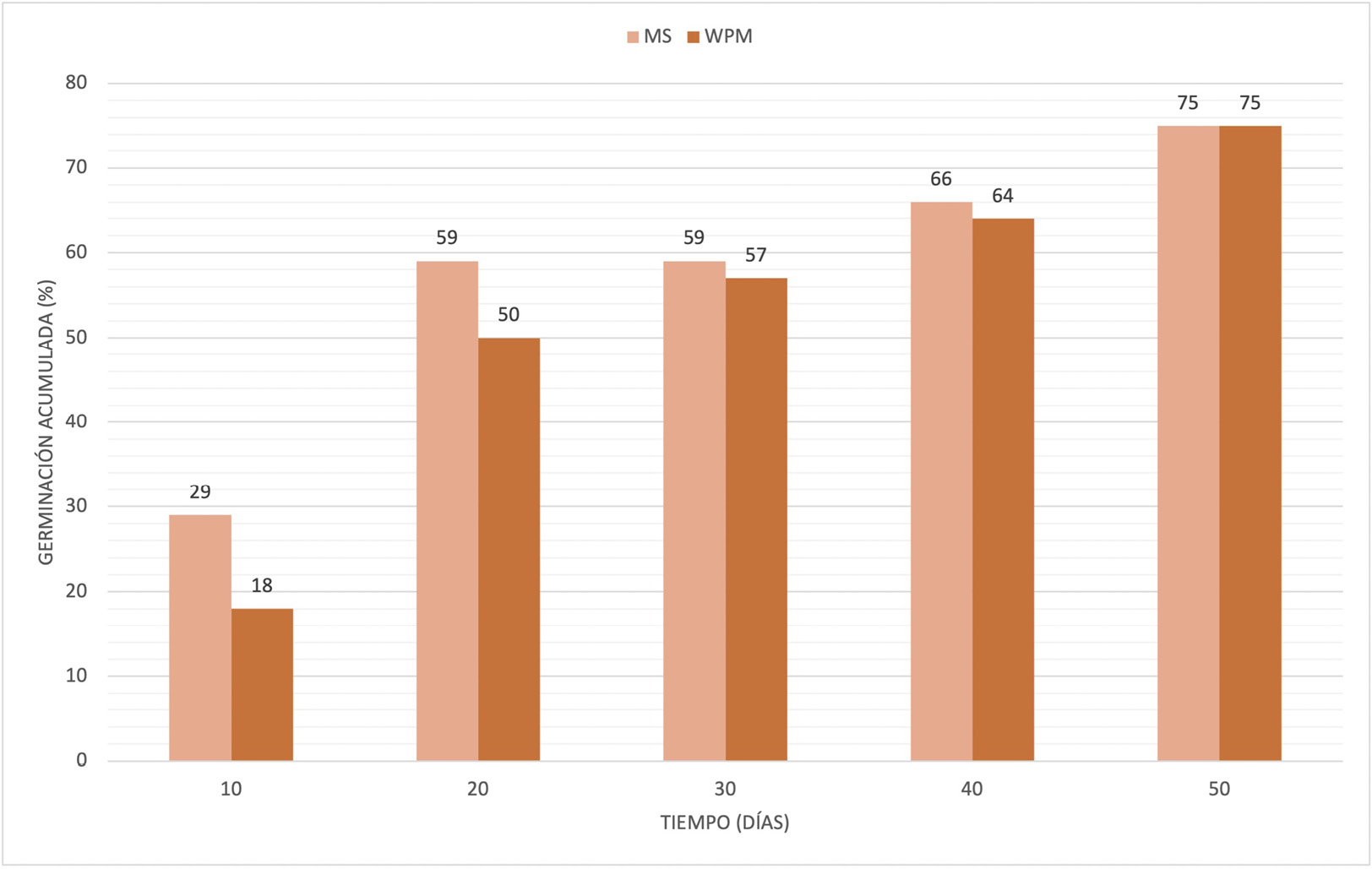
Figura 2. Germinación de C. thymifolia en los tratamientos MS y WPM en función del tiempo (días).
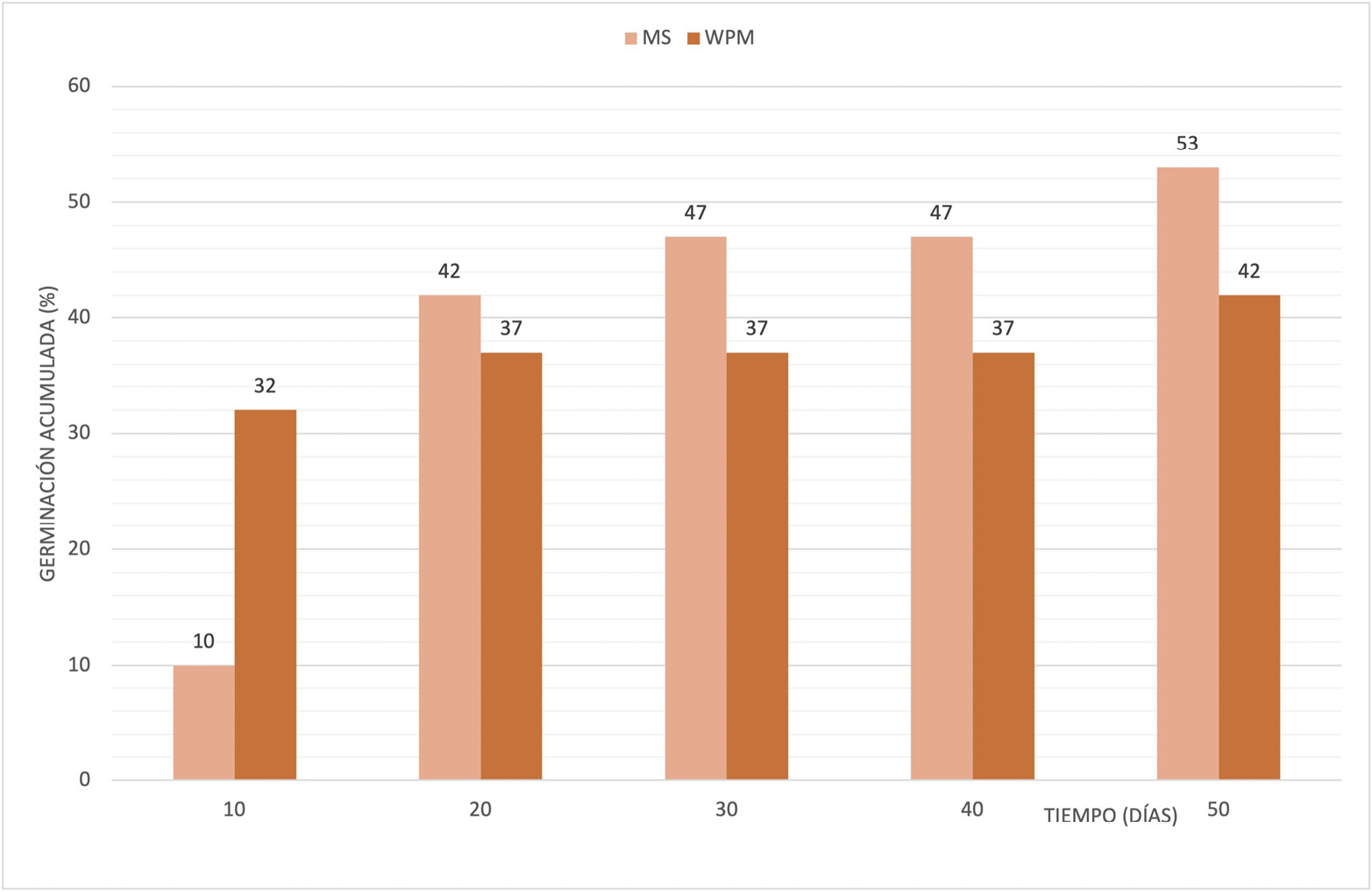
Figura 3. Germinación de C. missionica en los tratamientos MS y WPM en función del tiempo (días).
Finalmente, las plantas regeneradas mediante la germinación de semillas in vitro fueron aclimatadas con éxito en condiciones de invernadero, ya que su sobrevivencia ex vitro fue de casi el 100 %.
Conclusión
Bajo las condiciones de este experimento, tanto el medio MS como WPM son adecuados para la germinación in vitro de C. thymifolia y C. missionica. A su vez, ante estas circunstancias, las especies demostraron una diferencia en tiempos de germinación, puesto que C. thymifolia resulta la especie que logra germinar una mayor cantidad de semillas en un menor tiempo. Estos conocimientos sirven de apoyo como paso previo a futuros estudios de mejoramiento genético. Hasta donde se sabe, este es el primer informe de germinación in vitro de especies silvestres de Calibrachoa nativas de la Argentina.
Referencias
[1] ALW. John, G. Mäder, JN. Fregonezi, L. Freitas. “Genetic diversity and population structure of naturally rare Calibrachoa species with small distribution in southern Brazil”. Gen. Mol. Biol., vol 42, no. 1, pp. 108-119, 2010.
[2] G. Mäder, LB Freitas. “Biogeographical, ecological and phylogenetic analyses clarifying the evolutionary history of Calibrachoa in South American grasslands”. Mol. Phylogenet. Evol., vol. 141, pp. 1-10, 2019.
[3] JA. Greppi, JC. Hagiwara, R. Stehmann R.“Las especies argentinas de Calibrachoa (Solanaceae)”. XXXIV Jornadas Argentinas de Botánica. La Plata, Buenos Aires, Argentina, 2013.
[4] Anónimo (marzo, 2018), Flora Argentina [Online]. Disponible en: http://www.floraargentina.edu.ar/
[5] JA. Greppi, JC. Hagiwara, R. Stehmann R. “Novedades en Calibrachoa (Solanaceae) y notas taxonómicas sobre el género para la Argentina”. Darwiniana, vol. 1, no. 1, 2013.
[6] MS. Soto, JC. Hagiwara, MJ. Pannunzio, S. Stancanelli, G. Facciuto. “Evaluación de clones selectos del género Calibrachoa para su uso en cantero”. IV Congreso argentino de Floricultura y plantas ornamentales, p. 143. Corrientes, Argentina: Ediciones INTA.
[7] JR. Méndez Natera, JF. Merazo Pinto, NJ. Montaño Mata. “Relación entre la tasa de imbibición y el porcentaje de germinación en semillas de maíz (Zea mays L.), caraota (Phaseoulus vulgaris L.) y quinchoncho (Cajanum cajan L. Mill.). Rev. UDO Agríc., vol 8, no. 1, pp. 61-66, 2008.
[8] BC. Ruíz, CA. Laguna, ALG Iglesias, A. Damon, HTNJ. Marín, RHS. Azpíroz, MJL. Moreno. “Germinación in vitro de semillas de Encyclia adenocaula (La Llave & Lex.) Schltr (Orchidaceae)”. Rev. Inter. Bot. Exp., vol. 77, pp. 203-215, 2008.
[9] Y. García-Ramírez, M. Freire-Seijo, M. Tejeda, M. Reyes. “Germinación in vitro de semillas de Dendrocalamus strictus (Rosb.) Nees”. Biot. Veg., vol. 7, no. 1, pp. 41-44, 2007.
[10] HJ. du Plessis, R. Vassileva, R. Kleynhans, BA. Egan. “In vitro seed germination and seedling performance of Hibiscus coddii subsp. Barnardii”. Ornam. Hortic., vol. 26 no. 4, 2020.
[11] M. Rodríguez, M. Chacón, R. Carrillo. “Efecto de la concentración y de los componentes del medio de cultivo MS sobre la germinación in vitro de Ugni molinae”. Bosque, vol. 35, no. 1, pp. 119-122, 2014.
[12] B. Valizadehkaji , A. Ershadi, M. Tohidfar . “In vitro propagation of two Iranian commercial pomegranates (Punica granatum L.) cvs. ‘Malas Saveh’ and ‘Yusef Khani’”. Physiol. Mol. Biol. Plants, vol. 19, no. 4, pp. 597-603, 2014.
[13] E. Costa Araruna, JP. Riveiro-Oliveira, VJ. Pereira, SA. Asmar, B. De melo. “Salt concentrations in culture media for the development of Dipteryx alata in vitro” Pesq. Agropec. Bras., vol. 52, no. 12, pp. 1295-1300, 2017.
[14] T. Murashige, F. Skoog. “A revised medium for rapid growth and bioassays with tobacco tissue cultures”. Physiol. Plant., vol. 15, pp. 473-497, 1962.
[15] G. Lloyd, B. McCown. “Commercially feasible micropropagation of mountain laurel Kalmia latifolia, by use of shoot-tip culture”. Int. Plant Prop. Soc. Comb. Proc., vol. 30, pp.421-427, 1980.
[16] Di Rienzo, J. A., F. Casanoves, M. G. Balzarini, L. Gonzalez, M. Tablada. Grupo Infostat. Facultad de Ciencias Agrarias, Universidad Nacional de Córdoba, Argentina, 2020.
[17] NS. Martínez-Cruz, K. Arévalo-Niño, MJ. Verde-Star, A. Oranday-Cárdenas, C. Rivas-Morales, J. Treviño-Neávez, ME. Morales-Rubio. “Germinación in vitro e inducción de callo en Rubus adenotrichus Schltdl”. Polibot., vol. 35, pp. 99-107, 2013.
[18] J. Urías Valdez. “Propagación de Lippia palmeri Watson por cultivo de tejidos”. Trabajo final presentado para acceder al título de Licenciado en Biología. Departamento de investigaciones científicas y tecnológicas. Universidad de Sonora, Sonora, México, 2014.
[19] A. Flores-García, JGA. Moctezuma, JL. Rodríguez, A. Corona Ambris. “Germinación in vitro de semillas de Nolina parviflora (H.B.K.) Hemsl.” Forest. Veracruz., vol. 10, no. 2, pp. 27-33, 2008.
[20] OD. Quintero-García, S. Jaramillo-Villegas. “Rescate y germinacion in vitro de embriones inmaduros de cedro negro (Juglans neotropica Diels).” Acta Agron., vol. 61, no. 1, pp. 52-60, 2012.
[21] ER. Rodríguez-Ruíz, WA. Poot, JA. Rangel-Lucio, HV. Huerta, OJG. Gaona, JT. Carreón. “Germinación in vitro de Biznaga cabuchera”. Rev. Mex. Cienc. Agríc., vol. 9, no. 3, pp. 691-699, 2018.
1 Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Floricultura, Buenos Aires, Argentina.
Correo electrónico: le.tombion@gmail.com
2 Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Floricultura, Buenos Aires, Argentina. https://orcid.org/0000-0003-1281-0660
https://orcid.org/0000-0003-1281-0660
3 Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Floricultura, Buenos Aires, Argentina. https://orcid.org/0000-0003-1328-6784
https://orcid.org/0000-0003-1328-6784
4 Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Floricultura, Buenos Aires, Argentina. https://orcid.org/0000-0002-0407-9567
https://orcid.org/0000-0002-0407-9567
5 Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Floricultura, Buenos Aires, Argentina. https://orcid.org/0000-0003-0603-2970
https://orcid.org/0000-0003-0603-2970