Desarrollo y validación de un método para la determinación de nitrito en productos cárnicos mediante cromatografía iónica
Development and validation of a method for the determination of nitrite in meat products by ion chromatography
Priscilla Rojas-Alvarado1, Laura Vindas-Angulo2
Fecha de recepción: 17 de mayo, 2022
Fecha de aprobación: 29 de agosto, 2022
Rojas-Alvarado, O; Vindas-Angulo, L. Desarrollo y validación de un método para la determinación de nitrito en productos cárnicos mediante cromatografía iónica. Tecnología en Marcha. Vol. 36, No 3. Julio-Setiembre, 2023. Pág. 87-98. https://doi.org/10.18845/tm.v36i3.6136
https://doi.org/10.18845/tm.v36i3.6136
Palabras clave
Nitrito, salchichón criollo, validación, cromatografía iónica.
Resumen
El nitrito de sodio se ha usado como preservante en los embutidos desde el siglo XIX debido a sus excelentes efectos inhibidores contra los microorganismos patógenos. Sin embargo, de acuerdo con diversos estudios, se encontró que cantidades elevadas de nitrito de sodio (mayores a 125 ppm) puede ser peligroso para los consumidores, debido a que se podrían formar nitrosaminas (carcinógenos). Por este motivo, el análisis para la determinación del contenido de nitrito de sodio en embutidos es sumamente importante. El objetivo principal de esta investigación fue el desarrollo y validación de un método para la determinación de nitritos en salchichón criollo que se comercializa en carnicerías en la región de Occidente, mediante una metodología por cromatografía de iones. La validación del método para la determinación de nitrito en salchichón criollo mediante cromatografía de iones presentó parámetros de desempeño aceptables. En cuanto a la linealidad se obtuvieron tres curvas de calibración con R2 ≥ 0,995. El análisis de residuales y la prueba de homocedasticidad mostraron que el método tiene una buena linealidad. La precisión del método también fue aceptable (CV: 1,68 % para la repetibilidad y un CV: 1,01 % para la reproducibilidad). Con respecto a la veracidad, se obtuvo un sesgo relativo de 4,31 %. En relación con la selectividad, se confirmó la identidad del analito y se obtuvo un límite de detección de 0,0003 ppm y un límite de cuantificación de 0,001 ppm. En relación con el estudio comparativo entre el método desarrollado y el método oficial, se evidencia que no hay diferencia significativa entre ambos. En conclusión, el método desarrollado aporta resultados igual de fidedignos que el método oficial.
Keywords
Nitrite, creole sausage, validation, ion chromatography.
Abstract
Sodium nitrite has been used as a preservative in sausages since the 19th century due to its excellent inhibitory effects against pathogenic microorganisms. However, according to several studies, it was found that high amounts of sodium nitrite (greater than 125 ppm) can be dangerous for consumers, because nitrosamines (carcinogens) could be formed. For this reason, the analysis for the determination of the content of sodium nitrite in sausages is extremely important. The main objective of this research was the development and validation of a method for the determination of nitrites in sausage that are sold in butcher shops in the Western region, using an ion chromatography methodology. The validation of the method for the determination of nitrite in Creole sausage by ion chromatography presented acceptable performance parameters. Regarding linearity, three calibration curves with R2 ≥ 0.995 will be acquired. Residual analysis and homoscedasticity test showed that the method has good linearity. The precision of the method was also acceptable (CV: 1.68% for repeatability and a CV: 1.01% for reproducibility). Regarding truthfulness, a relative bias of 4.31% was obtained. Regarding selectivity, the identity of the analyte was established and a detection limit of 0.0003 ppm and a quantification limit of 0.001 ppm were obtained. In relation to the comparative study between the developed method and the official method, it is evident that there is no significant difference between the two. In conclusion, the developed method provides the same reliable results as the official method.
Introducción
Los nitritos se han utilizado como aditivos para la preservación de productos cárnicos desde el siglo XIX. Su uso inició cuando se observó que sales como el nitrato de potasio (KNO3), el nitrato de sodio (NaNO3) y el nitrito de sodio (NaNO2) presentaban mejores efectos preservantes que la sal común (NaCl) [1]. Los nitritos tienen efectos inhibidores contra microorganismos patógenos, estabilizan el color rojo de los pigmentos naturales de la carne, retrasan la rancidez, contribuyen con el desarrollo del sabor e inhiben la descomposición anaeróbica y la proliferación de microorganismos patógenos [2], [3].
A pesar de los beneficios que tienen los nitritos como preservantes, se ha presentado una gran discusión con respecto a su uso, debido a que se demostró que el uso de este aditivo forma compuestos de alta peligrosidad para la salud de las personas, como la formación de nitrosaminas y la incidencia de metahemoglobinemia [3], [4].Esto llevó a regular la adición de nitrito de sodio usado como preservante, en distintos países. Generalmente, la cantidad permitida de nitritos se encuentra en el rango de concentraciones de 120-150 mg/kg [5].
En la actualidad, según el Código de Reglamentos Federales de Estados Unidos de América [6], el contenido de nitrito de sodio en embutidos no debe exceder de 200 mg/kg [6]. En Costa Rica se permite una concentración máxima de 125 mg/kg [7].
Debido al impacto en la salud que ha tenido la adición de nitritos en los embutidos, es necesario determinar su contenido en estos alimentos, por lo que se han desarrollado una gran variedad de técnicas analíticas. El método oficial para la cuantificación de nitritos en embutidos es el de la AOAC 973.31 [8]; utiliza espectroscopía ultravioleta visible, donde la adición de los reactivos generadores de color implica un mayor tiempo de procesamiento de las muestras; además el impacto en la salud ocupacional en el analista [2]., mientras que por cromatografía iónica se evita este paso y se tiene mejor sensibilidad al ser un método cromatográfico. Con base en lo expuesto, el objetivo de esta investigación fue desarrollar y validar un método para la determinación de nitritos en dos productos cárnicos, salchichón y chicharrón de carne, mediante cromatografía iónica.
Materiales y métodos
Reactivos y equipos utilizados
Se utilizó nitrito de sodio grado analítico (99,99%) marca Sigma Aldrich como estándar. Para la fase móvil se utilizaron bicarbonato de sodio (99,50%) y carbonato de sodio (99,50%) marca Sigma Aldrich y el flujo de esta fue de 1 ml/min. El cromatógrafo de iones utilizado fue el Dionex ICS 5000 marca Thermo Fisher, donde se utilizó una columna Dionex IonPac™ AS23 RFIC™ 4 X 250 mm, el volumen de inyección fue de 1µL, el supresor utilizado fue ASRS™ 300 de 4 mm P/N 064554 y se utilizó un detector de conductividad.
Recolección y manejo de muestras
Se analizaron muestras de salchichón criollo; al ser elaborado de manera criolla este puede ser de carne vacuna o de mezclas de carne de cerdo, pollo y carne vacuna; en general no indicaban el tipo de carne en las etiquetas, las muestras fueron adquiridas en carnicerías en las que se elaboran o comercializan estos productos en la zona de Occidente en Costa Rica. Las muestras se guardaron en refrigeración, protegidas de la luz para evitar su descomposición.
Tratamiento de las muestras
Se tomó como referencia la preparación de la muestra según indica el método de la AOAC 973.31 [8], con modificaciones. La primera, se pesaron 50.00 g de muestra en balanza analítica, la segunda modificación constó en que después de aforar el balón se centrifugó durante 20 minutos y se filtra para la toma de alícuota con pipeta aforada de 20,00 mL. Por último, se omite la adición de los reactivos sulfanilamida y el reactivo de NED, para evitar la aparición de color.
Determinación de nitrito mediante la técnica de Cromatografía iónica
Se utilizó como referencia el procedimiento de las autoras López, Viera y Urbano [9], este método consiste en el desarrollo de un método para el análisis de nitrito, nitrato y cloruro de sodio en carnes frescas curadas de pollo, res y cerdo por medio de la técnica de cromatografía de iones, mientras que en el presente estudio se determinó nitrito de sodio en salchichón criollo y chicharrón de carne.
Para la preparación de la curva de calibración se tomó como referencia la preparación de las disoluciones estándar indicadas en el método oficial [8]. Se preparó una disolución madre de nitrito de sodio de concentración 500 ppm, luego una disolución de trabajo (50 ppm), y con ésta se prepararon siete soluciones estándar en un rango de concentraciones de 1,00 ppm - 7,00 ppm.
Validación de la metodología para la determinación de nitrito
La validación del método se llevó a cabo según los lineamientos establecidos en las guías del Ente Costarricense de Acreditación (ECA): ECA-MC-PO01 y ECA-MC-PO01-G01 [10]. Debido a que se trata de un método no normalizado, se evaluaron los siguientes parámetros de desempeño:
Ámbito de trabajo
Se midió el área en función de la concentración de analito para dos curvas de calibración, de siete patrones cada curva. La primera curva se realizó con bajas concentraciones (4,00 – 9,00 ppm) y la segunda con altas concentraciones (13,00 – 18,00 ppm). Los R2 se determinaron en Excel.
Linealidad
Se obtuvieron tres curvas de calibración independientes para medir la linealidad del método, con tres repeticiones en cada punto y el siguiente análisis de los datos por Excel: regresión en las curvas de calibración, de los residuales y una prueba de homocedasticidad con el test de Cochran.
Precisión
Para esta se evaluó la repetibilidad y la precisión intermedia.
•Repetibilidad: se seleccionaron dos patrones de la curva de calibración correspondiente a 3,00 ppm y 5,00 ppm. Se prepararon 10 repeticiones de cada patrón y se determinó la desviación estándar (DS) por Excel.
•Precisión intermedia: se seleccionaron dos patrones de la curva de calibración correspondiente a 3,00 ppm y 5,00 ppm. Se prepararon 10 repeticiones de cada patrón, una cada día diferente y se determinó la DS por Excel.
Ambos parámetros se llevaron a cabo bajo condiciones de T 25°C y H% 70%, en el laboratorio de química del Recinto de Grecia de la Universidad de Costa Rica.
Límite de detección
Se hicieron 10 medidas replicadas de blancos fortificados a concentraciones de 0,3 ppm; 0,5 ppm y 0,9 ppm. Se calculó la DS y el límite de detección (LOD) por Excel. De acuerdo con criterio de la guía Eurachem donde indica: Para LMP ≥ 0,1 ppm un LD ≤ 1/10 LMP [11].
Límite de cuantificación
Se hicieron 10 medidas replicadas de blancos fortificados a concentraciones de 0,3 ppm; 0,5 ppm y 0,9 ppm. Se calculó la DS y el límite de cuantificación (LOQ) por Excel. De acuerdo con criterio de la guía Eurachem donde indica: Para LMP ≥ 0,1 ppm un LQ ≤ 1/5 LMP [11].
Veracidad
Se midió el material de referencia (MR) el estándar de nitrito de sodio utilizando el método propuesto [11]. Se comparó el valor promedio obtenido, con el valor de referencia xref para el MR. Se calculó el sesgo, el sesgo relativo en porcentaje, y la recuperación relativa en porcentaje
Selectividad
En el cromatograma se verificó que la señal observada correspondía al ion nitrito. Se analizaron diez muestras de ensayo por el método propuesto y el método oficial. Con los resultados, se hizo un análisis de varianza de un factor (ANOVA), pruebas F y pruebas T por Minitab 2019, para determinar si el método propuesto brindaba resultados igual de fidedignos que el método oficial.
Robustez
Se llevó a cabo el test de robustez de Youden y Steiner. En esta prueba, se estudiaron seis variables: temperatura de digestión, tiempo de digestión, flujo de fase móvil, tiempo de centrifugado, degradación de la muestra y temperatura del detector.
Incertidumbre
Se analizaron los componentes relacionados en el análisis, por ejemplo, la medición de masa, el uso de balones y pipetas. Se calculó la incertidumbre de todos los componentes relacionados con el análisis.
Comparación de los métodos para la determinación de nitrito de sodio
Para la comparación de resultados entre el método oficial y el de cromatografía de iones, se llevó a cabo el análisis de diez réplicas de una misma muestra, mediante las dos metodologías mencionadas. Con los resultados obtenidos, se hicieron diferentes pruebas estadísticas de significancia, se hizo uso de pruebas estadísticas para el análisis de errores sistemáticos como prueba F, comparación de dos medias experimentales y el análisis de varianza (ANOVA). Las pruebas se hicieron con ayuda de programas estadísticos como MINITAB 18 y Microsoft Excel Plus 2016.
Resultados y Discusión
Validación del método
Cuando se desarrolla un nuevo método para la determinación de un analito, este debe validarse para comprobar la calidad de los datos [10], [12] y [13]. El alcance de la validación depende del tipo de método por validar, en este caso se cuenta con un método no normalizado (situación 3). Por lo tanto, se validaron los siguientes parámetros de desempeño: ámbito de trabajo, linealidad, precisión, veracidad, selectividad, límite de detección, límite de cuantificación, incertidumbre y robustez [10].
El ámbito de trabajo se determinó a partir de siete patrones de nitrito con concentraciones entre 1,00 ppm – 7,00 ppm, presentando un comportamiento lineal adecuado con R2 ≥ 0,995 y mayor sensibilidad. Seguidamente, se evaluó el parámetro de desempeño de la linealidad. En la Figura 1a se observan las curvas de calibración obtenidas por triplicado; donde cada patrón se preparó por triplicado. Para el sistema en el rango de concentraciones establecido y se muestran las ecuaciones de las rectas obtenidas; las cuales no presentan grandes diferencias entre sí, con un coeficiente de correlación adecuado (R2 ≥ 0,995).
(a) 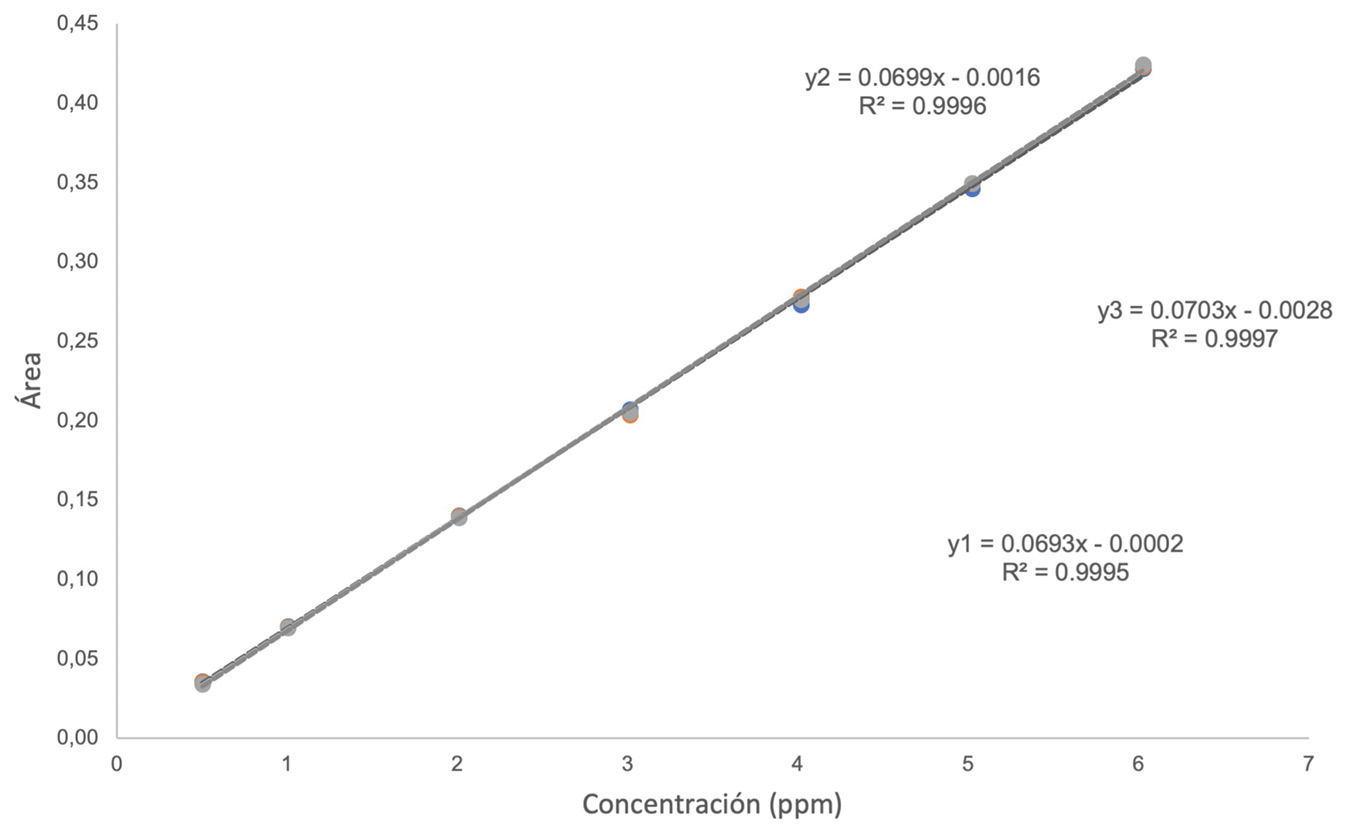
(b) 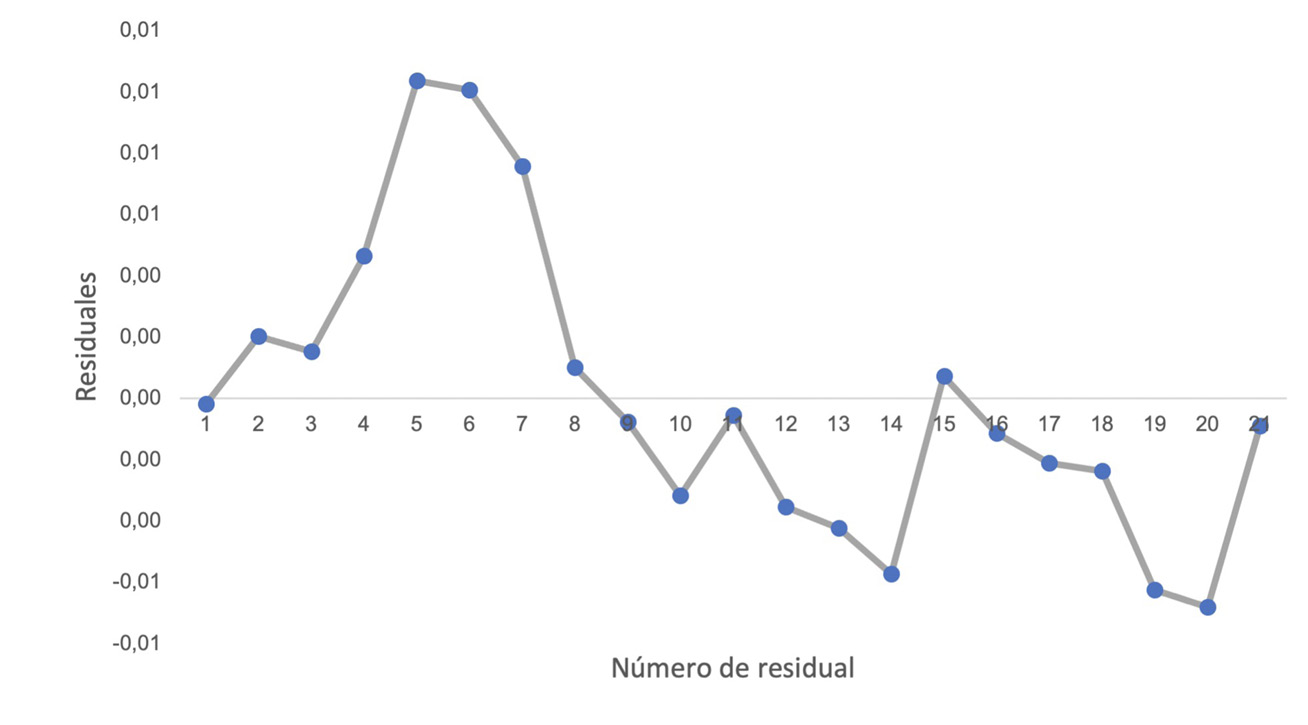
Figura 1. Parámetro de desempeño de linealidad (a), Superposición de curvas de calibración para comprobar linealidad del sistema (b). Análisis de residuales de las curvas de calibración.
Se realizó un análisis de los residuos correspondientes a la validación de la linealidad del sistema (Figura 1b). El comportamiento aleatorio de los datos indica que existe linealidad [14]. Además, se evaluó la homocedasticidad, para comprobar la linealidad del método. La estimación se llevó a cabo mediante el test de Cochran, por medio de la ecuación 1, donde s2max y s2i representan la varianza máxima y la varianza obtenida de cada patrón.
 (1)
(1)
Al calcular el valor C, este se compara con los valores críticos establecidos para la prueba de Cochran. Para la homocedasticidad del sistema, se obtuvo un valor C de 0,35; menor que el valor crítico 0,8534 Esto demuestra que las varianzas son iguales [15] y [16]. en las tres curvas preparadas; es decir, que existe un comportamiento homocedástico.
En relación con el parámetro de desempeño de la precisión, se determinó la repetibilidad y la precisión intermedia del método. Como se observa en la Cuadro 1, el coeficiente de variación (CV) obtenido en ambos parámetros cumple con el criterio de aceptación, por lo tanto, se evidencia que el método cuenta con una precisión óptima. En cuanto a la veracidad (Cuadro 1), se observa que el valor obtenido para el sesgo relativo fue de 4,31 %; cumple con el criterio de aceptación e indica que este brinda resultados exactos y confiables.
Cuadro 1. Parámetros de desempeño del método de análisis de nitrito en salchichón criollo y chicharrón de carne por cromatografía de iones.
|
Parámetro de desempeño |
Resultado |
Criterio de aceptación |
|
Ámbito de trabajo |
1,0– 7,00 ppm R2: 0,9998 |
R2 ≥ 0,995 |
|
Linealidad |
R2C1= 0,9998 R2C2= 0,9999 R2C3= 0,9998 |
R2 ≥ 0,995 |
|
Repetibilidad Desviación estándar Coeficiente de variación |
0,05 CV: 1,68% |
CV≤ 3 |
|
Reproducibilidad Desviación estándar Coeficiente de variación |
0,05 CV: 1,01% |
CV≤ 6 |
|
Veracidad Sesgo relativo % de recuperación |
4,31 % 104,31% |
Sesgo relativo <10% |
|
Selectividad |
Se confirma que el pico es de nitrito. |
Confirmación de la identidad del analito. |
|
Límite de detección |
0,0003 ppm |
Para LMP ≥ 0,1 ppm un LD ≤ 1/10 LMP. |
|
Límite de cuantificación |
0,001 ppm |
Para LMP ≥ 0,1 ppm un LQ ≤ 1/5 LMP. |
|
Incertidumbre |
0,5 ppm(1) |
(1): Incertidumbre máxima obtenida.
En cuanto al parámetro de desempeño de selectividad, se verificó que el pico obtenido en el cromatograma correspondiera al ion nitrito, de acuerdo con su tiempo de retención. Además, se realizaron otras pruebas estadísticas para evaluar la selectividad, detalladas en la sección Comparación de métodos.
En el Cuadro 1 se muestran los valores para los límites de detección y cuantificación. El valor del límite de detección representa el nivel de señal en el que se puede encontrar el analito sin confundirlo con el ruido instrumental. El límite de cuantificación indica el nivel al cual la precisión de la medida permite una determinación adecuada [13]. Se observa que ambos límites cumplen con los criterios de aceptación. La incertidumbre de medición se determinó considerando todos los componentes relacionados en el análisis, la incertidumbre dio un valor de 0,5 ppm (Cuadro 1).
Finalmente, se evaluaron seis variables críticas del método en desarrollo, para verificar si el método es robusto: temperatura de digestión, tiempo de digestión, flujo de la fase móvil, tiempo del centrifugado, tiempo de degradación de la muestra y temperatura del detector. En el Cuadro 2, se listan los factores que podrían afectar el método. Como se muestra, los factores críticos son la temperatura de digestión y el tiempo de digestión, pues se relacionan directamente con la extracción de nitrito de la muestra. Si se modifican estas variables, el método no sería adecuado para la cuantificación del analito.
El flujo de la fase móvil y el tiempo de degradación de la muestra no se incluyeron en el Cuadro 2, debido a que, al modificar estos factores, no se pudo medir adecuadamente el analito. Al cambiar el flujo de la fase móvil, el ion cloruro opaca al ion nitrito y no se logró observar adecuadamente el pico cromatográfico del nitrito. Con respecto al tiempo de degradación de la muestra, la degradación del ion nitrito no permitió el registró de su pico cromatográfico.
El tiempo de centrifugado y la temperatura del detector no afectaron al método de análisis (Cuadro 2). Sin embargo, de acuerdo con los factores analizados, se indica que el método no es robusto, debido a que el método es susceptible a cambios como la temperatura de digestión y el tiempo de digestión.
Cuadro 2. Resultados de la prueba de robustez del método cromatográfico.
|
Factor |
Valor de la condición de la variable |
Análisis |
Resultado |
Diferencia |
Criterio |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Promedio x |
Promedio y |
|
|||
|
Temperatura digestión |
A 100°C, a 80°C |
A |
A |
A |
A |
a |
a |
a |
a |
66,72 |
53,24 |
13,48 |
Afecta |
|
Tiempo digestión |
B 2 h, b 1 h |
B |
B |
B |
B |
b |
b |
b |
b |
30,92 |
23,91 |
7,01 |
Afecta |
|
Tiempo de centrifugado |
D 30 min, d 10 min |
D |
D |
D |
D |
d |
d |
d |
d |
33,15 |
35,41 |
-2,26 |
No afecta |
|
Temperatura del detector |
F 35°C, f 20°C |
F |
F |
F |
F |
f |
f |
f |
f |
61,06 |
66,20 |
-5,14 |
No afecta |
|
Factor |
Resultado de mediciones |
s |
t |
u |
v |
w |
x |
y |
z |
||||
|
Criterio |
Si la diferencia es mayor o igual a |
||||||||||||
Comparación de métodos
Cuando se desarrolla un método nuevo para la determinación de un analito; en este caso de nitrito, el método debe validarse [10] y [12]. Mediante diferentes parámetros de desempeño como los descritos anteriormente. Uno de los más determinantes es comparar los resultados obtenidos por el método desarrollado con los adquiridos mediante el método oficial. Para identificar errores sistemáticos, es decir, evaluar si el método por desarrollar proporciona resultados significativamente más altos o bajos que el procedimiento oficial [12]. Los resultados arrojados para ambos métodos se muestran en el Cuadro 3.
Cuadro 3. Resultados de las concentraciones obtenidas por el método desarrollado y el método oficial.
|
Resultados de las muestras de salchichón por los métodos: Cromatografía de Iones y el Espectrofotométrico UV-Vis |
|||
|
Muestra |
Masa (g) |
Concentración obtenida (ppm) por método CI |
Concentración obtenida (ppm) por método UV-Vis |
|
1 |
50.0011 |
38.4526 |
42.7496 |
|
2 |
50.0003 |
37.9290 |
47.5322 |
|
3 |
50.0013 |
38.1641 |
42.7495 |
|
4 |
50.0000 |
38.3748 |
41.7942 |
|
5 |
50.0009 |
38.0596 |
41.7934 |
|
6 |
50.0009 |
38.0858 |
45.6189 |
|
7 |
50.0026 |
37.5079 |
36.0540 |
|
8 |
50.0014 |
37.6136 |
35.0985 |
|
9 |
50.0015 |
36.5389 |
32.2293 |
|
10 |
50.0005 |
37.1949 |
30.3172 |
Con los resultados mostrados en el Cuadro 3, se llevó a cabo el contraste F para la comparación de las desviaciones estándar de los dos conjuntos de datos obtenidos por de cromatografía de iones (CI) y mediante el método oficial de la AOAC 973.31, por espectroscopia ultravioleta visible (UV). Se realizó el contraste de dos colas para establecer si las desviaciones estándar difieren en su precisión [12]. La hipótesis nula (H0) establece que los dos métodos tienen varianzas iguales (H0: θ1 = θ 2). Como se observa en el Cuadro 4 el valor crítico de F para dos colas es mayor que el F obtenido, H0 no se rechaza, asumiéndose que las varianzas son iguales.
Para la comparación de medias experimentales, se tomó como hipótesis nula (H0) que los dos métodos proporcionan el mismo resultado suponiendo que las varianzas son iguales (H0: μ1= μ2). Es decir, se prueba si existen diferencias significativas entre los promedios obtenidos por ambos métodos [17].
Como se observa en el Cuadro 4 el valor crítico de t para dos colas es mayor que el t obtenido. Además, en el Cuadro 4 puede verse que el valor p obtenido es mayor que el nivel de significancia (α = 0,05). Por lo tanto, la hipótesis nula H0 no se rechaza [12] y [17], pues no existe diferencia significativa entre los resultados proporcionados por ambos métodos, indicando que el método desarrollado en este estudio proporciona resultados igual de fidedignos que el método oficial.
Cuadro 4. Pruebas estadísticas para la comparación de los métodos analíticos en muestras de salchichón criollo.
|
Prueba estadística |
Valor calculado |
Valor crítico |
|
Prueba F(1) |
0.010 |
4.026 |
|
Prueba t(2) |
0.34079 |
2.10 |
Prueba F para varianzas de dos muestras de salchichón criollo. Prueba t para dos muestras de salchichón criollo suponiendo varianzas iguales
Finalmente, se hizo un análisis de varianza de un factor (ANOVA) para contrastar si el contenido de nitrito en la muestra de salchichón criollo presenta diferencias significativas al analizarse mediante CI y mediante UV. En el Cuadro 5 se observa que el valor p obtenido en el ANOVA, es mayor que el nivel de significancia (α = 0.05). Es decir, que las medias obtenidas por ambos métodos de análisis no presentan diferencias significativas.
Cuadro 5. Análisis de varianza de un factor para la comparación de muestras de salchichón criollo.
|
Fuente |
GL (1) |
SC Sec (2) |
SC Aj. (3) |
MC Aj. (4) |
Valor F |
Valor p |
|
Métodos |
1 |
16,23 |
16,23 |
16,23 |
0,96 |
0,341 |
|
Error |
18 |
305,08 |
305,08 |
16,95 |
||
|
Total |
19 |
321,31 |
(1): Grados de libertad. (2): Suma de cuadrados. (3): Suma de cuadrados ajustado. (4): Media de cuadrados ajustado.
En relación con los residuos para ANOVA de un solo factor, se elaboraron cuatro gráficas para observar su comportamiento. En la Figura 2a se muestra el gráfico de probabilidad normal, que permite verificar el supuesto de que los residuos están distribuidos de forma normal [17] y [18]. En este caso los residuos se mantienen describiendo una línea recta y no se muestran patrones de distribución que indiquen que no están distribuidos normalmente, por lo tanto, no hay evidencia de no normalidad.
En cuanto a la gráfica de residuo vs. ajustes (Figura 2b), se observa que los puntos se ubican, de manera aleatoria, a ambos lados del cero y no se encuentran patrones detectables en los puntos. Es decir, que los residuos se distribuyen aleatoriamente y tienen una varianza constante [17]. Para la gráfica de residuos vs. orden (Figura 2d), empleada para verificar el supuesto de que los residuos son independientes entre sí, al ubicarse de manera aleatoria alrededor de la línea central, sin seguir tendencias ni patrones cuando se muestran en orden cronológico [17] y [18]. Se observa que los residuos se distribuyen aleatoriamente alrededor de la línea central y no hay evidencia de que no sean independientes.
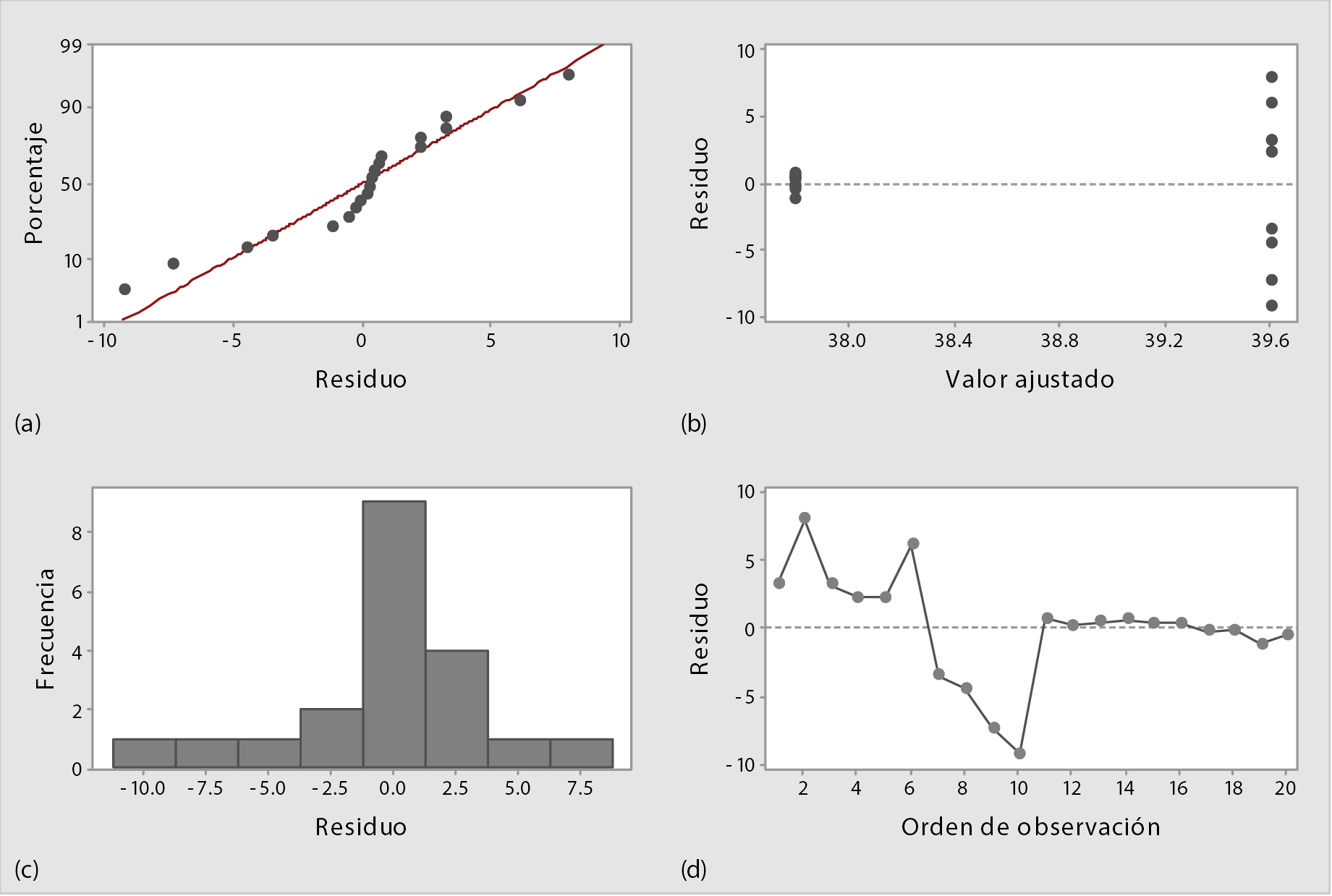
Figura 2. Gráficas de residuos para ANOVA de un solo factor en muestras de salchichón criollo. (a) Grafica de probabilidad normal. (b) vs. Ajustes. (c) Histograma. (d) vs. Orden. Fuente: elaboración propia mediante Minitab 2019.
Conclusiones
En cuanto al ámbito lineal se determinó que el método presentó una mejor linealidad en el rango de concentraciones de 1,0 – 7,0 ppm, con valores de coeficientes de correlación ≥ 0,995. El análisis de los residuos y la evaluación de la homocedasticidad, demuestran que el método presenta una linealidad adecuada. Con respecto a la precisión y la veracidad del método, el coeficiente de variación y el sesgo obtenido cumplen con el criterio de aceptación, es decir que el método aporta resultados precisos, exactos y fidedignos. El estudio estadístico comparativo entre el método desarrollado y el método oficial para determinar nitrito demuestra que no hay diferencia significativa entre ambos. Esto indica que el método desarrollado aporta resultados igual de fidedignos y confiables que el método oficial.
Agradecimientos
Las autoras agradecen al laboratorio de química del Recinto de Grecia, Universidad de Costa Rica, por permitir el desarrollo del proyecto código 540-B8-049 “Desarrollo de un método para el análisis de nitritos en dos productos cárnicos: el salchichón y el chicharrón de carne de consumo nacional en la región de Occidente mediante la técnica de cromatografía de iones”.
Referencias
[1] K. Honikel. “The use and control of nitrate and nitrite for the processing of meat products”. Meat Science, vol. 78, pp. 68–76, 2008.
[2] J. Rodríguez, É, Vargas y M. Gómez. “Procesos Industriales: manual de laboratorio para el análisis químico y control de calidad”. Heredia, Costa Rica: Editorial Universidad Nacional (EUNA). (2009)
[3] C. Ruíz, A. Herrero y F. Jiménez. “Determination of Nitrates and Nitrites,” en Flow Injection Analysis of Food Additivies, 1st ed, New York: Taylor & Francis Group, LLC, 2016, pp. 135-152.
[4] M. Selbes. “The Effects Of Amine Structure, Chloramine Species and Oxidation Strategies On The Formation Of N-Nitrosodimethylamine” (Tesis Doctoral). Clemson University, Estados Unidos, 2014.
[5] Handbook of Food Analysis Two Volume Set, 3rd ed., 2015, pp. 289-299.
[6] U.S. Food & Drug. (FDA). Food and Drugs Chapter I-Food and Drug Administration Department of Health and Human Services (Title 21, Volume 21), 2016.
[7] Ministerio de Economía, Industria y Comercio (MEIC), El Ministerio de Agricultura y Ganadería (MAG) y el Ministerio de Salud. Decreto N.º 35079-MEIC-MAG-S. Productos cárnicos embutidos: salchicha, salchichón, mortadela y chorizo. Especificaciones, 2009.
[8] Association of Official Agricultural Chemists (AOAC). Official methods of analysis of AOAC International, 2016.
[9] C. López, I. Viera y A. Urbano. “Development and validation of an ionic chromatography method for the determination of nitrate, nitrite and chloride in meat”. Food Chemistry, vol. (194), pp. 687-694, 2016.
[10] Ente Costarricense de Acreditación (ECA). GUÍA PARA LA VALIDACIÓN DE MÉTODOS. Código Nº: ECA-MCPO01-G01. Versión Nº 3, 2014
[11] Guía Eurachem: La adecuación al uso de los métodos analíticos – Una Guía de laboratorio para la validación de métodos y temas relacionados, 2016.
[12] J. Miller y J. Miller. Estadística para química analítica. 4ta ed, Madrid: Pearson Educación. S. A, 2002.
[13] S. Vargas y C. Herrera, C. “Contenido de Nitrito de Sodio y Bases Volátiles Nitrogenadas Totales en el Salchichón Producido por Empresas Embutidoras Nacionales”, Ingeniería y Ciencia Química, vol. 20 (1), pp. 17-23, 2002.
[14] E. Pérez y A. Rojas, “Validación de un método para cuantificación de acetaminofén en tabletas de 500mg por espectrofotometría ultravioleta para la prueba de uniformidad de contenido” en Revista Intersedes. vol. 17 (35), 2016.
[15] P. Martel y J. Díez, J. Probabilidad y estadística en medicina: aplicaciones en la práctica clínica y en la gestión̤ sanitaria. 1era ed, Madrid: Díaz de Santos, 1997.
[16] C. Mongay. Quimiometría. 1era ed, Valencia: Universitad de Valencia, 2005.
[17] Minitab. Minitab reference manual: Macintosh versión, release 8. State College, PA: Minitab, 2019.
[18] L. Vindas, N, Rodríguez y Y. Araya. “Influencia de las características químicas y el tiempo de almacenamiento en el contenido de nitrito de sodio en salchichas elaboradas industrialmente”. RECyT, vol. 21(31), pp. 36-41, 2019.
1 Docente. Costa Rica. Correo electrónico: pri0208@hotmail.com
2 Universidad de Costa Rica. Costa Rica.
Correo electrónico: laura.vindasangulo@ucr.ac.cr https://orcid.org/0000-0002-1399-9293
https://orcid.org/0000-0002-1399-9293


 , el factor afecta el método.
, el factor afecta el método.