Evaluación de la variación en la concentración de aldehídos en agua de lluvia y aire: caso de estudio en un área de conservación de Costa Rica
Quantitative assessment of aldehydes in air and rainwater: a case study in natural conservation area of Costa Rica
Melissa Araya-Araya1, José Pablo Sibaja-Brenes2, Roy Soto-Fallas3, José Carlos Mora-Barrantes4, Rosa Alfaro-Solís5, Henry Borbón-Alpízar6, Juan Valdés-González7
Fecha de recepción: 27 de enero, 2022
Fecha de aprobación: 3 de abril, 2022
Araya-Araya, M; Sibaja-Brenes, J.P; Soto-Fallas, R; Mora-Barrantes, J.C; Alfaro-Solís, R; Borbón-Alpízar, H; Valdés-González, J. Evaluación de la variación en la concentración de aldehídos en agua de lluvia y aire: caso de estudio en un área de conservación de Costa Rica. Tecnología en Marcha. Vol. 36, No 2. Abril-Junio, 2023. Pág. 143-154. https://doi.org/10.18845/tm.v36i2.5993
https://doi.org/10.18845/tm.v36i2.5993
Palabras clave
Aldehídos; acetaldehído; formaldehído; bosque; cromatografía; detector UV.
Resumen
Los aldehídos en el ambiente se encuentran entre la mayoría de los compuestos orgánicos que participan en las reacciones fotoquímicas en la atmósfera, formando principalmente radicales en cantidades significativas. Además, presentan efectos nocivos sobre la salud de los habitantes de las ciudades con atmósferas contaminadas, principalmente compuestos como el formaldehído y el acetaldehído. En el presente trabajo se determinó, durante el 2017, la concentración de siete aldehídos en muestras de aire y agua de lluvia en un área de conservación de Costa Rica, llamada Reserva Biológica Los Cusingos, ubicada en el Pacífico Sur, Pérez Zeledón. Para el muestreo y el análisis de los aldehídos se utilizó el método TO-11A (EPA). El muestreo utilizó con cartuchos de adsorción recubiertos con una disolución de 2,4-dinitrofenilhidracina (2,4-DNFH). Las muestras fueron cuantificadas por medio de un cromatógrafo líquido acoplado a un detector UV-Visible. Las mayores concentraciones de aldehídos en las muestras de aire corresponden a formaldehído (62.2 ± 3.1 μg/m3), acetaldehído (88.1 ± 4.9 μg/m3) y acroleína (102.2 ± 5.2 μg/m3) en un periodo de 4 horas. Se determinó que el heptanal fue el aldehído menos contribuyente a la cantidad de aldehídos totales, al encontrarse por debajo del límite de detección (< LC = 0.015 mg/L). Para las muestras de agua de lluvia, el único aldehído cuantificado fue el formaldehído cuya concentración osciló entre (0.00439 ± 0.0062 a 0.08 ± 0.13) mg/L. Los resultados obtenidos en la muestra de aire sugieren un aumento en la concentración de aldehídos correlacionados con la radiación solar y con la temperatura, sugiriendo como principal contribuyente las reacciones fotoquímicas que se llevan a cabo en el aire con hidrocarburos precursores para la generación de contaminantes secundarios.
Keywords
Aldehydes; acetaldehyde; formaldehyde; forest; Chromatograph; UV-detector.
Abstract
Aldehydes in the environment are among most organic compounds that participate in photochemical reactions, mainly forming radicals in significant quantities. These have harmful effects on the health of the inhabitants of cities with polluted atmospheres, mainly formaldehyde and acetaldehyde. In the present work, the concentration of seven aldehydes in air and rainwater samples in a conservation area of Costa Rica (Los Cusingos Biological Reserve, located in the South Pacific, Pérez Zeledón) was determined during 2017. For the sampling and analysis of the aldehydes, the TO-11A (EPA) method was used. Sampling used adsorption cartridges coated with a 2,4-dinitrophenylhydrazine (2,4-DNFH) solution. The samples were quantified by means of a liquid chromatograph coupled to a UV-Visible detector. The highest aldehyde concentrations in air samples correspond to formaldehyde (62.2 ± 3.1 μg/m3), acetaldehyde (88.1 ± 4.9 μg/m3) and acrolein (102.2 ± 5.2 μg/m3) during 4 hours of sampling. Heptanal was determined to be the least contributory aldehyde, as it was below the detection limit. The only aldehyde quantified in the rainwater samples was formaldehyde. The results obtained in the air sample suggest an increase in the concentration of aldehydes correlated with solar radiation and temperature, suggesting as the main contributor the photochemical reactions that take place in the air with precursor hydrocarbons.
Introduccion
La atmósfera se puede dividir en varias capas de acuerdo con la variación de la temperatura con la altura, siendo la troposfera la región más activa, la cual es la capa que contiene alrededor del 80 % de la masa total del aire y casi todo el vapor de agua de la atmósfera [1]. Posee la mayor influencia sobre la superficie terrestre y se pueden encontrar gran cantidad de especies trazas, cuya presencia se relaciona con procesos geológicos, biológicos, químicos y antropogénicos [2]. En la atmósfera existen contaminantes primarios y secundarios, los primeros emitidos directamente desde una fuente, sin embargo, en la mayoría de los casos son los contaminantes secundarios los de mayor importancia, ya que se forman por medio de procesos fotoquímicos que actúan sobre los contaminantes primarios o incluso sobre especies no contaminantes en la atmósfera [3]. Entre los contaminantes primarios se encuentran los aldehídos, los cuales son compuestos orgánicos volátiles biogénicos (COVBs) que contienen el grupo carbonilo y un doble enlace carbono-oxígeno. Son componentes importantes de la química atmosférica y se forman por la degradación fotoquímica de otros compuestos orgánicos, como los hidrocarburos. Estos pueden ser emitidos a la atmósfera por fuentes biogénicas o antropogénicas [2].
Entre las fuentes naturales de los COVBs se encuentran los ecosistemas forestales, particularmente en el trópico existe una gran cantidad de compuestos orgánicos volátiles biogénicos, los cuales comprenden alrededor del 90 % (1150 TgC/año) de las emisiones globales de los compuestos orgánicos volátiles (COV) [4]. La producción de los COVBs tiene su origen en los diferentes tejidos vegetales, siendo emitidos mediante diversos procesos fisiológicos, acumulándose en órganos especializados en hojas y tallos, desprendiéndose o almacenándose, según sea la especie [5].
Con respecto a las fuentes antropogénicas, la mayoría de los hidrocarburos son emitidos por la combustión de vehículos y motores de combustión interna. La oxidación de estos compuestos origina contaminantes secundarios en la atmósfera como aldehídos, cetonas, ácidos orgánicos, peróxidos, entre otros. La condensación de aldehídos y cetonas produce aerosoles de olor peculiar, que además limitan la visibilidad [6]. El formaldehído (HCHO) y al acetaldehído (CH3CHO), son los aldehídos más simples, según su fórmula molecular, y son compuestos emitidos directamente a la atmósfera desde una variedad de fuentes naturales y no naturales. Las emisiones antropogénicas de estos aldehídos se concentran en las zonas urbanas, y están entre los 25 COV de más alta emisión no natural en los Estados Unidos [7]. La importancia de los aldehídos en la atmósfera y el interés por el estudio del comportamiento de estos ha aumentado a lo largo de los últimos años, debido a que los compuestos carbonílicos desempeñan un papel importante en un gran número de procesos que ocurren en la atmósfera. Esto es debido a que son: a) contaminantes primarios emitidos a la atmósfera como residuos procedentes de la combustión incompleta de combustibles fósiles o por emisiones biogénicas, b) contaminantes secundarios procedentes de reacciones que ocurren en la atmósfera, c) fuente esencial de radicales libres para la fotoquímica troposférica, y d) los más importantes en atmósferas contaminadas (son los compuestos que más fácilmente se fotolizan en la atmósfera [8]. No obstante, a pesar de la importancia de los COVBs en los procesos atmosféricos, estos presentan también efectos sobre la salud humana y animal que han sido marco de discusión por científicos en los últimos años. Pequeñas exposiciones a formaldehído y a otros aldehídos específicos, tales como el acetaldehído, acroleína y crotonaldehído, causan irritación en los ojos, en la piel y en la membrana mucosa del tracto respiratorio superior [9].
Estudios con animales indican que, a elevadas concentraciones, muchos aldehídos y cetonas deben ser considerados como altamente citotóxicos y genotóxicos, como consecuencia de provocar ataques nucleofílicos a grupos funcionales amino y sulfhídrilos de biomoléculas, tales como proteínas, ácidos nucleicos, glutatión y cisteína. Consecuentemente, estos aldehídos tóxicos causan complicaciones biológicas de distinto tipo, incluyendo arteriosclerosis, enfermedades cardiovasculares, carcinogénesis, enfermedades inflamatorias, displasia mamográfica, gastritis crónica y displasia precancerosa [10] [11].
Por lo anterior, el presente trabajo tiene como objetivo evaluar la variación de la concentración de los aldehídos en el agua de lluvia y en el aire en la Reserva Biológica Los Cusingos, Pérez Zeledón, con el propósito de comparar los resultados con investigaciones realizadas en sitios con características similares de preservación. Esto puede aportar información sobre las características naturales o antropogénicas de emisión de los aldehídos, además de generar datos que sirvan como base para seguir llevando a cabo monitoreos de estos compuestos en esta área de conservación.
Materiales y métodos
Sitios de estudio
El muestreo de aldehídos en aire y en agua de lluvia se realizó en la Reserva Biológica Los Cusingos, ubicada en el Pacífico Sur, Pérez Zeledón [12]. La reserva forma parte del Corredor Biológico Dr. Skutch, con las coordenadas 09°20’17’’ Norte y 83°37’37’’Oeste, a una altura de 725 m s.n.m. También, colinda con el Parque Nacional Chirripó (Figura 1), y es atravesado por el río Peñas Blancas. Además, a 5 km al noreste, se tomaron muestras de agua de lluvia en la Reserva Biológica Las Nubes, un proyecto de la Facultad de Estudios Ambientales de la Universidad de York, Canadá, ubicada al noreste del Parque Nacional Chirripó, en las coordenadas 09°23’17’’ Norte y 083°36’03’’Oeste.
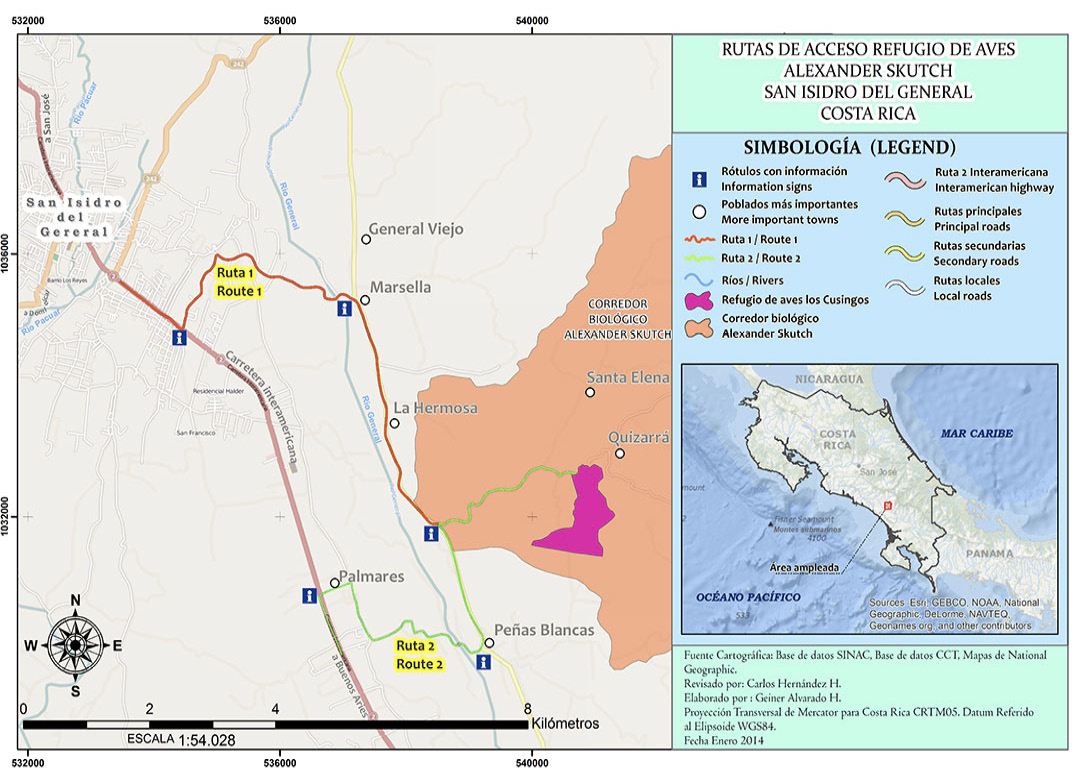
Figura 1. Localización geográfica de la Reserva Biológica Los Cusingos [12].
Condiciones meteorológicas
Los datos de las condiciones meteorológicas de la Reserva Biológica Los Cusingos se obtuvieron del Instituto Meteorológico Nacional de Costa Rica, específicamente de la estación meteorológica número 98097 Montecarlo, Pérez Zeledón, ubicada a 4 km aproximadamente de la zona de estudio, en las coordenadas 09°21’28’’ Norte y 83°36’03’’ Oeste, a una altura de 1005 m s.n.m.
Muestreo y análisis
La recolección de las muestras de aire se realizó con cartuchos de adsorción recubiertos con una disolución de la 2,4-dinitrofenilhidrazina (2,4-DNFH) recristalizada. El sistema de muestreo consistió en una bomba de diafragma que permite pasar el aire a través de los cartuchos, una trampa de seguridad para proteger la bomba de una posible entrada de agua, una válvula de punto crítico para regular el flujo de aire que entra al sistema y un filtro de policarbonato o de fibra de vidrio, para evitar que las partículas que se encuentren en el aire se depositen en los cartuchos y generen una interferencia [13].
El sitio de muestreo para la toma de muestras de aire se ubicó en el área de los Jardines Pamela Lankaster en la Reserva Biológica Los Cusingos, a 1.5 m de altura, y aproximadamente a 3 m de distancia de la vegetación, en las coordenadas 09°20’17.5’’ Norte y 83°37’37.5’’Oeste, a una altura de 725 m s.n.m.
El sistema de muestreo en el agua de lluvia consiste en una botella de polietileno ámbar Nalgene de 1 L y un embudo de polietileno de espiga corta de 13 cm de diámetro (lavados con ácido clorhídrico 1 mol/L y agua desionizada). El embudo se introduce en la botella mediante un tapón de hule perforado. En el extremo inferior del embudo se coloca un cedazo de polietileno para evitar la entrada de partículas sólidas. La altura a la cual se colocó la botella fue de 1.5 m del piso, no existiendo obstáculos cercanos a la toma de muestra que pudiesen afectar los resultados a una distancia de 20 m [13].
La toma de muestras de agua de lluvia fue ubicada a 30 m aproximadamente de la toma de muestras de aire, en las coordenadas 09°20’16.6’’ Norte y 83°37’35.7’’Oeste, a una altura de 712 m s.n.m. La determinación de la concentración de los aldehídos analizados tanto para las muestras de aire como de lluvia (formaldehído, acetaldehído, acroleína, propanal, butanal, hexanal y heptanal) se realizó durante un periodo de 3 semanas de muestreo, comprendidas entre junio y julio del 2017, tomándose muestras durante 4 h, 2 veces al día. Estas muestras se almacenaron para ser analizadas posteriormente.
Para el análisis de los aldehídos en ambas matrices (aire y lluvia) se utilizó la metodología publicada por la Agencia de Protección Ambiental de los Estados Unidos (EPA) método TO-11A [14]. El análisis de las muestras se realizó en un cromatógrafo acoplado a un detector Dionex Ultravioleta Visible UV-VIS, mediante inyección manual. Las condiciones de análisis para la determinación de los aldehídos fueron: Temperatura del horno: 45 °C, fase móvil: acetonitrilo:agua 60:40, flujo: 1.2 mL/min, columna Agilent C18, 150 mm de longitud y 4.6 mm de diámetro interno, detector Dionex UV-Vis, longitud de onda (l = 365 nm). Se utilizó el programa Chromeleon 6.0 para determinar las áreas de los patrones y de las muestras. Los datos meteorológicos fueron proporcionados por el Instituto Meteorológico Nacional de Costa Rica [12].
Resultados y discusión
Concentración de aldehídos en aire
Para las mediciones de la concentración de aldehídos en aire, se estudió la variación temporal en tres campañas de muestreo. Las variaciones en las campañas se muestran en las Figuras 2, 3 y 4. Para la primer campaña de muestreo, la Figura 2 muestra la variación de la concentración promedio diaria de los aldehídos en la Reserva Biológica Los Cusingos. La acroleína, el acetaldehído y el formaldehido presentaron las concentraciones promedio diarias mayores de los aldehídos en estudio, con valores que alcanzaron los (102.2 ± 5.2) μg/m3, los (88.1 ± 4.9) μg/m3 y los (62.2 ± 3.1) μg/m3, respectivamente. Para el caso del hexanal, el 23 de junio aumentó su concentración promedio a (48.7 ± 3.5) μg/m3, lo cual representa hasta 3 veces más de la cantidad obtenida en días anteriores (10.6 ± 1.3 μg/m3 a 18.0 ± 1.8 μg/m3). Este aumento en la concentración de hexanal se pudo deber a factores propios de la naturaleza para el periodo de estudio. Para toda la semana se presentó una temperatura con valores entre 22.8 °C y 24.9 °C, favoreciendo la volatilidad y posiblemente, las velocidades de oxidación por medio de las reacciones fotoquímicas [15]. Los valores promedios diarios reportados durante la primera campaña de muestreo para: formaldehído, acetaldehído, acroleína, propanal, butanal, hexanal y heptanal fueron: (40.8 ± 4.4) μg/m3, (56.1 ± 46.3) μg/m3, (60.1 ± 6.7) μg/m3, (4.4 ± 1.7) μg/m3, (3.0 ± 1.8) μg/m3, (18.9 ± 4.9) μg/m3 y (1.70 ± 0.98) μg/m3, respectivamente. Se muestra una mayor cantidad de aldehídos de cadena corta, los cuales son productos secundarios de las reacciones fotoquímicas de los COV en el aire.
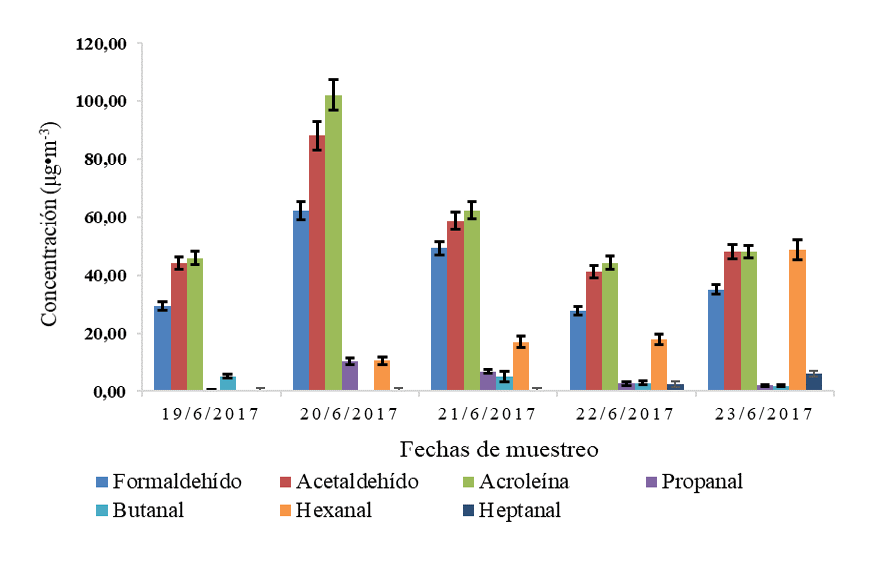
Figura 2. Variación de la concentración promedio diaria de los aldehídos en la Reserva Biológica Los Cusingos, en la primer campaña de muestreo (19 al 23 junio del 2017).
En la figura 3 se muestra la variación de la concentración promedio diaria de los aldehídos en la Reserva Biológica Los Cusingos durante la segunda campaña de muestreo. Para esta campaña la concentración en el aire de la acroleína estuvo por debajo del límite de detección. El acetaldehído se encontró en mayor abundancia con respecto a los demás compuestos, presentado valores entre (17.0 ± 1.1) μg/m3 a (52.1 ± 3.0) μg/m3. Por su parte, el propanal, el butanal y el hexanal no sobrepasaron los 10 μg/m3 durante el muestreo, encontrándose por debajo del límite de cuantificación. Los valores promedios diarios de concentración reportados para los aldehídos: formaldehído, acetaldehído, propanal, butanal y hexanal fueron (17.2 ± 2.3) μg/m3, (31.6 ± 4.1) μg/m3, (2.45 ± 0.92) μg/m3, (2.7 ± 8.6) μg/m3 y (8.4 ± 6.7) μg/m3, respectivamente.
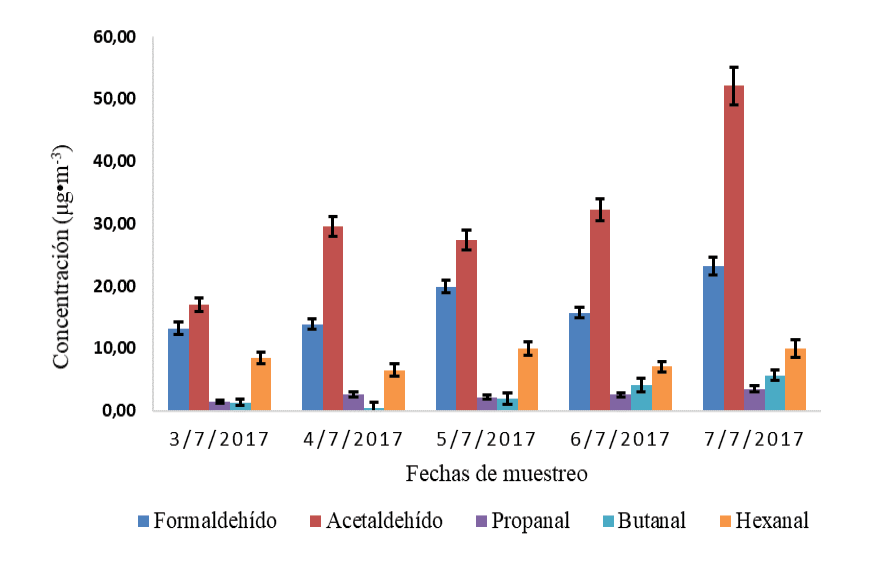
Figura 3. Variación de la concentración promedio diaria de los aldehídos en la Reserva Biológica Los Cusingos, durante el segundo muestreo (el 3 al 7 de julio del 2017).
La figura 4 muestra la tendencia diaria reportada para los aldehídos analizados durante la tercer campaña de muestreo. La mayor concentración diaria corresponde a la acroleína, con un valor de (47.0 ± 2.5) μg/m3, mientras que la menor concentración corresponde al heptanal, con una magnitud de (2.00 ± 0.29) μg/m3. Se observa además en la Figura 4, diferencias muy marcadas entre las concentraciones de los aldehídos de cadena corta con respecto a los de cadena larga, con diferencias entre el 75 % a 80 %.

Figura 4. Variación de la concentración promedio diaria de los aldehídos en la Reserva Biológica Los Cusingos, durante el tercer muestreo (17 al 21 de julio del 2017).
Al tomar en cuenta las tres campañas de muestreo, se encontró una correlación de Pearson fuerte (Triola, 2004) de la radiación y de la temperatura con respecto a la concentración de los aldehídos analizados, lo cual sugiere que la cantidad de los compuestos carbonílicos en el aire estaría muy relacionada con las reacciones fotoquímicas y con la evapotranspiración de las plantas. Para los periodos de estudio, según los boletines meteorológicos del Instituto Meteorológico Nacional de junio y julio del 2017, junio se caracterizó por tener una influencia de viento predominante en el Pacífico Oriental, golfo de México, Centroamérica, el mar Caribe y el océano Atlántico. Para julio, se presentó una mayor incursión de vientos alisios sobre el país que provocaron una reducción en las precipitaciones, condición conocida como canícula, característica de cada año en julio [22] [23]. Esta situación meteorológica pudo generar la variación de la concentración de aldehídos en el aire durante los dos meses de muestreo, donde se tuvo una mayor cantidad en junio que en julio.
La Figura 5 muestra la variación porcentual de la concentración de cada uno de los aldehídos durante las tres campañas de muestreo en la zona. Durante los tres periodos de muestreo, el formaldehído y el acetaldehído fueron los aldehídos de mayor porcentaje en el aire. La concentración de la acroleína fue alta en la primer y la tercera campaña, pero para el segundo periodo estuvo por debajo del límite de detección. Según las mediciones realizadas por Salazar et al, 2016 en Monteverde en el 2015, las mayores concentraciones de aldehídos fueron reportadas para el acetaldehído, el propanal y el butanal, comportamiento diferente al de este estudio. Esta variación de los aldehídos en Costa Rica se pudo deber a la radicación incidente, la altitud del muestreo y al tipo de vegetación de las zonas de estudio, ya que Monteverde es un bosque nuboso a 1534 m s.n.m. mientras que el Refugio Los Cusingos es un bosque muy húmedo premontano, que se encuentra a una altura de 1005 m s.n.m. Estas variaciones hacen que la vegetación de la zona sea distinta y así sus emisiones de compuestos orgánicos volátiles y de aldehídos.
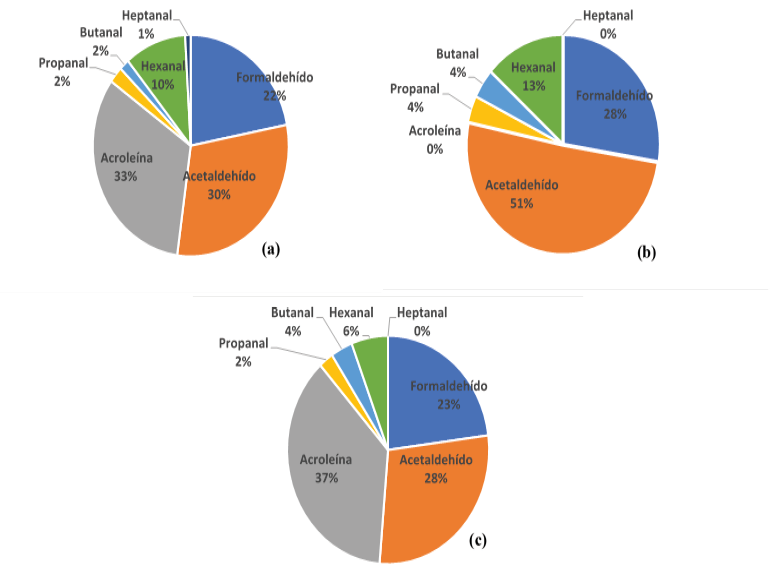
Figura 5. Contribución porcentual de cada aldehído en el (a) primer muestreo, (b) segundo muestreo y (c) tercer muestreo en la Reserva Biológica Los Cusingos.
Durante el presente estudio, fue el formaldehído el compuesto carbonílico reportado con mayor abundancia, lo cual se debe principalmente a que es un producto de la oxidación fotoquímica de los hidrocarburos y de los COVˈs emitidos por la vegetación. Además, este aldehído, procede de fuentes de emisión primarias, tanto biogénicas como antropogénicas. No obstante, debido a que el tiempo de vida medio que tiene por fotólisis es relativamente corto (8 h), este no se transporta lejos de las fuentes de emisión durante el día [15]. El acetaldehído es el otro de los aldehídos predominante durante los muestreos, según Singh y colaboradores [16], la mayoría de los alcanos y de los alquenos forman acetaldehídos como productos intermediarios de la oxidación fotoquímica. En la atmósfera global, la fuente más grande del acetaldehído proviene de la oxidación del etano y del propano, mientras que el propanal puede ser formado a través de la oxidación fotoquímica de muchos hidrocarburos [16].
Concentración de aldehídos en agua de lluvia
La fuente dominante de aldehídos en el agua de lluvia son los aldehídos en fase gaseosa, que se producen fotoquímicamente en la atmósfera a partir de hidrocarburos antropogénicos o biogénicos naturales [17]. El Cuadro 1 muestra las concentraciones de los aldehídos en el agua de lluvia de las muestras recolectadas en la Reserva Biológica Los Cusingos. El único aldehído que se pudo cuantificar durante los días de precipitación corresponde al formaldehído, el acetaldehído se reportó por debajo del límite de cuantificación, y los demás aldehídos, por debajo del límite de detección.
Cuadro 1. Concentración de los aldehídos en el agua de lluvia en la Reserva Biológica Los Cusingos durante las tres campañas de muestreo, y en Las Nubes.
|
Fecha |
Reserva Biológica Los Cusingos |
Proyecto Las Nubes |
|
|
Formaldehído (mg/L) |
Acetaldehído (mg/L) |
Formaldehído (mg/L) |
|
|
19/06/2017 |
0.0548 ± 0.0062 |
< LC = 0.015 |
NA |
|
20/06/2017 |
0.0544 ± 0.0062 |
< LC = 0.015 |
NA |
|
22/06/2017 |
0.0439 ± 0.0062 |
< LC = 0.015 |
NA |
|
03/07/2017 |
0.0530 ± 0.0041 |
< LC = 0.032 |
NA |
|
06/07/2017 |
0.0623 ± 0.0041 |
< LC = 0.032 |
NA |
|
07/07/2017 |
0.0623 ± 0.0041 |
< LC = 0.032 |
NA |
|
21/07/2017 |
0.08 ± 0.13 |
< LC = 0.011 |
0.08 ± 0.13 |
Nota: LC: Límite de cuantificación. NA: No analizado
La cuantificación de aldehídos en agua de lluvia depende de factores de estabilidad y solubilidad en el agua. Una posible explicación de la cuantificación del formaldehído (único aldehído cuantificado) en el agua de lluvia es debido a su hidrolisis en el agua, para producir un intermediario muy estable en forma de diol; metilenglicol. El formaldehído tiene una constante de hidratación de 2530 a 25 °C, lo que sugiere que la hidratación es esencialmente completa y prácticamente toda la molécula existe en su forma diol, lo que aumenta su solubilidad en agua en varios órdenes de magnitud [2].
Comparación con otras investigaciones
El cuadro 2 muestra una comparación entre las concentraciones reportadas de los aldehídos en aire en el presente estudio con los valores reportados para otras regiones rurales y boscosas del mundo. Los datos obtenidos presentan valores por lo general más altos que las otras regiones.
Cuadro 2. Comparación entre las concentraciones de los aldehídos en aire en la Reserva Biológica Los Cusingos, con las concentraciones de los aldehídos en aire en otras regiones rurales y boscosas del mundo.
|
Lugar |
Concentración promedio de aldehídos (μg•m-3) |
Período de muestreo |
||||||
|
F |
A |
Acr |
P |
B |
Hx |
Hp |
||
|
Reserva Biológica Los Cusingos, Costa Rica (Este estudio) |
26.8 |
38.5 |
48.3 |
3.05 |
9.1 |
11.0 |
1.70 |
Junio-Julio 2017 |
|
Reserva Biológica Monteverde (Salazar et al, 2016) |
1.95 |
4.13 |
ND |
8.45 |
5.42 |
1.92 |
0.18 |
Abr-Jun 2015 |
|
Parque forestal de Tijuca, Brasil (Guimaraes et al., 2010) |
2.88 |
1.96 |
ND |
ND |
ND |
ND |
ND |
2007-2008 |
|
Parque Forestal Prince Hill, Sur de China (Yu et al., 2007) |
3.70 |
3.33 |
ND |
0.90 |
1.00 |
1.78 |
0.81 |
Agosto 2004 |
|
Irazú, Costa Rica (Vega, 2000) |
37 |
22 |
ND |
10 |
7 |
3 |
2 |
Abr y Dic 1999 |
|
Gopalpura, Agra (Khare et al., 1997) |
1.7 |
ND |
ND |
ND |
ND |
ND |
ND |
Junio-Setiembre 1995 y 1996 |
F= Formaldehído; A=Acetaldehído; Acr=Acroleína; P=Propanal; B=Butanal; Hx=Hexanal; Hp=Heptanal; ND= No detectado
Según lo reportado por Salazar et al 2016 en la Reserva Biológica Monteverde [21], se encontraron prácticamente los mismos aldehídos de la presente investigación, con excepción de la acroleína. El propanal es el único que en Monteverde muestra concentraciones mayores con respecto a los demás aldehídos. Esta diferencia en concentraciones puede deberse al tipo de zona y de vegetación, donde es posible que la radiación solar sea una factor importante para la formación de aldehídos por reacciones fotoquímicas. En Monteverde se suelen presentar precipitaciones abundantes que no permiten que los aldehídos sean cuantificados [12].
En el Bosque de Tijuca, en Río de Janeiro, se obtuvieron concentraciones mucho menores que en Los Cusingos, a pesar que Tijuca alberga cientos de especies de plantas y es uno de los bosques urbanos más grandes del mundo (superficie de 39.51 km2). Sin embargo, es un área montañosa de bosque lluvioso con picos montañosos de hasta 1021 m de altura que forman una barrera natural a la circulación de aire, lo que produce fuertes lluvias de más de 2000 mm al año [18] a diferencia de la Reserva Bilógica Los Cusingos, la cual posee un clima muy húmedo premontano. Tijuca al presentar un clima lluvioso tiende a disminuir las emisiones biogénicas de los aldehídos, además que por su altura puede variar la cantidad de radiación que puede ser recibida en la zona, según el periodo del año.
Las concentraciones de los aldehídos reportadas para el Forestal Prince Hill de China y la zona de Gopalpura en la India, están por debajo de las concentraciones de los aldehídos reportadas en Los Cusingos. La zona de Prince Hill se encuentra bajo un clima subtropical [19] y Gopalpura es una zona semi-árida [20], ambas con condiciones de temperaturas distintas a las de Costa Rica y con un tipo de vegetación diferente, con montañas altas a sus alrededores.
Con respecto al análisis realizado en el volcán Irazú en el 2000, en una zona ubicada al noreste del cráter del Volcán, el cual es un punto de entrada de los vientos al Valle Central [13], los resultados de estos análisis en comparación con los de la Reserva Biológica Los Cusingos son similares. Sin embargo, la altura de muestreo y la vegetación que los rodea son bastantes diferentes. Además, las concentraciones de los aldehídos en la zona del Irazú pueden ser influenciadas por los vientos alisios con presencia de contaminantes antropogénicos, que por efecto de la radiación solar experimentan reacciones fotoquímicas que pueden generar aldehídos en la zona, además de los emitidos por la vegetación propia del lugar [13].
Conclusiones
Las mayores concentraciones de aldehídos en las muestras de aire correspondieron al formaldehído, el acetaldehído y la acroleína, siendo la acroleína la que presentó mayores concentraciones en cada muestreo. Por su parte el heptanal, fue el aldehído menos contribuyente, al encontrarse por debajo del límite de detección en dos campañas de muestreo. Estos resultados obtenidos en las muestras de aire indican un aumento pronunciado en las concentraciones de los aldehídos correlacionados con la radiación solar y la temperatura, sugiriendo que el principal contribuyente de la formación de los aldehídos son las reacciones fotoquímicas que se llevan a cabo en el aire con los hidrocarburos precursores o por emisión directa de los aldehídos. Las condiciones meteorológicas en el país pudieron afectar la concentración de los compuestos carbonílicos en el aire.
Para las muestras de lluvia se identificó solo la presencia de formaldehído, principalmente porque este se disuelve en el agua más fácilmente que los demás aldehídos, y porque se hidroliza formando un diol estable en la disolución. Los demás aldehídos se encontraron por debajo del límite de cuantificación o del límite de detección del método, con excepción de una muestra en donde se identificó al acetaldehído.
Con el fin de generar una base de datos robusta y confiable, se recomienda la ejecución de una mayor cantidad de muestreos en la Reserva de estudio, bajo distintas épocas del año y con mayor cantidad de puntos de muestreo, con el fin de comparar los datos de acuerdo con la altura y la vegetación de la zona.
Agradecimientos
A los autores les gustaría agradecer al Centro Científico Tropical (CCT) y sus colaboradores de la Reserva Biológica Los Cusingos, por permitir el libre acceso a la reserva para la toma de muestras. Además, agradecer a los administradores del Proyecto Las Nubes, Facultad de estudios Ambientales de la Universidad de York, Canadá, por la colaboración y permitir que se tomarán muestras de agua de lluvia en sus instalaciones.
Referencias
[1] R. Chang, y K. Goldsby, Química. China: Mc Graw Hill Education, 2013.
[2] J. Seinfeld, and S. Pandis, Atmospheric Chemistry and Physics from Air Pollution to Climate Change. New Jersey, USA: John Wiley & Sons, 2006.
[3] S. Manahan, Introducción a la química ambiental. España: Reverté, 2007.
[4] L. Mielke, K. Pratt, P. Shepson, S. McLuckey, A. Wisthaler, and A. Hansel, “Quantitative determination of biogenic volatile organic compounds in the atmosphere using proton-transfer reaction linear ion trap mass spectrometry,” Analytical Chemistry, vol 82, no 19, pp.7952-7967, 2010. https://doi.org/10.1021/ac1014244
[5] E. Pichersky, and J. Gershenzon, “The formation and function of plant volátiles: perfumes for pollinator attraction and defense,” Current Opinion in Plant Biology, vol. 5, no 3, pp. 237-243, 2002. https://doi.org/10.1016/S1369-5266(02)00251-0
[6] E. Muños, y M. Grau, Ingeniería Química. Madrid, España: Universidad Nacional de Educación a Distancia, 2013.
[7] H. Simon, L. Beck, P. Bhave, F. Divita, Y. Hsu, D. Luecken, D. Mobley, G. Pouliot, A. Reff, G. Sarwar, and M. Strum, “The development and uses of EPA’s SPECIATE database,” Atmospheric Pollution Research, vol. 1, no 4, pp. 196-206. 2010. https://doi.org/10.5094/APR.2010.026
[8] M. Salgado, “Estudio cinético de las reacciones de interés atmosférico, reacciones del radical NO3 con aldehídos,” Tesis doctoral, Universidad de Castilla-La Mancha, España, 2001.
[9] B. Delgado, “Compuestos carbonílicos en muestras de interés medioambiental y agroalimentario,” Tesis doctoral, Universidad de la Laguna, Tenerife, España, 2009.
[10] J. Kinsella, and D. Hwang, “Biosynthesis of flavors by Penicillium roqueforti,” Biotechnology and Bioengineering, vol. 18, no 7, pp. 927-938, 1976. https://doi.org/10.1002/bit.260180706
[11] G. Lees, and G. Jago, “Role of acetaldehyde in metabolism: a Review 1. Enzymes catalyzing reactions involving acetaldehyde,” Journal of Dairy Science, vol. 61, no 9, pp. 1205-1215, 1978. https://doi.org/10.3168/jds.S0022-0302(78)83708-4
[12] Instituto Meteorológico Nacional (IMN). Clima de Costa Rica. Pacífico Sur. https://www.imn.ac.cr/documents/10179/31165/PacificoSur.pdf/e9ff2013-e30e-46a3-ad39-934200753fff (accesado el 17 de enero, 2019).
[13] D. Vega, “Aplicación de dos técnicas analíticas de muestreo para la determinación de aldehídos en aire y en agua de lluvia en tres zonas de Costa Rica”. Tesis de maestría, Universidad Nacional, Heredia, Costa Rica, 2000.
[14] EPA. Environmental Protection Agency. Compendium of Methods for the Determination of Toxic Organic Compounds in Ambient Air. U.S. 1999. https://www3.epa.gov/ttnamti1/files/ambient/airtox/to-11ar.pdf (accesado 24 de Marzo, 2016).
[15] John H. Seinfeld, Spyros N. Pandis. Atmospheric Chemistry and Physics: From Air Pollution to Climate Change. John Wiley & Sons, 2016. ISBN 1118947401.
[16] H. B. Singh, L. J. Salas, R. B. Chatfield, E. Czech, A. Fried, J. Walega, M. J. Evans, B. D. Field, D. J. Jacob, D. Blake, B. Heikes, R. Talbot, G. Sachse, J. H. Crawford, M. A. Avery, S. Sandholm, and H. Fuelberg, “Analysis of the atmospheric distribution, sources, and sinks of oxygenated volatile organic chemicals based on measurements over Pacific during TRACE-P,” Journal of Geophysical Research Atmospheres, vol. 109, no 15, pp. 1-20, 2004. https://doi.org/10.1029/2003JD003883
[17] R. Peña, S. García, C. Herrero, M. Losada, A. Vásquez, and T. Lucas, “Organic acids and aldehydes in rainwater in a northwest region of Spain,” Atmospheric Environment, vol. 36, no 34, pp. 5277-5288, 2002. https://doi.org/10.1016/S1352-2310(02)00648-9
[18] C. Guimaraes, D. Custodio, R. Oliveira, L. Varandas, and G. Arbilla, “Comparative study of automotive, aircraft and biogenic emissions of aldehydes and aromatic compounds,” Bulletin of Environmental Contamination and Toxicology, vol. 84, no 2, pp. 180-184, 2010. doi: 10.1007/s00128-009-9891-5
[19] Y. Yu, S. We, H. Lu, Y. Feng, X. Wang, G. Sheng, and J. Fu, “Characteristics of atmospheric carbonyls and VOCs in Forest Park in South China,” Environmental Monitoring and Assessment, vol. 137, no 1-3, pp. 275-285, 2008. Doi:10.1007/s10661-007-9759-2
[20] P. Khare, G. Satsangi, N. Kumar, M. Kumari, and S. Srivastava, “HCHO, HCOOH and CH3COOH in air and rainwater at a rural tropical site in North Central India”. Atmospheric Environment, vol. 31, no 23, pp. 3867-3875, 1997. https://doi.org/10.1016/S1352-2310(97)00263-X.
[21] Brenda Salazar-López, José Pablo Sibaja-Brenes, Juan Valdés-González, Gerardo Rodríguez-Rodríguez. Evaluación de la concentración de los aldehídos en el aire en la Reserva Biológica Monteverde y en la ciudad de Heredia, Costa Rica. Revista de Ciencias Ambientales (Trop J Environ Sci). (Junio, 2016). EISSN: 2215-3896. 50(1): 41-52.
[22] Instituto Meteorológico Nacional. (2017). Boletín Meteorológico Mensual Junio 2017. ISSN: 1654-0465.
[23] Instituto Meteorológico Nacional. (2017). Boletín Meteorológico Mensual Julio 2017. ISSN: 1654-0465.
[24] Triola, M. Estadística, Novena edición: editorial Pearson Educación, México. 2004; pp 498-510, 742.
1 Laboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: melissa.araya.araya@una.est.ac.cr https://orcid.org/0000-0002-6866-9603
https://orcid.org/0000-0002-6866-9603
2 Laboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: jose.sibaja.brenes@una.ac.cr https://orcid.org/0000-0002-7056-2717
https://orcid.org/0000-0002-7056-2717
3 Laboratorio de Productos Naturales y Ensayos Biológicos, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: roy.soto.fallas@una.ac.cr https://orcid.org/0000-0001-6983-540X
https://orcid.org/0000-0001-6983-540X
4 Laboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: jose.mora.barrantes@una.ac.cr https://orcid.org/0000-0002-0409-5276
https://orcid.org/0000-0002-0409-5276
5 Laboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: rosa.alfaro.solis@una.cr https://orcid.org/0000-0001-7413-4210
https://orcid.org/0000-0001-7413-4210
6 Laboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional. Costa Rica. Correo electrónico: henry.borbon.alpizar@una.ac.cr https://orcid.org/0000-0003-0869-4126
https://orcid.org/0000-0003-0869-4126
7 Universidad Tecnológica de Panamá. Ciudad de Pnamá. Panamá. Correo electrónico: juan.valdes@utp.ac.pa https://orcid.org/0000-0002-8641-927X
https://orcid.org/0000-0002-8641-927X