Comparación de la actividad antifúngica de los aceites esenciales del género Cinnamomum spp. contra fitopatógenos
Comparison of antifungal activity against plant pathogens using essential oils of Cinnamomum spp gender
Angie Geraldine Rojas-Amado1, Jovanna Acero-Godoy2
Fecha de recepción: 2 de noviembre, 2021
Fecha de aprobación: 6 de marzo, 2022
Rojas-Amado, A. G; Acero-Godoy, J. Comparación de la actividad antifúngica de los aceites esenciales del género cinnamomum spp. contra fitopatógenos. Tecnología en Marcha. Vol. 36, No 2. Abril-Junio, 2023. Pág.3-19. https://doi.org/10.18845/tm.v36i2.5854
https://doi.org/10.18845/tm.v36i2.5854
Palabras clave
Biocontrol; salubridad; técnicas; composición; alcanfor.
Resumen
La propagación de plagas afecta diferentes especies de plantas generando un desafío para el mantenimiento del control de la inocuidad alimentaria, diferentes investigaciones concuerdan con que el uso permanente de plaguicidas químicos genera a largo plazo afecciones de salud en las diferentes comunidades bióticas y abióticas, además ocasiona resistencia en los diferentes fitopatógenos a los componentes químicos que contienen los plaguicidas, lo cual promueve la proliferación de dichos microorganismos. En la búsqueda de soluciones a esta problemática, se han desarrollado varias investigaciones, de las cuales un amplio y prometedor campo es el uso de aceites esenciales (AE) de diferentes plantas, dichas investigaciones han mostrado resultados positivos en la inhibición de la actividad antifúngica. El presente artículo de revisión se realiza con el fin de comparar el efecto inhibitorio que presentan tres aceites del género Cinnamomum spp., Cinnamomum zeylanicum, Cinnamomum cassia y Cinnamomum camphora frente a tres hongos fitopatógenos, Alternaria solani, Fusarium oxysporum y Rhizoctonia solani distribuidos en el suelo a nivel mundial, analizando cual es el método de extracción y el método de caracterización química usado más frecuente, adicionalmente se comparan los resultados obtenidos por distintos autores en cuanto la actividad inhibitoria que estos AE tienen en los fitopatógenos mencionados a diferentes CMI obteniendo conclusiones variables. Cinnamomum zeylanicum, parece ser hasta ahora el aceite esencial más estudiado frente a tres especies de hongos mencionadas y presenta un prometedor antifúngico para las nuevas tecnologías de control de plagas, se propone continuar investigando en el comportamiento inhibitorio del aceite de canela.
Keywords
Biocontrol; sanitation; techniques; composition; camphor.
Abstract
The spread of pests affects different plant species generating a challenge for maintaining food safety control, different investigations agree that the permanent use of chemical pesticides generates long-term health conditions in the different biotic and abiotic communities, as well as causing resistance in the different phytopathogens to the chemical components that pesticides contain, which promotes the proliferation of these microorganisms. In the search for solutions to this problem, several investigations have been developed, of which a wide and promising field is the use of essential oils (EA) from different plants, these investigations have shown positive results in the inhibition of antifungal activity. This review article is carried out in order to compare the inhibitory effect of three oils of the genus Cinnamomum spp., Cinnamomum zeylanicum, Cinnamomum cassia and Cinnamomum camphora against three phytopathogenic fungi, Alternaria solani, Fusarium oxysporum and Rhizoctonia solani distributed in the soil worldwide, analyzing which is the extraction method and the most frequently used chemical characterization method, additionally the results obtained by different authors are compared regarding the inhibitory activity that these EA have in the mentioned phytopathogens at different MICs obtaining variable conclusions . Cinnamomum zeylanicum, seems to be the most studied essential oil against three species of fungi mentioned so far and presents a promising antifungal for new pest control technologies, it is proposed to continue investigating the inhibitory behavior of cinnamon oil.
Introducción
Desde los comienzos de la humanidad surge el apuro de controlar las plagas que afectan la agricultura creando diferentes tipos de sustancias para combatirlas, sin embargo, a lo largo del tiempo, algunos plaguicidas se han identificado como un peligro para el medio ambiente, amenazando la estabilidad de las comunidades bióticas y abióticas representando a su vez un problema de salud pública. [1]
Durante las últimas décadas, los aceites esenciales (AE) han adquirido un interés creciente gracias a sus características fisicoquímicas ya que no generan residuos nocivos al ser de fuente natural, siendo postulados como control biológico en lugar de los plaguicidas de síntesis química. Debido a sus compuestos esencialmente terpénicos, terpenoides, constituyentes aromáticos, alifáticos, óxidos, alcoholes, éteres, esteres, aldehídos y cetonas, son antioxidantes, insecticidas y antimicrobianos. [2] [3] [4].
Los AE son mezclas de compuestos liquidas complejas, oleosas y aromáticas naturales, biosintetizados por plantas como metabolitos secundarios en sus flores, brotes, tallos, semillas, raíces, frutos, corteza y madera, son característicos por su bajo peso molecular, por su densidad y naturaleza hidrófoba, al ser compuestos lipófilos, les permite ser inmiscibles en agua y solubles en disolventes orgánicos. Los AE representan menos del 5% del total de la materia seca de la planta, y su acción es rápida pero poco persistente al ser altamente volátiles, representado un problema al momento de su utilización. La actividad antimicrobiana de estos no está determinada solo por uno de sus compuestos si no por la combinación de todos ellos, esta puede ser caracterizada también por su pH ácido. [2][4].
El género Cinnamomum cuenta con alrededor de 250 especies de árboles y arbustos que se encuentran distribuidos en el sureste de Asia, China y Australia. Este se cultiva preferiblemente en climas cálidos, generalmente asociados a bosques y selvas tropicales. Los AE frecuentemente usados a nivel mundial son los de Cinnamomum zeylanicum, Cinnamomum cassia y Cinnamomum camphora. Estos pueden contener un alto porcentaje de cinamaldehìdo y cantidades considerables de eugenol, lo cual depende del origen geográfico de la especia y las condiciones de procesamiento. [2] [5]
La palabra canela, procede de una terminología griega que denota madera dulce, esta se obtiene de la corteza de diferentes especies de las plantas de Cinnamomum, derivando de ahí su nombre en inglés cinnamon. La canela es usada en diferentes partes del mundo desde tiempos muy antiguos por sus diferentes propiedades y compuestos bioactivos estudiados en diferentes áreas de la biología. [6] [7]
Actualmente, se ha evaluado la efectividad de los AE de canela en diferentes aspectos medicinales; el AE de la corteza de dicha planta es afrodisíaco, antihelmíntico y tónico. Es útil en el tratamiento de la bilis, sequedad de boca, diabetes, bronquitis, diarrea, picazón y enfermedades cardíacas y urinarias; también es carminativo y expectorante, y es útil en hidrocele, dolor de cabeza, anticancerígeno, etc. En cuanto la industria alimentaria se ha evaluado su efectividad en el control de calidad y producción agrícola mostrando resultados eficientes. [2][5]
No solamente se ha evaluado la actividad antimicrobiana del aceite esencial Cinnamomum (canela), sino que en diferentes estudios se ha evidenciado su actividad antioxidante, en donde han comparado con varios AE naturales la eliminación de radicales libres DPPH (2,2-difenil-1-picrilhidrazilo), determinando la extinción del radical más fuerte siendo esto confirmado por ensayos de fotoquimioluminiscencia. En estos estudios también se pudo determinar que el eugenol, es el principal compuesto de este aceite y le brinda la capacidad de poseer mayor actividad antioxidante. [5]
En cuanto su actividad antifúngica y antibacteriana, diferentes autores, han determinado que esto se atribuye al compuesto cinamaldehìdo, siendo un compuesto principal del aceite de canela. Además, el conjunto de los compuestos del aceite como son los oxigenados tales como linalol, 1,8-cineol, neral y geranial, potencializan la actividad antibacteriana. [2][5]
Existe una amplia variedad de hogos fitopatógenos los cuales infectan diferentes cultivos generando daños en el rendimiento de este, por su rápida capacidad de reproducción, ocasionando enfermedades típicas que incluyen la pudrición de raíces y agotamiento. Estos patógenos son generalmente transmitidos a través del suelo. [8] [9]
Uno de los fitopatógenos necrotróficos comúnmente encontrados afectando a las plantas de tomate y papa, es Alternaria solani (ver figura 1), este microorganismo causa el tizón temprano, produce diferentes polipéptidos como la solanapirona y el ácido alternárico que le permiten propagarse ocasionando aproximadamente un 50% de perdidas en el rendimiento de los cultivos, lo cual requiere un control mediante el uso de funguicidas que actualmente, ya han generado resistencia hacia Alternaria solani. Otra de las problemáticas es que este fitopatógeno está ampliamente distribuido por el mundo siendo devastador para los cultivos. [10][11][12]

Figura 1. Alternaria solani, A. Síntomas de la enfermedad en Solanum tuberosum (Foto JE van der Waals, Universidad de Pretoria, Sudáfrica). B – H. Conidios y conidióforos. tomada de:[13]
Por otro lado, Fusarium oxysporum (figura 2) es un hongo ampliamente distribuido en suelo y abarca un complejo variable de cepas con características morfológicas y patológicas diferentes, algunas de estas cepas son saprótrofos y endófitos comensales que colonizan la raíces, pero no representan una amenaza para la planta, es más, cepas específicas pueden generar un beneficio para el huésped ocasionando protección ante diferentes patógenos que la pueden afectar, sin embargo, Fusarium oxysporum también presenta un complejo de cepas que permiten categorizarlo como hongo emergente, ya que invaden diferentes tipos de plantas distribuidas en el mundo ocasionando síntomas característicos como clorosis en las hojas, necrosis de los sistemas vasculares o muerte del huésped ya que este coloniza el xilema. [14] [15]
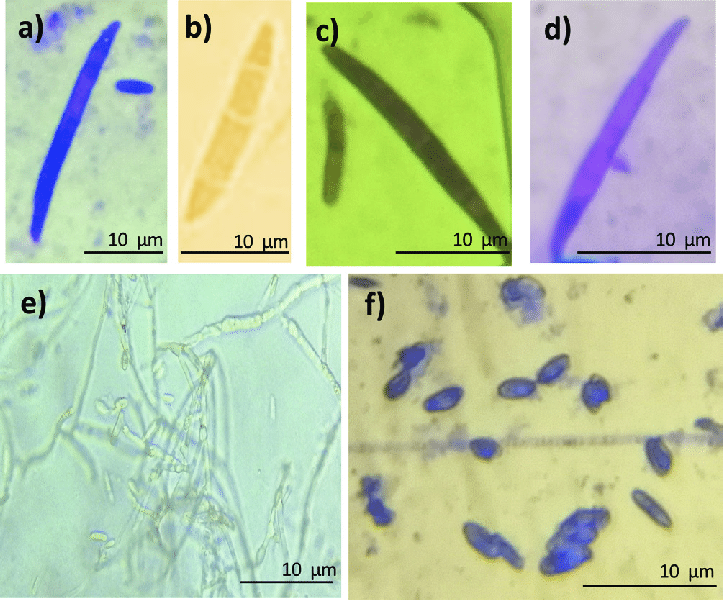
Figura 2. Fusarium oxysporum, Estructuras morfológicas de Fusarium oxysporum en aumento inmersión (100x); a-d) micronidios, e) micelio, f) clamidosporas, Tomada de: [16]
Además de los patógenos anteriormente mencionados, otro de los principales hongos necrotróficos con distribución global es Rhizoctonia solani (figura 3), siendo responsable de grandes pérdidas en la agricultura a nivel mundial de papa y arroz, causando pudrición en las raíces de la planta colonizada, este hongo tiene la capacidad de sobrevivir en diferentes condiciones ambientales. [17][18] [19]

Figura 3. Rhizoctonia solani, Síntomas en hojas de nabo y morfología de hongos causales. a Plántulas enfermas en un campo. b Plántulas enfermas con tallo anillado (cv. Pino Green). c Colonias cultivadas en PDA a 25 ° C en la oscuridad durante 2 meses. d Hifas ramificadas e Micrografía de fluorescencia de hifa teñida con DAPI f Anastomosis hifal g Síntomas en las hojas de nabo 8 días después de la inoculación con el aislado RT2 tomada de: [20]
Metodología
Revisión bibliográfica de distintas bases de datos tales como ScienceDirect, NCBI y Scopus, con objeto de proponer el uso de los aceites esenciales, como son el de canela, partiendo de sus beneficios y correlacionándolo con la necesidad de minimizar el empleo de químicos tóxicos para las plagas en el área agrícola. Se propone realizar una comparación de 3 especies del género Cinnamomun spp. para la inhibición de fitopatógenos de 3 especies microbianas de origen fúngico, evaluando la efectividad que estos puedan tener a una concentración mínima inhibitoria (CMI) y la composición química de cada uno de estos mediante una revisión bibliográfica de diferentes estudios expuestos en artículos científicos. [21]
Clasificación taxonómica de la canela
La canela, desde los tiempos más antiguos es conocida como una planta aromática, destacándose por ser una de las especias más importantes en el mundo. Pertenece al reino Plantae, a la División Magnoliophyta, a la Clase Magnoliopsida, Subclase Magnoliidae, al Orden, a la Familia Lauraceae, al género Cinnamomun, y las 3 especies que se revisaran son Cinnamomum zeylanicum, Cinnamomum cassia y Cinnamomum camphora. [22][23]
Descripción botánica
Cinnamomum zeylanicum
Llamado comúnmente el árbol de canelo, se caracteriza por tener una altura de 5.0 a 10 metros, ramificado, de hojas opuestas, ovales acuminadas, obtusas o ligeramente agudas, flores sedosas, brillantes, lanceoladas, tiene de 10 a 20 cm de largo por 4.0 a 7.0 cm de ancho, con 3.0 a 5.0 nervaduras visibles que salen de la base, presentan una coloración verde oscura cuando el árbol madura (ver figura 4). Las flores son sedosas con una coloración de blanco a amarillento de aproximadamente 6.0 mm agrupadas en panículas generalmente más largas que las hojas. El fruto es ovoide-agudo, seco, de color café oscuro y mide de 10 a 13 mm. [22][24]

Figura 4. Fotografía de Cinnamomum zeylanicum Capturada en el Edificio de Ciencias Nucleares por: [25].
Conocido como canela china, este tipo de árbol se caracteriza por su parecido con C. verum y del cual se diferencia principalmente por su tamaño, siendo C. cassia más grande oscilando entre los 10 metros de alto (ver figura 5). Presenta comportamiento perennifolio, tiene hojas perennes, que están opuestas de un brillante color verde con venas rojizas son alargadas y ovaladas con dimensiones aproximadas entre 10 y 18 cm de largo y 4.0 – 5.0 cm de ancho tiene una conformación más puntiaguda. Cuenta con corteza papirácea, sus ramas son erguidas y se obtiene una canela que cuenta con una superficie rugosa de la corteza de sus ramas jóvenes con una dimensión mayor que un milímetro y un color que puede ser de tono grisáceo. [26][27]

Figura 5. Fotografía de Cinnamomum cassia tomada de [26].
Comúnmente llamado alcanfor, es un árbol aromático, de crecimiento relativamente acelerado que puede superar los 30 metros de altura, cuenta con una copa densa redondeada y un tronco grueso ce 50 a 100 cm de ancho que tiene una corteza inicialmente lisa, grisácea que tiende a tornarse gruesa rugosa y fisurada a lo largo, este se ramifica generalmente desde muy abajo, presenta ramillas delgadas de color castaño, sus hojas son normalmente alternas y perennes, simples, pecioladas, anchas, de color verde brillante, ovado-elípticas, de 6.0-15 cm de largo por 3.0-7.0 cm de ancho, su base es anchamente cuneada o redondeada, su margen es entero y algo engrosado, a veces algo ondulado (ver figura 6). Sus flores son bisexuales, sobre pedicelos glabros de 1.0-2.0 mm de largo, con una tonalidad blanco-verdosa o amarillenta, ligeramente acampanadas de unos 3.0 mm de largo, con un perianto de 6 tépalos elípticos situados en dos verticilos. Sus frutos son bayas redondas, ovoides o subglobosas, de 7.0 a 10 mm de diámetro de color rojo a negruzco, acompañado de un perianto cupuliforme verdoso. [28], [29]

Figura 6. Fotografía de Cinnamomum camphora tomada [29].
Lugar de origen, distribución y cultivo
La canela es endémica de Asía del sur, puntualmente de Sri Lanka, que es una nación insular al sur de la India, siendo este el productor y exportador de aceite de corteza y hojas dominante a nivel mundial. Se han identificado cerca de 250 especies de canela. Las especies que motivan esta revisión bibliográfica son C. cassia y C. camphora, originarias de China y C. zeylanicum es originaria de Sri Lanka, sin embargo, estas son cosmopolitas y se encuentran distribuidas en diferentes partes del mundo. [30]
El crecimiento del árbol de canela es favorecido en un clima húmedo, tropical, cálido de baja altitud y el suelo no debe estar anegado ya que se produciría una corteza de sabor amargo, generalmente está listo para su cosecha después de 3 años, la especia se obtiene secando la parte central de la corteza y el aceite volátil se obtiene de diferentes partes de la planta, vale aclarar que poseen la misma variedad de hidrocarburos en proporciones diferentes con componentes destacados como cinamaldehìdo en la corteza, eugenol en las hojas y alcanfor en la raíz. Las flores y frutos son una rica fuente de acetato de trans-cinnamilo y se ha encontrado más de 80 compuestos de diferentes partes de la canela. [30]
Métodos de extracción de los aceites
La hidrodestilación se puede emplear de tres formas diferentes: destilación de agua, destilación de agua y vapor y destilación directa de vapor, implicando tres procesos fisicoquímicos principales la hidrodifusión, la hidrólisis y la descomposición por calor [31]. Se puede ver una representación gráfica en la figura 7.
Sin embargo, que este sea el método de mayor uso no quiere decir que no se presente dificultades y desventajas, tales como la perdida de compuestos volátiles y degradación de compuestos insaturados al requerir un mayor tiempo de extracción, causando una afección en la calidad del aceite y con ello generando una baja eficacia de extracción, para buscar solución a la creciente problemática, en diferentes investigaciones sobre técnicas adicionales innovadoras y ecológicas se han implementado técnicas que reduzcan el tiempo de extracción, generen un menor consumo de energía y disolventes orgánicos y así originando menos residuos y emisiones de CO2 como la extracción asistida por ultrasonido, la extracción asistida por microondas y la extracción asistida por nitrocelulosa, siendo estas técnicas de excelente aplicación dando unos resultados muy efectivos. [32] [33] [34] [35][36]
Se estima que la canela puede tener entre 20 y 80 compuestos químicos y que estos son muy complejos, la presencia y concentración relativa de estos varia por muchos factores como el área geográfica, la edad de cultivo del árbol, el periodo de cosecha y el suelo de la planta, como se muestra a continuación en el cuadro 1 [32].
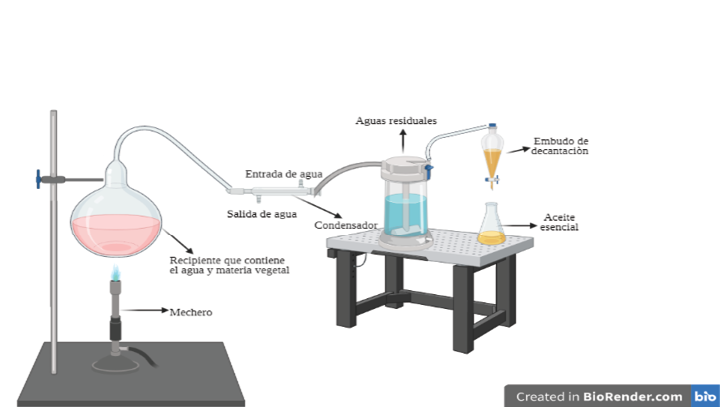
Figura 7. Representación gráfica de la hidrodestilación utilizada por los investigadores, Elaboración propia, referencias revisadas: [36] [37] [38]
Caracterización química del aceite esencial de canela
Así como el método de extracción de aceites más común es la hidrodestilación a pesar de sus dificultades, el método predilecto para la evaluación química cualitativa de componentes es la GC-MS (Cromatografía de gases – espectrometría de masas), esto por su bajo costo de empleo, capacidad de alto rendimiento y alta sensibilidad, la imposición de este método depende de cada equipo, lo cual permite agregar como factor de variación para la presencia de componentes el manejo que el aceite tenga al ingresar al cromatógrafo. Lo anteriormente mencionado se evidencia en el cuadro 2, en la cual se comparan los componentes encontrados por diferentes autores y todos varían en porcentaje y presencia. [39]
En el trabajo realizado por V.S Pragadheesh et al., 2013, se puede referenciar lo anteriormente mencionado, pese a que la extracción y medición de componentes se realizó de manera mensual durante un año, y aunque se tratara de la misma planta de C. camphora, hubo meses en los cuales los componentes no estaban presentes o se encontraban en diferente porcentaje, cuestión que los autores le otorgan a las variaciones estacionales, ya que tanto como la recolección, conservación y manejo para la extracción del aceite de la corteza de esta planta se realizó sin ninguna variación, por eso sería incorrecto delimitar el porcentaje o presencia de los diferentes componentes. [40]
En el caso del aceite esencial C. zeylanicum, Božik et al., 2017, Kalagatur et al., 2020 y Yasmin et al., 2020, indican haber determinado cantidades relativas de α-pineno, Linalol y Eugenol; En cuanto al aceite esencial C. cassia, Jeyaratnam et al., 2016, Xie et al., 2017 y Chen et al., 2020 únicamente concuerdan con haber determinado Cinamaldehìdo. Y a pesar de que no todos los autores citados para C. camphora encuentran una similitud en la búsqueda de compuestos, 3 de 4 si lo hicieron, V.S Pragadheesh et al., 2013, Chen et al., 2020 y Xiao et al., 2020 concuerdan con haber encontrado α-pineno, Canfeno, β-pineno, Borneol, Cariofileno, γ-Elemene, Mirceno, γ-terpineno y Alcanfor, siendo también estas 3 investigaciones las que más relacionan compuestos, esto puede ser por la variación geográfica en la cual se encuentra la planta, en estos casos estaban situadas en países como Republica checa, India y Pakistán, además existen condiciones edafoclimáticas y genéticas de la planta que pueden generar que la concentraciones de las componentes sean diferentes. [34] [41][42][43][44][45][46][47][48]
Cuadro 1. Composición química de los AE de canela.
|
Cinnamomum zeylanicum (%) |
Cinnamomum cassia (%) |
Cinnamomum camphora (%) |
||||||||
|
Compuesto químico |
[41] |
[42] |
[43] |
[44] |
[45] |
[34] |
[40] |
[47] |
[46] |
[48] |
|
Acetato de cinamilo |
2,50% |
|||||||||
|
Cumarina |
1.0% |
11.98% |
7.45% |
|||||||
|
α-pineno |
1.04% |
0,60% |
0.141% |
3.7% |
4.85% |
2.2% |
||||
|
0.33% |
0,19% |
2.2% |
4.43% |
0.5% |
||||||
|
β-pineno |
0.21% |
0,44% |
1.4% |
3.57% |
0.7% |
|||||
|
α-felandreno |
0.80% |
5,92% |
0.7% |
5.7% |
||||||
|
p-cimeno |
1.22% |
1,21% |
0.5% |
3.16% |
||||||
|
d-limoneno |
0,71% |
12% |
||||||||
|
Eucaliptol |
0.12% |
0.2% |
16.8% |
|||||||
|
Linalol |
1.87% |
4,29% |
0.171% |
1.0% |
0.46% |
26.6% |
98.39% |
|||
|
Borneol |
0.5% |
0.4% |
16.41% |
0.7% |
||||||
|
Naftaleno |
0.1% |
3.1% |
||||||||
|
Oxido de linalol |
1.53% |
0,84% |
||||||||
|
α-terpineol |
0.24% |
0.7% |
0.8% |
8.7% |
||||||
|
Cinamaldehído |
1.35% |
35,81% |
85.4% |
49.75% |
0,62% |
|||||
|
Humuleno |
3.97% |
1.9% |
||||||||
|
Eugenol |
76.85% |
12,41% |
8.9% |
0.2% |
1.27% |
|||||
|
Biciclogermacreno |
2.83% |
|||||||||
|
Germacrene |
0.6% |
2.05% |
0.8% |
|||||||
|
Copaeno |
0.68% |
0,19% |
0.6% |
3,66% |
6.23% |
0.2% |
||||
|
Cariofileno |
2.97% |
0.5% |
3.4% |
10.71% |
3.3% |
|||||
|
Acetato de cinamilo |
1.38% |
30.26% |
||||||||
|
γ-Elemene |
1,31% |
0.3% |
0.63% |
1.3% |
||||||
|
Benzoato de bencilo |
3.87% |
|||||||||
|
Limoneno |
10,54% |
3.8% |
8.23% |
|||||||
|
Mirceno |
0,09% |
1.9% |
6.23% |
1.3% |
||||||
|
γ-terpineno |
2,71% |
0.1% |
3.66% |
0.5% |
||||||
|
Alcanfor |
0,70% |
73.8% |
10.6% |
5.0% |
||||||
|
β-felandreno |
8,21% |
|||||||||
|
Isoterpinoleno |
1,37% |
|||||||||
|
trans-Carveol |
1,31% |
|||||||||
|
2-metoxicinamaldehído |
5,07% |
|||||||||
|
trans- cinnamaldehído |
81,86% |
|||||||||
|
4-terpineol |
0.10% |
3.5% |
0.4% |
1.1% |
||||||
Fuentes: [34] [41][42][43][44][45][46][47][48]
Aceites esenciales del género Cinnamomum spp. para el control biológico de hongos fitopatógenos
Los hongos son los principales causantes de las enfermedades en plantas, representando el grupo más variado de riesgo ecológico a nivel mundial, en su mayoría pertenecen a basidiomicetos y ascomicetos, utilizando distintos métodos de invasión, generando una sobreproducción de factores de virulencia que le permitan desarrollar de manera benéfica la colonización, hongos como Alternaria solani y Rhizoctonia solani tienen mecanismos necrotrófico, lo que quiere decir que luego de generar toxinas para matar su huésped se alimentan de ese material, mientras que Fusarium oxysporum coloniza el tejido vivo, generando moléculas efectoras que le permitan inhibir la muerte vegetal y le permita manipular el metabolismo de la planta denominado biótrofo, por esto, la aplicación de métodos para el control biológico que sean prometedores requieren una profundización investigativa. En la siguiente tabla se comparan los resultados del comportamiento de los aceites de canela en los 3 fitopatógenos usados en distintos estudios y así evaluar la viabilidad de los resultado obtenidos con una concentración mínima inhibitoria (CMI) para uso en cultivos agrícolas para superar la problemática e innovar las tecnologías de biocontrol en medio de la creciente demanda de estos productos y así abordar una agricultura sostenible a perspectivas futuras llegando a una estabilidad y supervivencia. [49]
Los resultados realizados en diferentes investigaciones son variables tanto en CMI como en efectividad a los 3 fitopatógenos propuestos, esta variabilidad de resultados permite discutir la aplicación de los AE de canela para su control. Como se evidencia el aceite que cuenta con más investigaciones realizadas sobre estos patógenos vegetales es el aceite C. zeylanicum, presenta un potencial para tratar la enfermedad que genera A. solani, ya que los autores Ramírez S. et al., 2016 y Bahraminejad et al., 2017, con CMI de 0.05% y 1.0 μl/ml respectivamente, coinciden en inhibir A. solani en un 100%, sin excluir el impedimento de desarrollo que este presenta frente a los otros 2 fitopatógenos mencionados, nuevamente Ramírez S. et al., 2016, que adicionalmente usaron F. oxysporum, con una CMI de 0,05% pudo inhibir un 73.2% el crecimiento del patógeno, y Juarez E., 2017, en el cual determinaron el comportamiento inhibitorio con R. solani, a una CMI de 300 ppm tiene una actividad inhibitoria de 66.74 %, siendo este un excelente candidato para mitigar el uso de plaguicidas químicos que puedan resultar tóxicos. [50][51]
Frente a los aceites C. cassia y C. camphora, que han sido investigados para diferentes fitopatógenos, lamentablemente en los 3 fitopatógenos seleccionados aún falta profundizar la propuesta de acción inhibitoria frente a ellos, sin embargo, hay algunos autores que han planteado unas bases que permitirán potenciar esta formulación antifúngica, en el caso de C. cassia, los autores Xie et al., 2017, proponen evaluar la actividad inhibitoria del aceite contra F. oxysporum y de R. solani, trabajaron una CMI de 400 μg / mL, sin embargo los porcentajes de acción no son muy altos, siendo 28,50% y 54,80% respectivamente. [45]
Igualmente pasa con C. camphora, que carece de información investigativa frente a los fitopatógenos seleccionados en específico, sin embargo en el artículo de investigación (Tomazoni et al., 2017), encontrado se obtienen resultados prometedores frente al comportamiento sobre A. solani, a una CMI de 1.5 μL, se obtiene una actividad inhibitoria total (100%), lo cual nos llevaría a concluir que los aceites de canela tienen un potencial para nuevos usos frente al manejo de tizón temprano ocasionado por A. solani. [53]
Cuadro 2. Comparación de actividad antifúngica de los AE de canela
|
Aceite esencial |
Fitopatógeno |
Método |
CMI |
Acción |
% Inhibición |
Referencia |
|
Cinnamomum zeylanicum |
Alternaria solani |
Placa (Agar PDA modificado con AE) |
0.05 y 0.01% |
Inhibición del crecimiento |
0.05% = 100% Crecimiento micelial y 100% formación de conidios 0.01% = 16.5% el crecimiento micelial y 50.23%formación de conidio |
[50] |
|
Alternaria solani |
Placa (Agar PDA modificado con AE) |
1.0 μl/ml. |
Inhibición del crecimiento |
100% |
[51] |
|
|
Fusarium oxysporum |
Placa (Agar PDA modificado con AE) |
0.05 y 0.01% |
Inhibición del crecimiento |
0.05% = 73.2 % Crecimiento micelial y 100% formación de conidios 0.01% = 6.5 % Crecimiento micelial y 22.4 % formación de conidios |
[50] |
|
|
Rhizoctonia solani |
Placa (Agar PDA modificado con AE) |
100 ppm 200 ppm 300 ppm |
Inhibición del crecimiento |
100 ppm: 4.6 % 200 ppm : 14.00 % 300 ppm: 66.74 % |
[52] |
|
|
Cinnamomum cassia |
Fusarium oxysporum |
Placa (Agar PDA modificado con AE) |
400 μg / mL |
Acción fungicida |
28,50% |
[45] |
|
Rhizoctonia solani |
Placa (Agar PDA modificado con AE) |
400 μg / mL |
Acción fungicida |
54,80% |
[45] |
|
|
Cinnamomum camphora |
Alternaria solani |
Placa (Agar PDA modificado con AE) |
1.0 μL 1.5 μL |
Acción fungicida |
1.0 μL: 27.88% 1.5 μL: 100% |
[53] |
Fuentes: [45] [50] [51] [52] [53]
Finalmente se podría agregar, que esto determina un nuevo horizonte para continuar en la investigación, teniendo en cuenta la cantidad numerosa de AE y de fitopatógenos de múltiples especies, se podría contemplar la idea de ampliar las posibilidades del uso de AE del género Cinnamomum en estos 3 fitopatógenos distribuidos ubicuamente a nivel mundial, partiendo de unos porcentajes de inhibición brindados por los autores anteriormente mencionados.
Discusión y conclusiones
La solución convencional más usada actualmente es el uso de plaguicidas químicos que contienen compuestos tóxicos los cuales generan problemáticas de salud pública y de diferentes ecosistemas, además el uso persistente de estos plaguicidas en el afán de aumentar el rendimiento y ganancias por parte de diferentes agricultores ha generado una evolución de cepas resistentes de innumerables especies de fitopatógenos distribuidos ampliamente en el suelo a nivel mundial, afectando también la exportación, el desarrollo sostenible y la economía de los diferentes países los cuales tienen como base económica la agricultura. [54] [55] [56]
Diferentes investigaciones que buscan alternativas para solucionar la problemática de resistencia y toxicidad generada por los plaguicidas han adquirido fuerza durante los últimos años, en cuanto a microorganismos patógenos las investigaciones que podrían adquirir más fuerza inclinadas hacia el uso de AE extraídos de diferentes plantas como la menta, tomillo, orégano, etc, evaluando en varios estudios el comportamiento de diferentes fitopatógenos, también sus componentes y acción inhibitoria obteniendo resultados experimentales que permiten una introducción al potencial oculto que tienen estos aceites de las diferentes plantas, permitiendo comparar los beneficios y desventajas que estas podrían generar, sin duda alguna, implican más trabajo pero es una solución alterna prometedora que mitigaría los diferentes riesgos de salud a los que actualmente están sometidos diferentes especies, adicionalmente tendría un impacto positivo en la economía mundial al reducir las plagas y al mismo tiempo las afecciones causadas por los plaguicidas. [57] [58] [59] [60].
El empleo comercial de la canela para diferentes actividades y la propuesta del uso de una especia conocida para inhibir fitopatógenos es bastante intrigante, esto se basa en diferentes estudios que comprueban la efectividad de este con diferentes fitopatógenos como bacterias en el caso del estudio realizado por Chen et al., 2020 en el cual evaluaron el comportamiento de C. camphora con B. subtilis, S.gallinarum, S. aureus, E. faecalis y E. coli, en el cual se evidenció la buena actividad que este tuvo al aumentar la apoptosis de cada una de estas.[34]
Otros fitopatógenos en los cuales se ha estudiado la efectividad de las diferentes especies de aceites de canela son los hongos, siendo también un amplio campo de estudio, unos hongos de importancia a nivel mundial son A. solani, F. oxysporum y R. solani, por las diferentes enfermedades vegetales que estos pueden generar se propone continuar innovando con aportes científicos que permitan conocer más del comportamiento del aceite esencial de canela ya que en A. solani los autores concuerdan en que los AE del género Cinnamomum como C. zeylanicum y C. camphora presentan un potencial prometedor para mitigar el microorganismo que genera el tizón temprano especialmente en cultivos de papa y tomate, sin embargo falta más investigación del comportamiento inhibitorio de estos aceites frente a F. oxysporum y R. solani siendo estos de esparcimiento ubicuo a nivel mundial, la inhibición de estos sería de gran avance. También es importante sembrar la duda de que pasaría si se combinan los aceites de canela de diferente género y que acción presentaría estos frente a la limitación de crecimiento del fitopatógeno, cabe resaltar que es un campo amplio de investigación el cual no tendría limitaciones para su aplicación, se abre la puerta a continuar investigando la forma de acción de los AE de canela, ¿por qué inhibe más unas especies que otras?, ¿si solo tiene que ver con el comportamiento génico del patógeno o si también tiene que ver con la presencia y ausencia de los diferentes componentes del aceite extraído?, son preguntas que solo las próximas investigaciones podrán resolver, partiendo de las bases firmes y comprometedoras que hasta el momento se han encontrado [45][50] [51] [52] [53]
El aceite esencial de canela presenta resultados variables en diferentes investigaciones, pero lo más importante siendo un método de control biológico que promete una nueva alternativa para evitar el uso de plaguicidas tóxicos, lo cual mitigaría problemáticas de salud pública y enfermedades animales que pueden generar los componentes químicos que contienen los plaguicidas.
Agradecimientos
A la Universidad Colegio Mayor de Cundinamarca.
[1] del Puerto Rodríguez, A. M., Suárez Tamayo, S., & Palacio Estrada, D. E. Efectos de los plaguicidas sobre el ambiente y la salud. Revista Cubana de Higiene y Epidemiología, 52(3), 372-387. (2014).
[2] Liberal D, Universitat Politècnica de València, E. Evaluación del potencial antifúngico de los aceites esenciales comerciales de Canela (Cinnamomum verum J. Presl) y Laurel (Laurus nobilis L.) En el control de Botryotinia fuckeliana (de Bary) Whetzel, Epicoccum nigrum Link, Curvularia hawaiiensis Manamgoda, L. Cai, K.D. Hyde y Aspergillus niger van Tieghem., Universitat Politècnica de València. Ingeniería del agua, 18(1), ix. (2014). https://doi.org/10.4995/ia.2014.3293
[3] Andrade, G., García, A., Cervantes, L., Aíl C., Borboa, J., & Rueda ,E. Study of the autochthonous plants as a potential biocontroller in. Revista de la Facultad de Ciencias Agrarias. (2017).
[4] Boukaew, S., Prasertsan, P., & Sattayasamitsathit, S. Evaluation of antifungal activity of essential oils against aflatoxigenic Aspergillus flavus and their allelopathic activity from fumigation to protect maize seeds during storage. Industrial Crops and Products, 97, 558-566. (2017). https://doi.org/10.1016/j.indcrop.2017.01.005
[5] Cardoso, G. A., López, A., & Sosa, M. E. Chapter 38—Cinnamon (Cinnamomum zeylanicum) Essential Oils. En V. R. Preedy (Ed.), Essential Oils in Food Preservation, Flavor and Safety (pp. 339-347). Academic Press. (2016). https://doi.org/10.1016/B978-0-12-416641-7.00038-9
[6] Hamidpour, R., Hamidpour, M., Hamidpour, S., & Shahlari, M. Cinnamon from the selection of traditional applications to its novel effects on the inhibition of angiogenesis in cancer cells and prevention of Alzheimer’s disease, and a series of functions such as antioxidant, anticholesterol, antidiabetes, antibacterial, antifungal, nematicidal, acaracidal, and repellent activities. Journal of Traditional and Complementary Medicine, 5(2), 66-70. (2015). https://doi.org/10.1016/j.jtcme.2014.11.008
[7] Almatroodi, S. A., Alsahli, M. A., Almatroudi, A., Anwar, S., Verma, A. K., Dev, K., & Rahmani, A. H. Cinnamon and its active compounds: A potential candidate in disease and tumour management through modulating various genes activity. Gene Reports, 21, 100966. (2020) https://doi.org/10.1016/j.genrep.2020.100966
[8] Fan, L., Luo, Z., Li, Y., Liu, X., Fan, J., Xue, W., Tang, L., & Li, Y. Synthesis and antifungal activity of imidazo[1,2-b] pyridazine derivatives against phytopathogenic fungi. Bioorganic & Medicinal Chemistry Letters, 30(14), 127139. (2020). https://doi.org/10.1016/j.bmcl.2020.127139
[9] Chávez-Ramírez, B., Kerber-Díaz, J. C., Acoltzi-Conde, M. C., Ibarra, J. A., Vásquez-Murrieta, M.-S., & Estrada-de los Santos, P. Inhibition of Rhizoctonia solani RhCh-14 and Pythium ultimum PyFr-14 by Paenibacillus polymyxa NMA1017 and Burkholderia cenocepacia CACua-24: A proposal for biocontrol of phytopathogenic fungi. Microbiological Research, 230, 126347. (2020). https://doi.org/10.1016/j.micres.2019.126347
[10] Iftikhar, S., Shahid, A. A., Halim, S. A., Wolters, P. J., Vleeshouwers, V. G. A. A., Khan, A., Al-Harrasi, A., & Ahmad, S. Discovering Novel Alternaria solani Succinate Dehydrogenase Inhibitors by in Silico Modeling and Virtual Screening Strategies to Combat Early Blight. Frontiers in Chemistry, 5. (2017). https://doi.org/10.3389/fchem.2017.00100
[11] Leite, G. L. D., & Fialho, A. Chapter 14—Protection of Tomatoes Using Bagging Technology and Its Role in IPM of Arthropod Pests. En W. Wakil, G. E. Brust, & T. M. Perring (Eds.), Sustainable Management of Arthropod Pests of Tomato (pp. 305-311). Academic Press. (2018). https://doi.org/10.1016/B978-0-12-802441-6.00014-0
[12] Brouwer, S. M., Odilbekov, F., Burra, D. D., Lenman, M., Hedley, P. E., Grenville-Briggs, L., Alexandersson, E., Liljeroth, E., & Andreasson, E. Intact salicylic acid signalling is required for potato defence against the necrotrophic fungus Alternaria solani. Plant Molecular Biology, 104(1), 1-19. (2020) https://doi.org/10.1007/s11103-020-01019-6
[13] Woudenberg, J. H. C., Truter, M., Groenewald, J. Z., & Crous, P. Large-spored Alternaria pathogens in section Porri disentangled. Studies in Mycology, 79, 1-47. (2014). https://doi.org/10.1016/j.simyco.2014.07.003
[14] Adhikari, T. B., Gao, A., Ingram, T., & Louws, F. J. Pathogenomics Characterization of an Emerging Fungal Pathogen, Fusarium oxysporum f. Sp. Lycopersici in Greenhouse Tomato Production Systems. Frontiers in Microbiology, 11. (2020). https://doi.org/10.3389/fmicb.2020.01995
[15] de Lamo, F. J., & Takken, F. L. Biocontrol by Fusarium oxysporum Using Endophyte-Mediated Resistance. (2020, febrero 6). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7015898/
[16] A.Juarez-Garcia, R., Sanzon, D., Ramirez, L. F., Ruiz Nieto, J., & Hernández-Ruíz, J. Inhibición del crecimiento in vitro de Fusarium oxysporum Schltdl con extracto de Argemone ochroleuca Seet (Papaveraceae). 2020, 1-8. (2020). https://doi.org/10.30973/aap/2020.6.0061012
[17] Zrenner, R., Verwaaijen, B., Genzel, F., Flemer, B., & Grosch, R. Transcriptional Changes in Potato Sprouts upon Interaction with Rhizoctonia solani Indicate Pathogen-Induced Interference in the Defence Pathways of Potato. International Journal of Molecular Sciences, 22(6). (2021). https://doi.org/10.3390/ijms22063094
[18] Lee, D.-Y., Jeon, J., Kim, K.-T., Cheong, K., Song, H., Choi, G., Ko, J., Opiyo, S. O., Correll, J. C., Zuo, S., Madhav, S., Wang, G.-L., & Lee, Y.-H. Comparative genome analyses of four rice-infecting Rhizoctonia solani isolates reveal extensive enrichment of homogalacturonan modification genes. BMC Genomics, 22. (2021). https://doi.org/10.1186/s12864-021-07549-7
[19] Hashem, A. H., Abdelaziz, A. M., Askar, A. A., Fouda, H. M., Khalil, A. M. A., Abd-Elsalam, K. A., & Khaleil, M. M. Bacillus megaterium-Mediated Synthesis of Selenium Nanoparticles and Their Antifungal Activity against Rhizoctonia solani in Faba Bean Plants. Journal of Fungi, 7(3). (2021). https://doi.org/10.3390/jof7030195
[20] Hiroyuki Sekiguchi, Takeshi Toda, Erika Sato, Keisuke Tomioka, Hiroharu Murakami, Ryota Amemiya, Naoyuki Hirako, Masato Nakata, Mitsuro Hyakumachi, & Seiya Tsushima. Rhizoctonia blight of turnip green caused by Rhizoctonia solani AG-4 HG-III. (2015, agosto 29). https://ezproxy.unicolmayor.edu.co:2425/article/10.1007/s10327-015-0616-9
[21] Delong, W., Yongling, W., Lanying, W., Juntao, F., & Xing, Z. Design, synthesis and evaluation of 3-arylidene azetidin-2-ones as potential antifungal agents against Alternaria solani Sorauer. Bioorganic & Medicinal Chemistry, 25(24), 6661-6673. (2017). https://doi.org/10.1016/j.bmc.2017.11.003
[22] Aizaga Zurita Sofía Jacqueline Proyecto de investigación presentado como requisito previo a la obtención del título de Odontóloga. (2017).
[23] Rivera, C. D. N., Portilla, D. E., Chavez, G. S., Medina, D. R. F., Hernández, N. G. H., Ingunza, E. L. G., & Arteaga, M. A. B. Efecto hipoglicemiante de la canela cinnamomun verum j.Presl en ratas inducidas a hiperglicemia con estreptozocina. Medicina naturista, 15(1), 80-89. (2021).
[24] Sánchez miranda luisa.pdf. (s. f.). Recuperado 15 de octubre de 2020, de https://tesis.ipn.mx/bitstream/handle/123456789/25267/S%C3%81NCHEZ%20MIRANDA%20LUISA.pdf?sequence=1&isAllowed=y
[25] Aru S., Cinnamomum zeylanicum Blume (LAURACEAE) Captured at Nuclear Science Building, (2008). https://www.flickr.com/search/?text=Cinnamomum%20zeylanicum%20tree
[26] Sarmiento Lurdes, «Casia (Cinnamomum Cassia)», JardineriaOn, árboles y arbustos, septiembre 19 2018, Accedido: oct. 15, 2020. [En línea]. Disponible en: https://www.jardineriaon.com/casia-cinnamomum-cassia.html
[27] Bissanti, G. Cinnamomum cassia: Sistematica, Etimologia, Habitat, Coltivazione Un Mondo Ecosostenibile. (2019, julio 27) http://antropocene.it/en/2019/07/27/cinnamomum-cassia/
[28] Sánchez de lorenzo Cáceres José Manuel, «Cinnamomun camphora», Accedido: oct. 15, 2020. [En línea]. Disponible en: http://www.arbolesornamentales.es/Cinnamomum%20camphora.pdf
[29] Bonells J. EL CINNAMOMUM CAMPHORA Y SUS CULTIVARES. Jardines sin fronteras. (2020, febrero 10). https://jardinessinfronteras.com/2020/02/10/el-cinnamomum-camphora-y-sus-cultivares/
[30] Ribeiro-Santos, R., Andrade, M., Madella, D., Martinazzo, A. P., de Aquino García Moura, L., de Melo, N. R., & Sanches-Silva, A. Revisiting an ancient spice with medicinal purposes: Cinnamon. Trends in Food Science & Technology, 62, 154-169. (2017). https://doi.org/10.1016/j.tifs.2017.02.011
[31] Aramrueang, N., Asavasanti, S., & Khanunthong, A. Chapter 10—Leafy Vegetables. En Z. Pan, R. Zhang, & S. Zicari (Eds.), Integrated Processing Technologies for Food and Agricultural By-Products (pp. 245-272). Academic Press. (2019). https://doi.org/10.1016/B978-0-12-814138-0.00010-1
[32] Yu, H., Ren, X., Liu, Y., Xie, Y., Guo, Y., Cheng, Y., Qian, H., & Yao, W. Extraction of Cinnamomum camphora chvar. Borneol essential oil using neutral cellulase assisted-steam distillation: Optimization of extraction, and analysis of chemical constituents. Industrial Crops and Products, 141, 111794. (2019). https://doi.org/10.1016/j.indcrop.2019.111794
[33] Radivojac, A., Bera, O., Micić, D., Đurović, S., Zeković, Z., Blagojević, S., & Pavlić, B. Conventional versus microwave-assisted hydrodistillation of sage herbal dust: Kinetics modeling and physico-chemical properties of essential oil. Food and Bioproducts Processing, 123, 90-101. (2020). https://doi.org/10.1016/j.fbp.2020.06.015
[34] Chen, G., Sun, F., Wang, S., Wang, W., Dong, J., & Gao, F. Enhanced extraction of essential oil from Cinnamomum cassia bark by ultrasound assisted hydrodistillation. Chinese Journal of Chemical Engineering. (2020). https://doi.org/10.1016/j.cjche.2020.08.007
[35] Ghazanfari, N., Mortazavi, S. A., Yazdi, F. T., & Mohammadi, M. Microwave-assisted hydrodistillation extraction of essential oil from coriander seeds and evaluation of their composition, antioxidant, and antimicrobial activity. Heliyon, 6(9), e04893. (2020). https://doi.org/10.1016/j.heliyon.2020.e04893
[36] Dangkulwanich, M., & Charaslertrangsi, T. Hydrodistillation and antimicrobial properties of lemongrass oil (Cymbopogon citratus, Stapf): An undergraduate laboratory exercise bridging chemistry and microbiology. Science Division, Mahidol University International College, Nakhon Pathom, Thailand. (2020). https://onlinelibrary.wiley.com/doi/pdf/10.1111/1541-4329.12178
[37] Elyemni, M., Louaste, B., Nechad, I., Elkamli, T., Bouia, A., Taleb, M., Chaouch, M., & Eloutassi, N. Extraction of Essential Oils of Rosmarinus officinalis L. by Two Different Methods: Hydrodistillation and Microwave Assisted Hydrodistillation. The Scientific World Journal, 2019, e3659432. (2019). https://doi.org/10.1155/2019/3659432
[38] Kaleem, M., & Ahmad, A. Chapter 8—Flavonoids as Nutraceuticals. En A. M. Grumezescu & A. M. Holban (Eds.), Therapeutic, Probiotic, and Unconventional Foods (pp. 137-155). Academic Press. (2018). https://doi.org/10.1016/B978-0-12-814625-5.00008-X
[39] Loyo, R. M., Zarate, E., Barbosa, C. S., & Simoes-Barbosa, A. Gas chromatography-mass spectrometry (GC/MS) reveals urine metabolites associated to light and heavy infections by Schistosoma mansoni in mice. Parasitology International, 80, 102239. (2021). https://doi.org/10.1016/j.parint.2020.102239
[40] V.S. Pragadheesh, Arvind Saroj, Anju Yadav, C.S. Chanotiya, M. Alam, A. Samad, Chemical characterization, and antifungal activity of Cinnamomum campho essential oil, Industrial Crops and Products, Volume 49, Pages 628-633, ISSN 0926-6690, 2013, https://doi.org/10.1016/j.indcrop.2013.06.023. https://www.sciencedirect.com/science/article/pii/S0926669013003129
[41] Božik M., Nový P., Klouček P, Chemical composition and antimicrobial activity of cinnamon, thyme, oregano, and clove essential oils against plant pathogenic bacteria, acta universitatis agriculturae et silviculturae mendelianae brunensis. (2017)
[42] Kalagatur, N. K., Gurunathan, S., Kamasani, J. R., Gunti, L., Kadirvelu, K., Mohan, C. D., Rangappa, S., Prasad, R., Almeida, F., Mudili, V., & Siddaiah, C. Inhibitory effect of C. zeylanicum, C. longa, O. basilicum, Z. officinale, and C. martini essential oils on growth and ochratoxin A content of A. ochraceous and P. verrucosum in maize grains. Biotechnology Reports, 27, e00490. (2020). https://doi.org/10.1016/j.btre.2020.e00490
[43] Yasmin, S., Nawaz, M., Anjum, A. A., Ashraf, K., Basra, M. A. R., Mehmood, A., Khan, I., & Malik, F. Phytochemical Analysis, and In Vitro Activity of Essential Oils of Selected Plants against Salmonella enteritidis and Salmonella gallinarum of Poultry Origin. Pakistan Veterinary Journal, 40(2), 139-144. Academic Search Complete. (2020).
[44] Jeyaratnam, N., Nour, A. H., Kanthasamy, R., Nour, A. H., Yuvaraj, A. R., & Akindoyo, J. O. Essential oil from Cinnamomum cassia bark through hydrodistillation and advanced microwave assisted hydrodistillation. Industrial Crops and Products, 92, 57-66. (2016). https://doi.org/10.1016/j.indcrop.2016.07.049
[45] Xie, Y., Huang, Q., Wang, Z., Cao, H., & Zhang, D. Structure-activity relationships of cinnamaldehyde and eugenol derivatives against plant pathogenic fungi. Industrial Crops and Products, 97, 388-394 (2017). https://doi.org/10.1016/j.indcrop.2016.12.043
[46] Chen, J., Tang, C., Zhang, R., Ye, S., Zhao, Z., Huang, Y., Xu, X., Lan, W., & Yang, D. Metabolomics analysis to evaluate the antibacterial activity of the essential oil from the leaves of Cinnamomum camphora (Linn.) Presl. Journal of Ethnopharmacology, 253, 112652. (2020). https://doi.org/10.1016/j.jep.2020.112652
[47] Xiao, S., Yu, H., Xie, Y., Guo, Y., Fan, J., & Yao, W. The anti-inflammatory potential of Cinnamomum camphora (L.) J.Presl essential oil in vitro and in vivo. Journal of Ethnopharmacology, 113516. (2020). https://doi.org/10.1016/j.jep.2020.113516
[48] Filho, J. G. de O., Silva, G. da C., Aguiar, A. C. de, Cipriano, L., Azeredo, H. M. C. de, Junior, S. B., & Ferreira, M. D. Chemical composition and antifungal activity of essential oils and their combinations against Botrytis cinerea in strawberries. Journal of Food Measurement and Characterization, 1-11. (2021). https://doi.org/10.1007/s11694-020-00765-x
[49] Sharma, I. Chapter 7—Phytopathogenic fungi and their biocontrol applications. En V. K. Sharma, M. P. Shah, S. Parmar, & A. Kumar (Eds.), Fungi Bio-Prospects in Sustainable Agriculture, Environment and Nano-Technology (pp. 155-188). Academic Press (2021).. https://doi.org/10.1016/B978-0-12-821394-0.00007-X
[50] Ramírez González, S. I., López Báez, O., Espinosa Zaragoza, S., & Wong Villarreal, A. (s. f.). Actividad antifúngica de hidrodestilados y aceites sobre Alternaria solani, Fusarium oxysporum y Colletotrichum gloesporioides. Recuperado 21 de septiembre de 2020, de http://www.scielo.org.mx/scielo.php?pid=S2007-09342016000801879&script=sci_arttext
[51] Bahraminejad, S., Seifolahpour, B., & Amiri, R. Antifungal effects of some medicinal and aromatic plant essential oils against Alternaria solani. (2017).
[52] Juarez, E. Y. Efecto antifúngico del aceite esencial de cinnamomum zeylanicum blume ”canela” sobre el crecimiento de Rhizoctonia solani J.G. Kühn. (2017).
[53] Tomazoni, E. Z., Pauletti, G. F., da Silva Ribeiro, R. T., Moura, S., & Schwambach, J. In vitro and in vivo activity of essential oils extracted from Eucalyptus staigeriana, Eucalyptus globulus and Cinnamomum camphora against Alternaria solani Sorauer causing early blight in tomato. Scientia Horticulturae, 223, 72-77. (2017). https://doi.org/10.1016/j.scienta.2017.04.033
[54] Li, C., Zhu, H., Li, C., Qian, H., Yao, W., & Guo, Y. The present situation of pesticide residues in China and their removal and transformation during food processing. Food Chemistry, 354, 129552. (2021). https://doi.org/10.1016/j.foodchem.2021.129552
[55] Knödler, M., Häfner, E., Klier, B., Albert, H., Binder, G., Schenk, A., & Steinhoff, B. Evaluating a comprehensive database on pesticide residues in essential oils: An update. Journal of Applied Research on Medicinal and Aromatic Plants, 20, 100283. (2021). https://doi.org/10.1016/j.jarmap.2020.100283
[56] Tambo, J. A., Romney, D., Mugambi, I., Mbugua, F., Bundi, M., Uzayisenga, B., Matimelo, M., & Ndhlovu, M. Can plant clinics enhance judicious use of pesticides? Evidence from Rwanda and Zambia. Food Policy, 102073. (2021). https://doi.org/10.1016/j.foodpol.2021.102073
[57] Universidad de Caldas, Noriega, D., Valencia, A., Universidad de Caldas, Villegas, B., & Universidad de Caldas. ARN de interferencia (ARNi): Una tecnología novedosa con potencial para el control de insectos plaga. Revista U.D.C.A Actualidad & Divulgación Científica, 19(1). (2016). https://doi.org/10.31910/rudca.v19.n1.2016.107
[58] Navarro, L. Respuestas moleculares de insectos a factores de estrés ambientales y biológicos. En P. Benavides Machado & C. E. Góngora (Eds.), El Control Natural de Insectos en el Ecosistema Cafetero Colombiano (pp. 142–157). Cenicafé. (2020). https://doi.org/10.38141/10791/0001_6
[59] Montero-Recalde, M., Mira, J. C., Avilés-Esquivel, D., Pazmiño-Miranda, P., & Erazo-Gutiérrez, R. Eficacia antimicrobiana del aceite esencial de tomillo (Thymus vulgaris) sobre una cepa de Staphylococcus aureus. Revista de Investigaciones Veterinarias del Perú, 29(2), 588-593. (2018). https://doi.org/10.15381/rivep.v29i2.14520
[60] Lozano, O., & Berenice, A. Determinación del efecto antimicrobiano de los aceites esenciales de tomillo (Thymus vulgaris) y orégano (Origanum vulgare) frente a la bacteria Staphylococcus aureus ATCC: 12600. 96. (2018)
1 Universidad Colegio Mayor de Cundinamarca, Facultad de Ciencias de la Salud. Colombia. Correo electrónico: agrojas@unicolmayor.edu.co https://orcid.org/0000-0002-3686-5896
https://orcid.org/0000-0002-3686-5896
2 Universidad Colegio Mayor de Cundinamarca, Facultad de Ciencias de la Salud. Colombia. Correo electrónico: jacerog@unicolmayor.edu.co https://orcid.org/0000-0003-1656-6888
https://orcid.org/0000-0003-1656-6888