Comunidades de macroinvertebrados bentónicos como bioindicador de calidad de agua en un sector del rio Chotano, Perú
Benthic macroinvertebrates community as quality bioindicator of water in a sector of the Chotano river, Perú
Celso Nazario Purihuamán-Leonardo1, Eberth Frank Sánchez-Bustamante2
Fecha de recepción: 11 de mayo de 2021
Fecha de aprobación: 30 de agosto de 2021
Purihuamán-Leonardo, C.N; Sánchez-Bustamante, E.F. Comunidades de macroinvertebrados bentónicos como bioindicador de calidad de agua en un sector del rio Chotano, Perú. Tecnología en Marcha. Vol. 35-3. Julio-Setiembre 2022. Pág. 117-127. https://doi.org/10.18845/tm.v35i3.5662
https://doi.org/10.18845/tm.v35i3.5662
Palabras clave
Contaminación orgánica; macroinvertebrados bentónicos; calidad del agua; biodiversidad.
Resumen
Se establecieron dos estaciones en un sector del rio Chotano, con el objetivo de evaluar la calidad del agua, empleando macroinvertebrados bentónicos como bioindicadores, para lo cual se utilizaron índices biológicos: IBMWP, ETP %, diversidad, riqueza, equidad, dominancia, la densidad y grupos tróficos. La recolección de los macroinvertebrados se realizó empleando la red tipo Surber, en dos períodos (seco y lluvioso). En la estación 1 se colectaron en promedio 710 ind/m2 distribuidos en 23 taxones de los órdenes díptera, efemeróptera y tricóptera y en la estación 2 se colectaron 16790 ind/m2, con 6 taxones de los órdenes haplotaxida y díptera, siendo las especies indicadores de polución orgánica, Chironomus sp, Tubifex sp y Psychoda sp, presentes mayormente en la estación 2. Los índices promedios más altos en la estación 1 a comparación de la estación 2 fueron, IBMWP con 60 puntos indicador de calidad de agua dudosa, moderadamente contaminada y 11 puntos, indicador de calidad muy crítica fuertemente contaminada, la diversidad de Shannon – Wiener 1,33 y 0,30 indicador de aguas con poca diversidad, la equidad de Pielou 0,50 muestran poblaciones más estables y 0,20 menos estables; los índices más bajos en la estación 1 comparando con la estación 2 fueron, dominancia de Simpson 0,37 indicador de poca dominancia y mayor diversidad y 0,9 indicador de mayor dominancia, menor diversidad y mayor polución orgánica.
Keywords
Organic pollution; benthic macroinvertebrates; water quality; biodiversity.
Abstract
Two stations were established in a sector of the Chotano river, with the objective of evaluating the quality of the water, using benthic macroinvertebrates as bioindicators, for which biological indices were used: IBMWP, ETP %, diversity, richness, equity, dominance, density and trophic groups. The collection of macroinvertebrates was carried out using the Surber sampler, in two periods (dry and rainy). In the first season, an average of 710 ind/m2 were collected, classified in 23 taxa of the orders diptera, ephemeroptera and tricoptera, and in the second season 16790 ind/m2 were collected, with 6 taxa of the orders haplotaxide and diptera, the species indicating organic pollution, Chironomus sp, Tubbier sp and Psychoda sp, present mostly in season 2. The highest average indices in season 1 compared to season 2 were IBMWP with 60 points indicating moderately polluted doubtful water quality and 11 points indicating highly polluted critical quality, the diversity of Shannon - Wiener 1,33 and 0,30 indicating waters with limited diversity, the equity of Pielou 0,50 show more stable and 0,20 less stable populations; the lowest indices in station 1 compared to season 2 were, Simpson dominance 0,37 indicator of low dominance and higher diversity and 0,9 indicator of higher dominance, lower diversity and higher organic pollution.
Introducción
El estudio biológico y ecológico de las aguas continentales o biomonitoreo basado en la estructura de la comunidad de macroinvertebrados bentónicos especialmente los que presentan sensibilidad o tolerancia a determinadas condiciones ambientales; es uno de los métodos más eficaces para evaluar los cambios ambientales como: Las características fisicoquímicas de la calidad de las aguas continentales, el tipo de flora y fauna a ellas asociadas, permitiendo así, conocer el estado de eutroficación de un cuerpo de agua, su potabilidad para el consumo humano y animal, su grado de aceptabilidad para irrigación, usos industriales, piscicultura y actividades humanas relacionadas con el campo hídrico [1], [2], [3], [4]. Los ecosistemas acuáticos continentales en las últimas décadas han sufrido más impactos por la actividad humana. Los desechos industriales y domésticos de una población cada vez más creciente, tienen como destino final los ríos, y en último término el mar; afectando a los organismos bentónicos por el cambio en la composición natural de los sistemas acuáticos de muchos ríos del mundo, estos han desaparecido, o se han visto sustancialmente reducida o aumentado su población [6], [7]. Los macroinvertebrados presentan sensibilidad o tolerancia a determinadas condiciones ambientales y cumplen importantes funciones en la transformación de la materia orgánica fina y gruesa compuesta por hojas caídas y restos de animales, siendo un componente fundamental en la dinámica y funcionamiento del río como indicadores de calidad del agua; desarrollando modificaciones morfológicas y fisiológicas para su adaptación en el hábitat, como son las estrategias alimenticias, las cuales, se organizan en grupos funcionales [9], [10]. Existen cinco grupos funcionales alimenticios principales: los trituradores, que se alimentan de materia orgánica particulada gruesa (MOPG); los colectores-recolectores; colectores filtradores, de materia orgánica particulada fina (MOPF) y los raspadores de biopelícula y depredadores, que consumen otros animales. En quebradas de montaña, se observa variedad de oferta alimenticia, que se relaciona con la presencia de ciertos grupos funcionales; destacando los raspadores y colectores-recolectores [11].
El río Chotano no es ajeno a esta realidad y está siendo impactado con aguas residuales del camal municipal y red de alcantarillado domésticas que son arrojadas sin ningún tipo de tratamiento a la quebrada Colpamayo, tributario de dicho río y en algunos casos al mismo río; debido a ello, la investigación tiene como propósito evaluar la calidad del agua mediante la identificación de las diversas especies de macroinvertebrados que allí habitan.
Materiales y métodos
Área de Estudio
El área de estudio se encuentra ubicado en un sector del río Chotano entre los 06°34,220´ latitud S y 78° 39,113´ longitud O a una altitud de 2301 m.s.n.m., estación 1 y a los 6° 34,145´ latitud S y 78° 39,188´ longitud O a una altitud de 2301 m.s.n.m., estación 2. El afluente, quebrada Colpamayo tributario del río Chotano, desemboca a los 6° 34,181´ latitud S y 78° 39,155´ longitud O a una altitud de 2301 m.s.n.m., zona 17 hemisferio sur, como se aprecia en la figura 1.
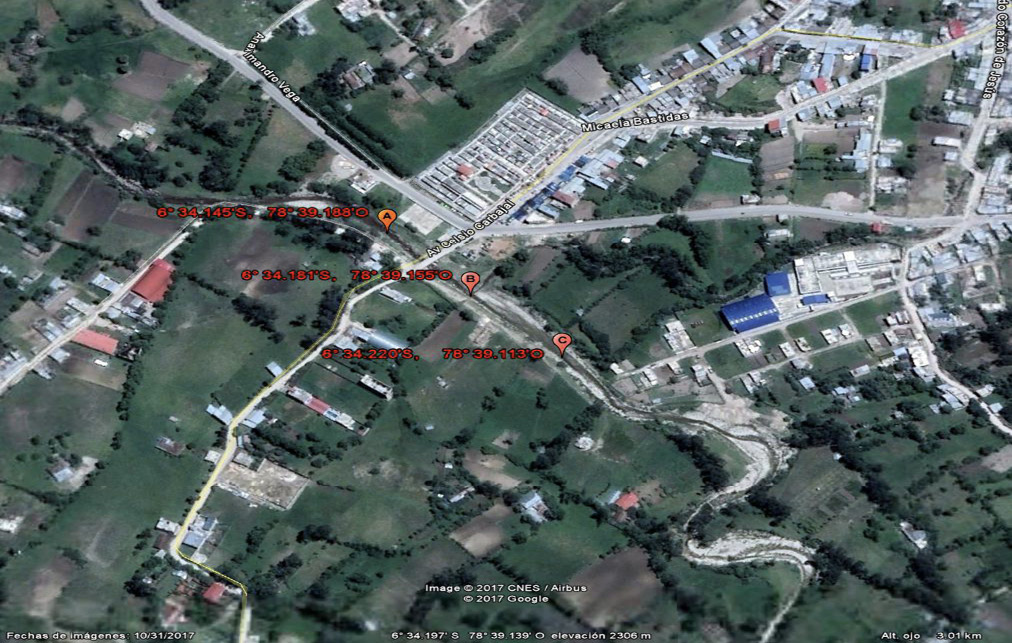
Figura 1. Ubicación de la estación 1 y 2, sector del río Chotano.
Recolección de macroinvertebrados
Los muestreos se desarrollaron en ambas estaciones del río Chotano, ubicados a una distancia de 100 m cada una, correspondientes a época seca y comienzos de lluvias. Se determinaron puntos específicos cada 10 m. extrayéndose cuatro muestras por punto, dos a las orillas y dos en la parte media del río, por cada estación se tomaron 40 muestras, la captura de los macroinvertebrados se realizó según la guía para el estudio de los macroinvetebrados acuáticos del Departamento de Antioquía [1] y el método de colecta, identificación y análisis de comunidades biológicas [12], utilizando la red Surber para muestras cuantitativas con una superficie básica de 0,034 m2, malla de 500 µm con un marco de 337,5 cm2. Las muestras fueron colectadas en envases PET para ser llevadas a los ambientes del Laboratorio de análisis de la calidad de agua para consumo humano de la Dirección Ejecutiva de Salud Ambiental de la ciudad de Chota, donde se depositaron en una bandeja de porcelana, el sustrato se movió con cuidado para realizar la colecta, colocándose en una placa Petri y con ayuda de una pinza entomológica se colocaron en el estereoscopio marca Kyowa optical modelo SD-2PL usando los objetivos de 15 X/15 y 10X/23 por 4X para su observación y determinación taxonómica de los especímenes según género y/o morfotipo [1], [14].
Análisis de los datos hallados
Con los grupos analizados de los macroinvertebrados a través de órdenes, familias, o géneros para evaluar la calidad del agua, se calculó el índice biótico IBMWP “Biological Monitoring Working Party” modificado y adaptado para el río Chotano [1], [15], además se calculó el índice de riqueza total de EPT (Ephemeroptera, Plecoptera y Trichoptera).
Las pruebas estadísticas determinaron una distribución normal, por lo que se realizaron pruebas paramétricas para los índices de diversidad de Shannon – Wiener, la riqueza de Margalef (Dmg), la equidad de Pielou, la dominancia de Berger – Parker, y la dominancia de Simpson (ƛ), además se determinó la Densidad en ind /m2. El análisis de los grupos tróficos se realizó mediante la prueba Chi-cuadrado para muestras independientes, con un nivel de significancia de 0,05
Resultados
Cuadro 1. Taxonomía, categoría y tolerancia de los macroinvertebrados bentónicos colectados en la estación 1.
|
Filum |
Clase |
Orden |
Familia |
Género y Especie |
Estación 1 (organismo/m2) |
Categorías tróficas |
Tolerancia a la polución |
|||||
|
M1 |
M2 |
M3 |
M4 |
Promedio |
Porcentaje (%) |
|||||||
|
Artrópoda |
Insecta |
Efemeróptera |
Baetidae |
Camelobaetidius kondratieffi |
112 |
38 |
172 |
540 |
216 |
30,4 |
Colector-raspador |
Tolerante |
|
Baetis tricaudata |
57 |
19 |
86 |
269 |
108 |
15,2 |
Colector-raspador |
Tolerante |
||||
|
Tricorythidae |
Tricorythodes sp |
38 |
28 |
8 |
14 |
22 |
3,1 |
Colector-fragmentador |
Tolerante |
|||
|
Díptera |
Psychodidae |
Psychoda sp |
0,0 |
Colectores-detritivoro |
Resistente |
|||||||
|
Syrphidae |
Eristalis tenax |
0,0 |
Colectores-detritivoro |
Resistente |
||||||||
|
Simulidae |
Simulium sp |
187 |
62 |
46 |
108 |
101 |
14,2 |
Colector-filtrador |
Tolerante |
|||
|
Tipulidae |
Tipula sp |
1 |
0 |
1 |
0 |
1 |
0,1 |
Colector-fragmentador |
Tolerante |
|||
|
Ceratopogonidae |
Probezzia sp |
0 |
0 |
0 |
2 |
1 |
0,1 |
N.I |
Tolerante |
|||
|
Muscidae |
Limnophora sp |
0 |
12 |
2 |
8 |
6 |
0,8 |
Colector-detritivoros |
Tolerante |
|||
|
0,0 |
Colector-detritivoros |
Resistente |
||||||||||
|
Culicidae |
Culex sp |
18 |
15 |
5 |
8 |
12 |
1,7 |
Colector-filtrador |
Resistente |
|||
|
Chironomidae |
Chironomus sp (b) |
9 |
138 |
43 |
65 |
64 |
9,0 |
Colector-detritivoros |
Resistente |
|||
|
Chironomus sp (r) |
62 |
71 |
237 |
146 |
129 |
18,1 |
Colector-detritivoros |
Resistente |
||||
|
Chironomus sp (vm) |
8 |
34 |
11 |
0 |
13 |
1,8 |
Colector-detritivoros |
Resistente |
||||
|
Coleóptera |
Dytiscidae |
Dytiscus marginalis |
1 |
0 |
1 |
0 |
1 |
0,1 |
Depredador |
Tolerante |
||
|
Elmidae |
Stenelmis sp |
0 |
0 |
1 |
2 |
1 |
0,1 |
Colector-fragmentador |
Tolerante |
|||
|
Macrelmis sp |
0 |
1 |
0 |
3 |
1 |
0,1 |
Colector-fragmentador |
Tolerante |
||||
|
Megalóptera |
Corydalidae |
Corydalus sp |
0 |
0 |
1 |
2 |
1 |
0,1 |
Depredador |
Tolerante |
||
|
Tricóptera |
Hydroptilidae |
Hidroptila sp |
42 |
3 |
0 |
5 |
13 |
1,8 |
Colectores-raspadores |
Tolerente |
||
|
Hydropsychidae |
Smicridea sp |
0 |
0 |
3 |
2 |
1 |
0,1 |
Fragmentador |
Tolerente |
|||
|
Hydrobiosidae |
Atopsyche sp |
0 |
0 |
0 |
1 |
1 |
0,1 |
Depredador |
Tolerente |
|||
|
Polycentropodidae |
Polycentropus sp |
0 |
5 |
19 |
11 |
9 |
1,3 |
Depredador |
Tolerente |
|||
|
Philopotamidae |
Chimarrhodella sp |
0 |
1 |
0 |
0 |
1 |
0,1 |
N.I |
Tolerente |
|||
|
Mollusca |
Gastropoda |
Hygrophila |
Physidae |
Physa acuta |
0 |
0 |
4 |
8 |
3 |
0,4 |
Colectores-raspadores |
Resistente |
|
Annellida |
Oligochaeta |
Haplotaxida |
Lumbricidae |
Eisenia foetida |
0 |
0 |
2 |
0 |
1 |
0,1 |
Colectores-Detritivoros |
Resistente |
|
Tubificidae |
Tubifex sp |
0 |
0 |
17 |
3 |
5 |
0,7 |
Colectores-Detritivoros |
Resistente |
|||
|
3 |
3 |
7 |
19 |
23 |
535 |
427 |
659 |
1197 |
711 |
100,0 |
26 |
26 |
Cuadro 2. Taxonomía, categoría y tolerancia de los macroinvertebrados bentónicos colectados en la estación 2.
|
Filum |
Clase |
Orden |
Familia |
Género y Especie |
Estación 2 (organismo/m2) |
Categorías tróficas |
Tolerancia a la polución |
|||||
|
M1 |
M2 |
M3 |
M4 |
Promedio |
Porcentaje (%) |
|||||||
|
Artrópoda |
Insecta |
Efemeróptera |
Baetidae |
Camelobaetidius kondratieffi |
Colector-raspador |
Tolerante |
||||||
|
Baetis tricaudata |
Colector-raspador |
Tolerante |
||||||||||
|
Tricorythidae |
Tricorythodes sp |
Colector-fragmentador |
Tolerante |
|||||||||
|
Díptera |
Psychodidae |
Psychoda sp |
315 |
233 |
663 |
1335 |
637 |
4,0 |
Colectores-detritivoro |
Resistente |
||
|
Syrphidae |
Eristalis tenax |
111 |
53 |
138 |
377 |
170 |
1,1 |
Colectores-detritivoro |
Resistente |
|||
|
Simulidae |
Simulium sp |
Colector-filtrador |
Tolerante |
|||||||||
|
Tipulidae |
Tipula sp |
Colector-fragmentador |
Tolerante |
|||||||||
|
Ceratopogonidae |
Probezzia sp |
N.I |
Tolerante |
|||||||||
|
Muscidae |
Limnophora sp |
Colector-detritivoros |
Tolerante |
|||||||||
|
90 |
0 |
74 |
222 |
97 |
0,6 |
Colector-detritivoros |
Resistente |
|||||
|
Culicidae |
Culex sp |
Colector-filtrador |
Resistente |
|||||||||
|
Chironomidae |
Chironomus sp (b) |
Colector-detritivoros |
Resistente |
|||||||||
|
Chironomus sp (r) |
273 |
173 |
115 |
173 |
184 |
1,2 |
Colector-detritivoros |
Resistente |
||||
|
Chironomus sp (vm) |
Colector-detritivoros |
Resistente |
||||||||||
|
Coleóptera |
Dytiscidae |
Dytiscus marginalis |
Depredador |
Tolerante |
||||||||
|
Elmidae |
Stenelmis sp |
Colector-fragmentador |
Tolerante |
|||||||||
|
Macrelmis sp |
Colector-fragmentador |
Tolerante |
||||||||||
|
Megalóptera |
Corydalidae |
Corydalus sp |
Depredador |
Tolerante |
||||||||
|
Tricóptera |
Hydroptilidae |
Hidroptila sp |
Colectores-raspadores |
Tolerente |
||||||||
|
Hydropsychidae |
Smicridea sp |
Fragmentador |
Tolerente |
|||||||||
|
Hydrobiosidae |
Atopsyche sp |
Depredador |
Tolerente |
|||||||||
|
Polycentropodidae |
Polycentropus sp |
Depredador |
Tolerente |
|||||||||
|
Philopotamidae |
Chimarrhodella sp |
N.I |
Tolerente |
|||||||||
|
Mollusca |
Gastropoda |
Hygrophila |
Physidae |
Physa acuta |
Colectores-raspadores |
Resistente |
||||||
|
Annellida |
Oligochaeta |
Haplotaxida |
Lumbricidae |
Eisenia foetida |
10 |
1 |
9 |
11 |
8 |
0,1 |
Colectores-Detritivoros |
Resistente |
|
Tubificidae |
Tubifex sp |
14288 |
13450 |
15721 |
16087 |
14887 |
93,1 |
Colectores-Detritivoros |
Resistente |
|||
|
3 |
3 |
7 |
19 |
23 |
15087 |
13910 |
16720 |
18205 |
15983 |
100 |
26 |
26 |
Los cuadros 1 y 2 muestran las órdenes de macroinvertebrados encontrados en los distintos puntos muestreados en ambas estaciones; la estación 1, posee indicadores de aguas moderadamente contaminadas y bien oxigenadas [5], [13], siendo las más representativas, Díptera, Ephemeroptera y Tricoptera, pertenecientes a la clase insecta; los géneros más representativos de los macroinvertebrados bentónicos en esta estación, fueron: Camelobaetidius 30,4 %, Chironomus sp con un 28,9 %, Baetis 15,2 % y Simulium 14,2 %. Camelobaetidius, Baetis y Simulium sp, mientras que en los puntos muestreados de la estación 2, se registraron indicadores de aguas fuertemente contaminadas, con alta polución orgánica, siendo la más representativa, la presencia del orden díptera de la familia Chiromomidae; los géneros que destacan fueron: Tubifex sp con un 93 %, Psichoda sp 4 % y Chironomus sp 1 %, esto demuestra que zonas cercanas a poblaciones están siendo impactadas por la actividad humana a diferencia de las zonas altas que tienen menor contaminación [8].
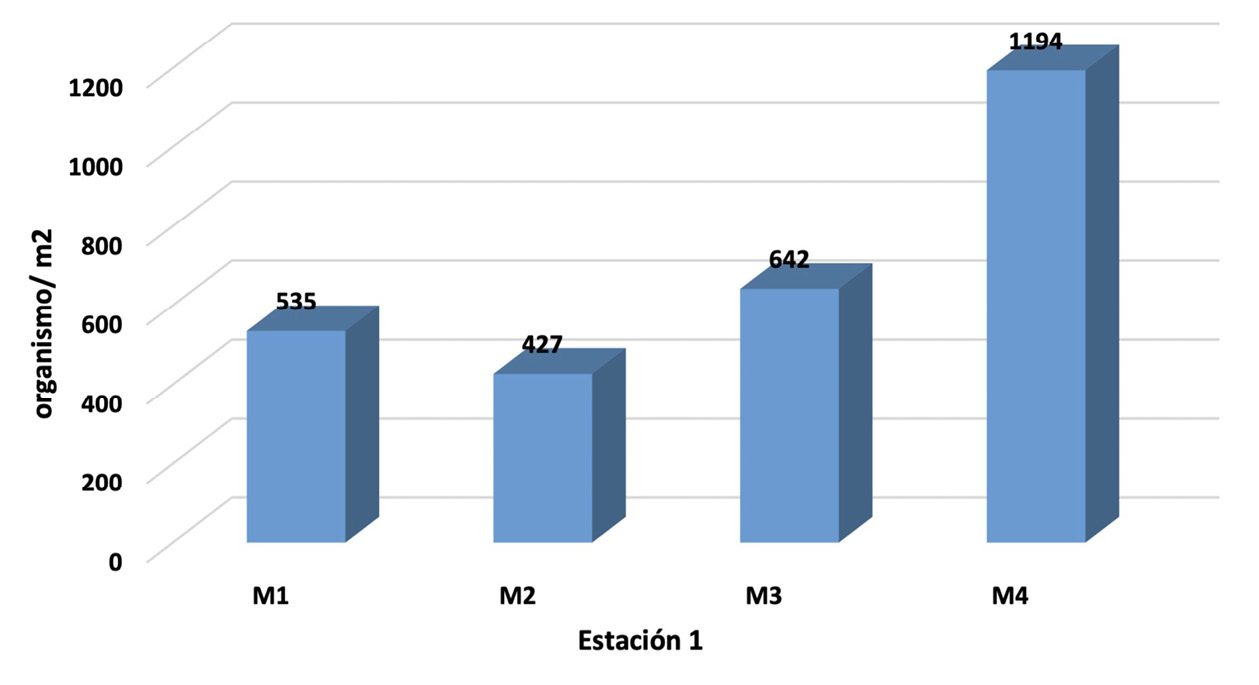
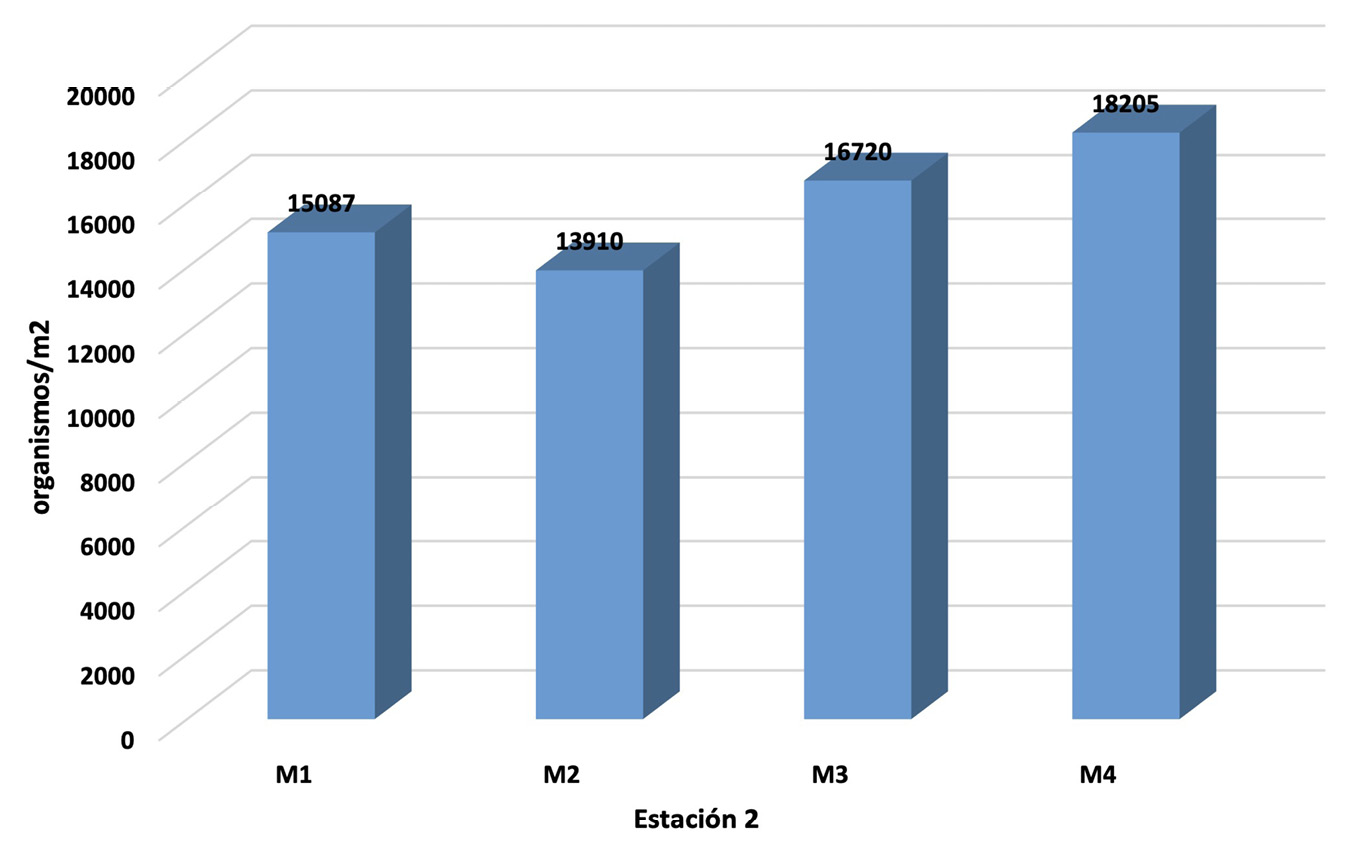
Figura 2. Macroinvertebrados bentónicos colectados en la estación 1 y 2.
En relación a los puntos de colecta de macroinvertebrados bentónicos en ambas estaciones (figura 2), se observa un ligero ascenso en los tres primeros muestreos y un elevado ascenso en el último muestreo, esto debido a que las muestras se realizaron en los períodos secos y lluvioso, la estación 1, muestra una calidad de agua moderadamente contaminada, según el Índice Biótico Grupo de Trabajo de Monitoreo Biológico «IBMWP”, debido al orden y genero del microorganismo encontrado, con una variación de entre 427 a 1194 organismos/m2. En la estación 2, se observa una variación de entre 13910 a 18205 organismos/m2 colectados, determinantes de una calidad de agua promedio muy crítica y fuertemente contaminada.
Cuadro 3. Índices determinados de las familias de macroinvertebrados bentónicos en la estación 1 y 2.
|
E1 |
E2 |
|||||||||
|
M1 |
M2 |
M3 |
M4 |
Promedio |
M1 |
M2 |
M3 |
M4 |
Promedio |
|
|
BMWP |
36 |
57 |
70 |
76 |
59,75 |
11 |
9 |
11 |
11 |
10,50 |
|
EPT |
46,50% |
22% |
43,70% |
70,30% |
45,6% |
0% |
0% |
0% |
0% |
0% |
|
Diversidad Shannon - Wiener (H´) |
1,54 |
1,38 |
1,33 |
1,08 |
1,33 |
0,28 |
0,18 |
0,28 |
0,48 |
0,31 |
|
Riqueza de Margalef (Dmg) |
1,59 |
2,15 |
2,77 |
2,68 |
2,30 |
0,52 |
0,43 |
0,51 |
0,51 |
0,49 |
|
Equidad de Pielou (J´) |
0,64 |
0,54 |
0,46 |
0,37 |
0,50 |
0,16 |
0,11 |
0,16 |
0,27 |
0,18 |
|
Dominancia de Berger-Parker (B) |
0,21 |
0,09 |
0,26 |
0,45 |
0,25 |
0,95 |
0,97 |
0,94 |
0,88 |
0,94 |
|
Dominancia de Simpson (ƛ) |
0,26 |
0,37 |
0,35 |
0,5 |
0,37 |
0,9 |
0,94 |
0,89 |
0,79 |
0,88 |
A partir de los estudios realizados, se obtuvieron los valores del cuadro 3, donde se evalúa la calidad de agua; el indicador de % EPT en la estación 1 y 2, presenta un promedio de 45,6 % y 0 %, la presencia de estos individuos de los grupos Ephemeroptera y Tricoptera son indicadores de bajos impacto antrópico [7], [16], tal como se observa en la primera estación, mientras que, porcentajes menores, denotan elevada contaminación, propio de la segunda estación. El índice de diversidad (H) tuvo un promedio de 1,33 y 0,31respectivamente en ambas estaciones, es decir este índice es bajo [8], en cambio el índice de diversidad de Shannon-Wiener se encuentra en término medio con un valor de 1,33 y 0. La riqueza de Margalef promedio en la estación 1, fue de 2,30 determinándose que es una zona de mediana diversidad y la estación 2, fue de 0,50 determinándose zona de baja diversidad; en cuanto a la Dominancia de Berger-Parker y Simpson sólo en la estación 2 se presentaron taxones dominantes (valores mayores que 0,55) con un promedio de 0,94 a 0,88, indicador de alta contaminación del agua. En la estación 1, no hubo presencia de estos taxones obteniéndose un promedio de 0,25 a 0,37
Cuadro 4. Número de géneros por categoría o grupo trófico encontrados en la estación 1 y 2.
|
Grupo trófico |
Estación |
Total |
||
|
E1 |
E2 |
Ambos |
||
|
Colector – Detritívoro |
6 |
6 |
3 |
9 |
|
Colector – Filtrador |
2 |
0 |
0 |
2 |
|
Colector – Fragmentador |
5 |
0 |
0 |
5 |
|
Colector – Raspador |
4 |
0 |
0 |
4 |
|
Depredador |
4 |
0 |
0 |
4 |
|
No Identificador (NI) |
2 |
0 |
0 |
2 |
|
Total |
23 |
6 |
3 |
26 |
En total se colectaron 26 géneros de macroinvertebrados bentónicos (cuadro 4), para un sector del río Chotano entre los meses de agosto a octubre; 23 géneros corresponden a la estación 1 y 6 géneros corresponden a la estación 2, de los cuales 3 géneros estuvieron presentes en ambas estaciones que son colector- detritívoro. En la estación 1, lo más representativos fueron 6 géneros con grupo trófico colectores – detritívoros, seguido con 5 géneros con grupo trófico colector-fragmentador, 4 géneros son colector-raspador y depredador y 2 géneros son colector-filtrador y 2 géneros no identificado; en la estación 2 se colectaron 6 géneros con grupo trófico colector-detritívoros.
La prueba de Chi cuadrado sobre número de géneros por grupo trófico encontrados en la estación 1 y 2 en un sector del río Chotano de agosto a octubre, evidencian que existen diferencias significativas entre los dos sectores (p=0,14 > 0,05).
Cuadro 5. Prueba de Levene para los Índice Biológicos de la calidad de agua estación 1 y 2.
|
Prueba de Levene de igualdad de varianzas |
prueba t para la igualdad de medias |
|||||||||
|
F |
Sig. |
t |
Gl |
Sig. (bilateral) |
Diferencia de medias |
Diferencia de error estándar |
95% de intervalo de confianza de la diferencia |
|||
|
Inferior |
Superior |
|||||||||
|
IBMWP |
Se asumen varianzas iguales |
7,84 |
0,03 |
5,55 |
6,00 |
0,0014 |
49,25 |
8,87 |
27,55 |
70,95 |
|
No se asumen varianzas iguales |
5,55 |
3,02 |
0,0113 |
49,25 |
8,87 |
21,13 |
77,37 |
|||
|
RIQUEZA |
Se asumen varianzas iguales |
11,61 |
0,01 |
6,60 |
6,00 |
0,0006 |
1,81 |
0,27 |
1,14 |
2,47 |
|
No se asumen varianzas iguales |
6,60 |
3,04 |
0,0068 |
1,81 |
0,27 |
0,94 |
2,67 |
|||
El estadístico de Levene y la prueba t, para el índice IBMWP y la riqueza, aplicadas para evaluar la igualdad de varianzas (cuadro 5), evidencian que existen diferencias significativas entre la variabilidad de ambas estaciones en estudio (p ≤ 0,05).
Conclusiones
El índice IBMWP (índice de grupo de trabajo de monitoreo biológico) de la familia de macroinvertebrados bentónicos, en base a las cantidades encontradas en ambas estaciones, puede ser un indicador de elevada polución orgánica en la estación 2.
Los grupos encontrados de la riqueza total EPT (%) fueron representativos en la estación 2, debido a su menor porcentaje, evidenciando la presencia de materia orgánica y lodos, propio de la contaminación ambiental del agua.
Las dominancias promedio determinadas, de Berger – Parker y Simpson, fueron menores en la estación 1, mostrando mayor diversidad, indicadores de baja contaminación; sin embargo, la estación 2 muestra poblaciones con mayor dominancia, menor diversidad, indicadores de elevada polución orgánica.
El estudio de los macroinvertebrados como indicador de contaminación orgánica, es importante, porque permite evaluar la calidad del agua; pues, este líquido vital para el ecosistema, es empleado por los pobladores que habitan en las zonas bajas del río, en actividades como, regadío de plantas, bebederos para ganados y también como fuente de agua para consumo humano, además este estudio, muestra los impactos generados por la actividad humana residentes en la parte alta del río, debido a que carecen de un sistema de tratamiento de aguas residuales, yendo a parar todos los desechos producidos al mismo cauce, generando elevada contaminación.
Esta investigación permite implementar, un sistema de monitoreo constante, debido a la presencia de estos microorganismos, cuya biomasa son indicadores de calidad de las aguas, evitando posibles riesgos de salubridad en las poblaciones que hace uso de las mismas, logrando una mejor calidad de vida.
Agradecimiento
A la Dirección Sub Regional de Salud Chota – Cajamarca y su representante, Lic. Hernán Tafur Coronel, por brindarnos todas las facilidades en el uso de los equipos sofisticados y laboratorios de análisis de agua, de la Dirección Ejecutiva de Salud Ambiental.
Referencias
[1] G. Roldan, Guía para el estudio de los macroinvertebrados acuáticos del Departamento de Antioquia, Bogotá: Editorial Presencia Ltda; 2019. Available: https://docer.com.ar/doc/11ns1n
[2] A. R. Ladson, L. J. White, J. A. Doolan, B. L. Finlayson y B. T. Hard BT, “Development and testing of an Index of Stream Condition for waterway management in Australia”, Fresh Biol, Vol. 41, no. 2, pp. 453 – 468, 2017. https://doi.org/10.1046/j.1365-2427.1999.00442.x
[3] D. Pham, “Linking Benthic Macroinvertebrates and Physicochemical Variables for Water Quality Assessment in Saigon River and Its Tributaries, Vietnam”, IOP Conf. Ser.: Earth Environ. Sci. 92 012053, 2017. This content was downloaded from IP address 181.64.105.147 on 09/03/2021 at 17:30
[4] A. Barboza, C.S. Silva, S.E. Araujo, T. Lima y I. M. Dantas, “Macroinvertebrados Bentônicos como bioindicadores da qualidade da água em um trecho do rio Apodi-Mossoró”, HOLOS, vol. 32, no. 7, pp. 121 - 132. 2016. DOI: 10.15628/holos.2016.4183
[5] A. Motta, L. Ortega, Y. Niño y N. Aranguren, “Grupos funcionales alimenticios de macroinvertebrados acuáticos en un arroyo tropical (Colombia)”, Rev. U.D.C.A Act. & Div. Cient. vol. 19, no. 2, pp. 425-433, 2017. http://dx.doi.org/10.17268/sci.agropecu.2016.01.04.
[6] L. Rodríguez, P. Ríos, M. Espinoza, P. Cedeño y G. Jiménez, “Caracterización de la calidad de agua mediante macroinvertebrados bentónicos en el río Puyo, en la Amazonía Ecuatoriana”, Hidrobiológica, vol. 26, no. 3, pp. 497-507, 2016.
[7] F. Bernardo, C. Fatima, G. Betiato, G. Pasquali, P. Afonso, y M. Teresinha, “Utilização da estrutura de comunidades de macroinvertebrados bentônicos como indicador de qualidade da água em rios no sul do Brasil”, Ambient. Água, vol. 12, no. 3, pp. 416 – 426, 2017. doi:10.4136/1980-993X
[8] J. Granados-Ramírez, P. Barragán, R. Trejo y M. Martínez, “Macroinvertebrados bentónicos de dos lagos de alta montaña en el estado de Morelos, México”, Intropica, vol. 12, no. 1, pp. 41–53, 2017. https://doi.org/10.21676/23897864.2206
[9] S. López, D. Huertas, A. Jaramillo, D. Calderón y J. Diaz, “Macroinvertebrados acuáticos como indicadores de calidad del agua del río Teusacá (Cundinamarca, Colombia)”, Ingeniería y Desarrollo, vol. 37, no. 2, pp. 269–288, 2019. http://search.ebscohost.com/login.aspx?direct=true&db=zbh&AN=139093499&lang=es&site=ehost-live. Acesso em: 8 mar. 2021.
[10] S. Sabater, J. Donato, A. Giorgi y A. Elosegi, El río como ecosistema. Conceptos y técnicas en ecología fluvial, España: Fundación BBVA; pp. 23-37, 2016.
[11] D. Simeone, CH. Tagliaro y CR. Beasley, “Amazonian freshwater mussel density: A useful indicator of macroinvertebrate assemblage and habitat quality”, Ecol. Indic., vol. 122, p. 107300, 2021. doi: 10.1016/j.ecolind.2020.107300
[12] Ministerio del Ambiente, Métodos de colecta, identificación y análisis de comunidades biológicas: plancton, perifiton, bentos (macroinvertebrados) y necton (peces) en aguas continentales del Perú, Lima: UNMSM, 2017.
[13] M. Custodio y F. Chaname, “Análisis de la biodiversidad de macroinvertebrados bentónicos del río Cunas mediante indicadores ambientales, Junín-Perú”, Scientia Agropecuaria, vol. 7, no 1, pp. 33-44, 2017. https://dx.doi.org/10.17268/sci.agropecu.2016.01.04
[14] A. Palma, Guía para la identificación de invertebrados acuáticos, 2016. Available: http://www2.udec.cl/~lpalma/Palma2013_Guia_identificacion_Macroinvertebrados_preview.pdf
[15] S. Chi, S. Li, S. Chen, M. Chen, J. Zheng y J. Hu, “Temporal variations in macroinvertebrate communities from the tributaries in the Three Gorges Reservoir Catchment, China”, Revista Chilena de Historia Natural. Vol. 90, no. 6, 2017. https://doi.org/10.1186/s40693-017-0069-y
[16] A. Savic, M. Đordevic, M. Juskovic y V. Pesic, “Ecological analysis of macroinvertebrate communities based on functional feeding groups: a case study in southeastern Serbia”, Biologica Nyssana, vol. 8, no. 2, pp. 159-166, 2017.
1 Escuela de Ingeniería Ambiental, Universidad Cesar Vallejo, Chiclayo, Perú. Correo electrónico: ingcelsop@gmail.com https://orcid.org/0000-0003-1270-0402
https://orcid.org/0000-0003-1270-0402
2 Dirección Sub Regional de Salud – Chota, Perú. Correo electrónico: blgosanchez@hotmail.com https://orcid.org/0000-0002-5108-2566
https://orcid.org/0000-0002-5108-2566