Diseño de un biorreactor tipo tanque agitado para el crecimiento de Rhodococcus opacus
Design of a stirred tank type bioreactor for the growth of Rhodococcus opacus
Pablo Bogantes-Portuguez1
Fecha de recepción: 3 de mayo de 2021
Fecha de aprobación: 30 de agosto de 2021
Bogantes-Portuguez, P. Diseño de un biorreactor tipo tanque agitado para el crecimiento de Rhodococcus opacus. Tecnología en Marcha. Vol. 35-3. Julio-Setiembre 2022. Pág. 141-157. https://doi.org/10.18845/tm.v35i3.5653
https://doi.org/10.18845/tm.v35i3.5653
Palabras clave
Biorreactor; configuración modular; Rhodococcus opacus; esterilización.
Resumen
En este artículo se presenta el diseño de un biorreactor de tipo tanque agitado asistido por microcontrolador utilizando conceptos de simplicidad de uso, modularidad, estética y ergonomía, según las necesidades de la empresa Cibus 3.0. El tanque cuenta con tres partes principales tapa, dispone sus elementos según su uso; caja de sensores, dispositivo que utiliza sensores de pH, temperatura y turbidez del medio; y tanque, con una capacidad volumétrica de 21.5 L. Se acopló un vaporizador de mano genérico como método de esterilización in situ. Para evaluar la eficiencia de esterilización se realizaron muestreos superficiales en las zonas más críticas de formación de biofilms (tapa, tubos, pared, impulsor y flecha), tras fermentaciones de E. coli y R. opacus. Se demostró que la máquina de vapor no cumple con el objetivo de eliminar la contaminación, logrando una esterilización del 92%. Sin embargo, el uso de autoclave permitió el rendimiento esperado de esterilización, esto se comprobó al realizar simulaciones de fermentación con medio estéril y no presentar contaminación al finalizar el ensayo. Se determinó la posibilidad de utilizar sensores de pH, sólidos suspendidos y temperatura tomando parte del medio para cada repetición sin afectar la inocuidad del sistema. De esta manera se introduce un dispositivo capaz de tomar las mediciones por medio de microcontrolador. Con el fin de corroborar la funcionalidad del equipo diseñado, se realizaron tres fermentaciones con la bacteria R. opacus, donde se obtuvieron curvas de crecimiento validando el funcionamiento del diseño alrededor del usuario y del proceso.
Keywords
Bioreactor; modular configuration; Rhodococcus opacus; sterilization.
Abstract
This article presents the design of a microcontroller-assisted stirred tank bioreactor using concepts of simplicity of use, modularity, aesthetics, and ergonomics, according to the needs of the Cibus 3.0 company. The tank has three main parts: lid (it has its elements according to its use); sensor box (device that uses pH sensors, temperature, and turbidity of the medium); and tank (with a volumetric capacity of 21.5 L). A generic handheld vaporizer was attached as a method of in situ sterilization. To evaluate the efficiency of sterilization, surface samplings were carried out in the most critical areas of biofilm formation (lid, tubes, wall, impeller, and arrow), after fermentations of E. coli and R. opacus. The steam engine shown not to meet the goal of eliminating contamination, achieving 92% sterilization. However, the use of an autoclave allowed the expected sterilization performance, this was verified when simulating fermentation with sterile medium and not presenting contamination at the end of the test. The possibility of using pH, suspended solids and temperature sensors was determined, taking part of the medium for each repetition without contaminating of the system. In this way, a device capable of taking measurements by means of a microcontroller is introduced. To corroborate the functionality of the designed equipment, three fermentations were carried out with the R. opacus bacteria, where growth curves were obtained validating the operation of the design around the user and the process.
Introducción
CIBUS 3.0 es un emprendimiento que desarrolla microorganismos modificados genéticamente para facilitar la conversión de subproductos derivados de la agroindustria, en productos con valor agregado; por ejemplo, el uso de la bacteria Rhodococcus opacus PD630 como plataforma de producción de biodiésel a partir de suero lácteo. Para este fin se seleccionan y optimizan las rutas metabólicas más eficientes y convenientes, para su posterior aplicación a escala industrial. El escalamiento de dicho bioproceso implica la necesidad de diseñar un biorreactor con una configuración modular, capaz de monitorear las condiciones de crecimiento de forma automatizada, para facilitar la optimización del proceso de fermentación y la evaluación de la eficiencia de estas fermentaciones a una escala mayor.
La base de esta actividad económica es el proceso de fermentación, donde se consumen compuestos de alto valor energético (azúcares), obteniéndose sustancias simples, útiles para el metabolismo, por ejemplo, ácidos, gases y alcoholes [1]–[4]. Entre otras aplicaciones se encuentran la remoción de componentes indeseados [3] como por ejemplo reducción de Cr (VI) a Cr (III) en agua residual industrial [5], el consumo de fenantreno [6] y pesticidas [7], [8] por bioaumentación de microorganismos autóctonos y la producción de compuestos de alto valor económico como la vainillina [9], [10], ácido cítrico [11], [12], ácido glutámico [13], [14] e inhibidores enzimáticos [15].
Dentro de los parámetros que influyen en la eficiencia de los procesos de fermentación, y que por lo tanto deben ser controlados, se incluye el oxígeno disuelto [16], la temperatura [17], el pH [18], la composición del medio [19], la osmolaridad y la agitación [20]. Adicionalmente, se monitorean variables de respuesta como el crecimiento de biomasa, el rendimiento de producción del metabolito de interés y el consumo de sustrato [21]. Mientras avanza la investigación en este tema, se vuelve evidente la relevancia de aspectos como la estandarización, la optimización del rendimiento y la reducción en los costos [21]–[23].
Los procesos de fermentación se pueden llevar a cabo bajo tres modos de operación [24] cuya diferencia recae principalmente en la disposición del medio nutritivo durante el bioproceso [25]. Estas estrategias de producción corresponden a la alimentación discontinua también conocida como batch process (se realiza una única alimentación previa al bioproceso) [26], operación semicontinua o fed-batch (su alimentación posee una fuerte etapa previa seguida de aportes durante la fermentación) [27] y la continua o continuous process (presenta un flujo constante de medio durante todo el bioproceso) [28]. Estos sistemas cuentan, además, con métodos para su homogenización, mecanismos de agitación (tanque agitado) y de columnas dispensadoras de oxígeno sin agitación (airlift o columna de burbujas) [14], [29].
Rhodococcus opacus PD630 será utilizado como microorganismo de estudio para validar el funcionamiento del biorreactor diseñado. Rhodococcus es una bacteria, que se describe como nocardioformo aerobio, Grampositivo, no móvil, que contiene estructuras micelares [30], [31]. Este género se conoce por su capacidad de biorremediación [32], [33]. Además, es una plataforma biológica de producción para diversos productos en la industria [34], [35]. En específico R. opacus presenta la capacidad de degradar compuestos aromáticos, furanos y ácidos orgánicos. Se ha demostrado que es capaz de acumular triacilglicéridos (TAG) y moléculas precursoras de biodiésel [36], [37].
Este artículo tiene por objetivo el diseño y construcción de un biorreactor tipo tanque agitado para el crecimiento de R. opacus PD630 como organismo de interés, además de evaluar su funcionamiento en términos de capacidad de monitoreo de variables de flujo y agitación.
Metodología
Diseño y construcción
Se diseñó y construyó un biorreactor con una capacidad volumétrica total de 21.5 L. Para esto, los requerimientos del emprendimiento se resumen en los principios de: simplicidad de uso, modularidad, estética y ergonomía, las cuales se agruparon bajo el concepto de principios del diseño. Con el fin de desglosar el proceso, el biorreactor se clasificó en tres partes: tanque, tapa y dispositivo de medición de factores múltiples (DMFM).
Tanque del biorreactor
El diseño teórico del tanque se basó en la fórmula del volumen del cilindro, empleando 250 mm de diámetro. En función del diámetro, el volumen especificado se completó al asignar una altura de 500 mm, esto para cumplir con un espacio libre mínimo del 20% y una proporción de 1.6 (altura del medio/diámetro). Dada la necesidad de eliminar ángulos de 90°, la geometría del tanque, inicialmente cilíndrica, cambió a un fondo semiesférico. Esta variación implicó una reducción de 50 mm en la altura, para un valor final de 450 mm. Para la construcción del tanque y todas sus piezas, se empleó acero inoxidable 316L de 5 mm, además, se procuró que contara con esquinas redondeadas y paredes internas pulidas con un acabado de grado alimenticio. En la sección inferior del tanque se incorporó una válvula check de cobre con una boquilla personalizada, para el uso de un vaporizador de mano genérico importado de Los Estados Unidos, como propuesta de proceso de esterilización. Para facilitar la limpieza se colocó un desagüe en el fondo del tanque, el cual es un orificio de 10 mm con un tornillo para su cierre.
Tapa
Se diseñó una tapa de 310 mm de diámetro con 5 mm de grosor; dos perforaciones especiales para la trampa de gas 15 mm y para la termocupla de 25 mm. Asimismo, seis perforaciones de 10 mm de diámetro para la incorporación de los elementos requeridos para el funcionamiento del biorreactor: válvula de presión (forma segura de liberar la presión acumulada durante la esterilización propuesta), entrada y reincorporación de medio para su conexión con el DMFM, termo pozo, tubos auxiliares, flecha personalizable, mamparas y difusor de aire.
La configuración de la tapa fue determinada por los principios del diseño mencionados anteriormente. Estos se ven plasmados en la disposición espacial de cada uno de los elementos presentes, tanto sensores como flujos de entrada y salida de material. Así, en la tapa se delimitaron tres sectores donde se dispusieron cada uno de los elementos según su relación con el usuario y con el DMFM.
Para distribuir los elementos de cada sector, maximizando la distancia entre ellos, se usó la Ecuación 1.
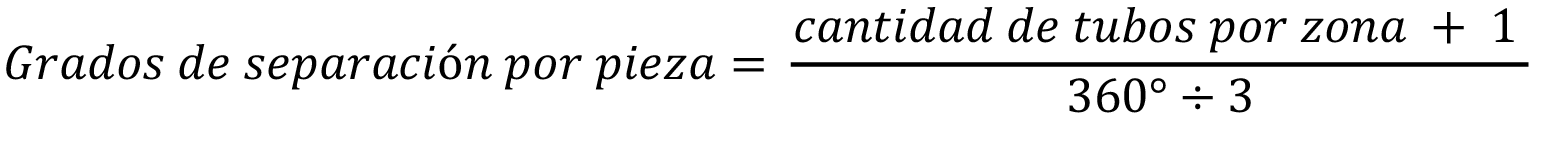
Ecuación 1. Distancia en grados por pieza en cada sector.
Descripción de las piezas en la tapa:
•Mamparas: se incorporaron tres mamparas de acero inoxidable 316L rodeadas de una pieza sólida de teflón con el fin de eliminar la posibilidad de fugas. Su ángulo es ajustable y posee un área superficial de .
•Flecha: para conservar mayor personalización, la flecha presenta un largo genérico de 360 mm con 13 mm de diámetro. Se conectó con un sistema de rodamientos a un acople Lovejoy® tipo L-Jaw con araña de hule. En ella se ajustaron los impulsores por medio de un tornillo sin cabeza. Se opera por un motor de 110 V de potencia.
•Impulsores: se cuenta con dos impulsores, tipo propela marina, individuales y removibles de acero inoxidable. El diámetro de cada uno es de 125 mm, lo que representa la mitad del ancho del tanque.
•Difusor: se colocó un difusor de aire en forma de L de 500 mm de largo, con orificios a lo largo con una separación de 7.5 mm en el eje horizontal (que consta de 173.36 mm), presentes debajo del impulsor. El ingreso de aire se da por medio de una manguera con un filtro miliporo de 0.22 µm (Membrane Solutions Corp), permitiendo la introducción de aire ambiental filtrado.
•Tubos: se incorporaron tubos de acero inoxidable 316L de 5 mm de grosor con tres dimensiones diferentes (300 mm, 200 mm y 20 mm de largo). En la tapa, se presenta un tubo de 300 mm para salida de medio, dos tubos de 200 mm extensibles por medio de mangueras adicionales y tubos de 20 mm con un cono truncado de punta, diseñados para la adición controlada de sustancias.
DMFM
Se construyó un dispositivo de medición de factores múltiples (DMFM), externo al tanque. La construcción del DMFM se basó en una caja de aluminio con esquinas redondeadas. Además, se utilizaron empaques del estilo o’ring a la medida para poder introducir cada uno de los sensores a presión. Los sensores de pH, turbidez del medio y temperatura fueron conectados a un Arduino Mega 2560 REV 3, dispositivo en el cual se ejecutan las lógicas necesarias para llevar el control de la reacción respectiva, la toma de datos y el monitoreo del funcionamiento. Este dispositivo fue equipado con bombas peristálticas impulsadas con un motor tipo Stepper (24 V y 30 W, para un flujo desde 0 – 400 ml/min), con el fin de facilitar la transferencia del medio de cultivo desde el tanque.
Sensores
Las pruebas relacionadas con la calibración de los sensores se realizaron por medio del DMFM, donde se recopilaron los datos y se ajustaron a comportamientos esperados, como se detalla a continuación:
Sensor de pH
El sensor utilizado fue la versión genérica del EZO Class pH, presente en el Kit Atlas Scientific, con controlador para Arduino. Para calibrar el pHmetro, se utilizaron patrones estándar de buffers con pH 4, 10 y 7. Se realizaron mediciones seriales por segundo y se ajustó la sensibilidad del instrumento con una perilla incorporada en la tarjeta que conecta el sensor con el Arduino.
Sensor de transmitancia
Se empleó el sensor de transmitancia marca DFRobot Gravity® con controlador para Arduino, importado de Estados Unidos. Su registro es de partículas en suspensión o Total Suspended Solids (TSS), el cual es un valor directamente proporcional al crecimiento de biomasa. Se verificó comparando los datos obtenidos durante el crecimiento de R. opacus y datos capturados por medio de medición de absorbancia, realizada durante las fermentaciones descritas más adelante.
Sensor de temperatura
El sensor de temperatura utilizado es la versión sumergible, modelo DS18B20, de SparkFun® de rango -55 °C a 125 °C con una fidelidad de ± 0.5 °C dentro del rango -10 °C a 85 °C. La verificación de su funcionamiento constó de mediciones constantes por parte del Arduino, contra mediciones tomadas a mano desde el termo pozo del biorreactor durante 15 min. Para estas mediciones, se usó un termómetro de inmersión graduado estándar.
Optimización del proceso de esterilización
Se realizó una fermentación con un cultivo de R. opacus y otro de E. coli en 15 L de agua con azúcar de mesa Doña María® a una concentración 20 g/L durante tres días con 3 repeticiones. Posteriormente se aplicó el procedimiento de limpieza y esterilización, el cual constó de tres fases: Limpieza gruesa, Exposición Química y Exposición a factores físicos. Para la Limpieza gruesa, se utilizó Jabón Lavatrastes Axion antigrasa en formato líquido, cubriendo todas las superficies y posteriormente se restregó. En la Exposición Química, el tanque se roció con el desinfectante Swipol® Amonio Cuaternario de cuarta generación, a una proporción 1:20 en agua. Por último, para la Exposición a factor físico, el biorreactor se expuso a vapor de agua durante 50 min (dos ciclos de 25 min cada uno) aproximadamente 200 ml por ciclo empleando un vaporizador de mano genérico.
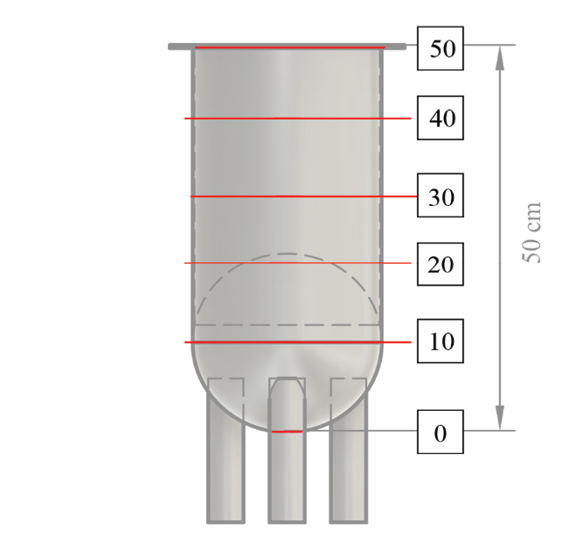
Figura 1. Esquema de alturas de control de temperatura.
Durante la exposición al vapor, se monitoreó la temperatura, cada 5 min, en diferentes alturas del tanque, con un termómetro de escala estándar en la parte externa. Se marcó, tomando la base del tanque como punto de inicio, donde se colocaron 4 puntos cada 10 cm hasta llegar a la tapa (figura 1).
Muestreo superficial
Con una plantilla hecha con cinta de enmascarar de 5 cm2 se muestreó el tubo, la pared, el impulsor, la tapa y la flecha, antes y después del proceso de esterilización, en aquellos puntos donde se observó mayor deposición de microorganismos. Las muestras se recuperaron con una tundra estéril previamente remojado en 1 ml de buffer de fosfatos (PBS) 0.1 M. Cada muestra se resuspendió en 10 ml de PBS agitando durante 1 min. Finalmente, se prepararon diluciones seriadas (10-5) que fueron plaqueadas por triplicado; las placas se incubaron a 30 °C.
Uso del tanque
Montaje del tanque
En cuanto a la preparación previa al montaje, el procedimiento inició tomando en cuenta los requerimientos de cada una de las piezas con el fin de brindar una vida útil mayor al biorreactor. Así, las piezas sensibles a temperatura (mangueras usadas por las bombas peristálticas y el adaptador del sensor de transmitancia) se colocaron previamente en cloro al 30%, overnight. Para las piezas resistentes a la temperatura (autoclavables), se realizó el proceso de autoclavado. Las mangueras autoclavables se seleccionaron con el cumplimiento de los estándares de la FDA (fda 21 cfr 177.2600), según el fabricante.
Se acoplaron todas aquellas mangueras que interactúan con el medio al biorreactor, previo al proceso de esterilización. Estas piezas corresponden a las mangueras de extracción del DMFM y la manguera de introducción del medio en los acoples de la tapa, mencionados en la sección anterior sobre las piezas de la tapa. Luego, se esterilizó el DMFM con la manguera de introducción (conectado a la manguera propia de la bomba peristáltica) y con la manguera de salida (conectado al tanque durante el montaje); ambas se instalaron previo al proceso de autoclavado. Para cada una de estas piezas se usó papel aluminio para proteger los extremos. De igual manera, se autoclavó la botella de toma de muestra y el adaptador del difusor de aire. El medio de cultivo se esterilizó por aparte, en una botella Pyrex®™ de 20 L. y luego se conectó a la tapa por medio de la tapa personalizada (figura 2) para el tanque con la manguera de silicón, y se aseguró con prensas.
Para proceder con el montaje, se tomó la botella con el medio de cultivo autoclavado y, en caso de ser requerido, se le agregó el inóculo. Luego se conectó a la manguera de la bomba peristáltica previamente bañada en alcohol de 95% v/v, con un mechero dentro del área aséptica. Este procedimiento se realizó para la conexión del DMFM, la botella de toma de muestra y el adaptador del difusor de aire. Seguidamente se colocaron filtros en los extremos expuestos de las tapas personalizadas.
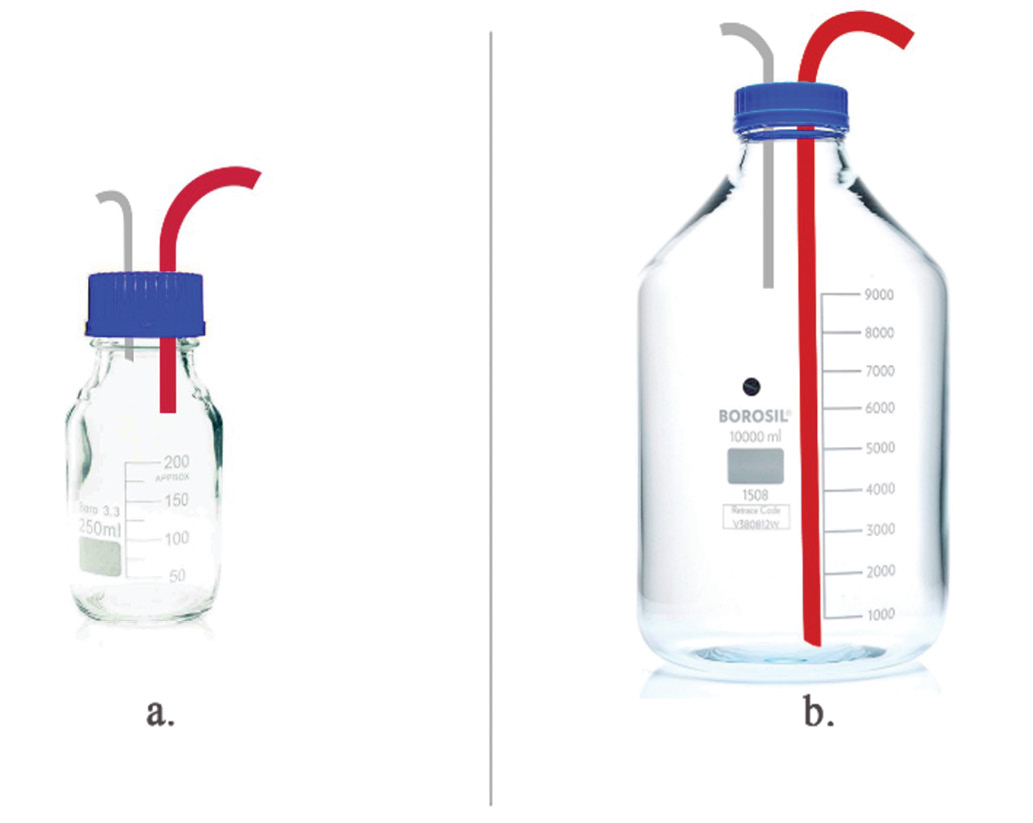
Figura 2. Ilustración de tapas personalizada. a. Toma de muestra; b. Botella de medio.
Para finalizar, se acoplaron las bombas peristálticas e inició el sistema de ingreso del medio previamente inoculado. Una vez terminado el llenado del tanque, se procedió a instalar el difusor de aire, y el DMFM para iniciar el sistema completo.
Desmontaje del bioproceso
Para el desmontaje, primero se detuvo el sistema DMFM, la agitación, la aireación y la ventilación del motor. Seguidamente, se abrió el desagüe de la parte inferior del tanque, para extraer toda la fermentación y, una vez vaciado el tanque, se lavó para su almacenaje como se describió en limpieza gruesa.
Simulación de un bioproceso
Se preparó el tanque como ha sido indicado en la sección anterior, con 10 L de agua con azúcar (50 g/L) como medio de cultivo, sin inóculo. Además, se preparó un cultivo de 100 ml de E. coli y otro de 100 ml de R. opacus, utilizando una colonia de placa brindada por la empresa. Transcurridos 3 días, se verificó visualmente la ausencia de crecimiento dentro del tanque y el crecimiento de los cultivos de E. coli y R. opacus. Se realizaron tres repeticiones del experimento.
Bioproceso
Se preparó un inóculo de 15 ml utilizando medio definido con buffer de fosfatos (phosphate-buffered defined medium; PBD) [38] que fue inoculado con 1 ml de R. opacus en glicerol (20% v/v) a 28 °C. Luego de incubar overnight, este inóculo fue aforado a 150 ml y se repitió la incubación a 28 °C. Posteriormente, se aforó hasta un volumen de 1.5 L, seguido de una última incubación a temperatura ambiente. A partir de este inóculo, se realizó una fermentación de 15 L, empleando como medio de cultivo agua suplementada con azúcar (40 g/L). La fermentación se llevó a cabo durante 5 días y se realizaron tres repeticiones. Se tomaron muestras dos veces al día, a las 8:00 y a las 20:00 h durante el tiempo de fermentación, empezando por tiempo 0. Se determinó la densidad óptica a las muestras, por medio del espectrofotómetro UV/VIS Spectrophotometer T6U® a una longitud de onda de 660 nm.
Resultados y discusión
Diseño y construcción
El diseñó se basó en la necesidad establecida por la empresa (Cibus 3.0). Para esto se usó el concepto de modularidad que le permite al sistema agilidad frente a los cambios y ahorro en altos costos debido a nuevos ajustes [39], [40]. En total el equipo cuenta con tres módulos ajustables e independientes entre sí, estandarizados para su reemplazo: el tanque, la tapa y el DMFM.
Tanque
Se decidió diseñar el equipo en acero 316L ya que es un material utilizado en el procesamiento de alimentos, cuenta con resistencia a temperatura hasta 450 °C y mayor rendimiento en acabados por soldadura (Australian Stainless Steel Development Association (ASSDA)[41]). El diseño se consolidó en un cilindro con fondo semiesférico para eliminar las esquinas donde inicialmente fue plano (figura 3) esto con el fin de facilitar la construcción y permitir mayor flujo dentro del tanque. Con un volumen total de 21.5 L, el tanque tiene una altura de 414.74 mm y un diámetro de 249.74 mm (figura 4). Este cálculo se rige por la relación 1.6 necesaria para promover un mayor contacto con el oxígeno entrante en el medio [42].

Figura 3. Medidas teóricas previo a la construcción(mm).
Además, la relación facilita la transferencia de calor durante el proceso, debido a que cuanto mayor sea la relación de altura y diámetro, mayor será el área de transferencia de temperatura [43], [44]. El volumen de trabajo (17 L) abarca un 80% del volumen total de biorreactor. El restante 20% de espacio es recurrente en los biorreactores para que, en caso de formación de espuma, no llegue a la tapa inmediatamente [43].
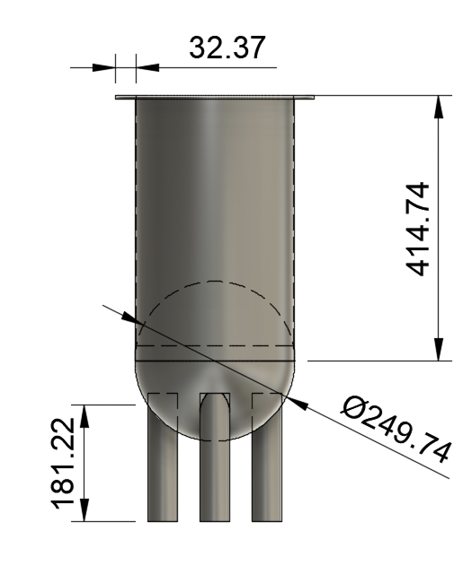
Figura 4. Dimensiones (mm) finales del biorreactor una vez construido.
Tapa
Los elementos dentro de la tapa se distribuyeron por medio de la Ecuación 1, lo que permitió aprovechar al máximo el espacio entre cada uno de los componentes, como se observa en la figura 5, brindándole al usuario el mayor espacio posible para manipular cada una de las conexiones del sistema.
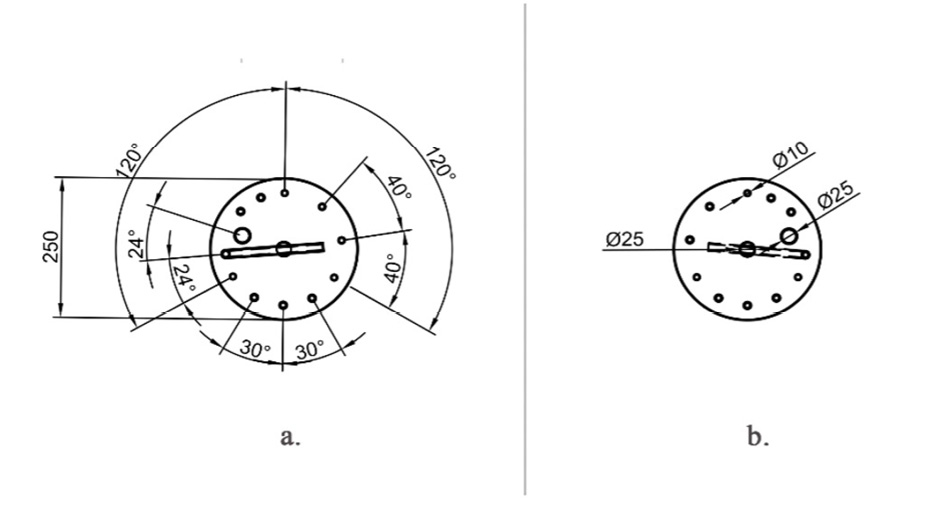
Figura 5. Dimensiones (mm) de la tapa: a. Distribución espacial de los elementos de la tapa. b. Medidas de elementos de la tapa.
Como parte de los principios del diseño, el entendimiento del proceso es crucial para un diseño basado en los usuarios [45], por lo que la distribución espacial de las piezas en la tapa se divide en 3 zonas de interacción con el usuario:
i.Alta relación con el DMFM (Fig. 6 (a)); este sector se caracteriza por contar con aquellas entradas y salidas que tienen contacto con el microcontrolador. Estas partes comparten la cualidad de ser instaladas y no volverse a modificar durante la corrida. Se colocaron los elementos que requieren de una conexión por medio de mangueras a una bomba peristáltica y el termo pozo.
ii.Alta relación con el usuario (Fig. 6 (b)); esta disposición del espacio posee aquellas partes donde el usuario puede intervenir, y donde tiene mayor acceso. Estas partes son manipulables por el usuario al menos una vez durante la corrida, de esta manera la intervención será segura. Se situaron los tubos internos correspondientes a la toma de muestra, un puerto de adición y un tubo auxiliar.
iii.Contacto mínimo (Fig. 6 (c)); estas piezas fungen como elementos completamente independientes cuya manipulación no es recomendable. Se ubicó la válvula de seguridad para expulsar la presión. Además, se incorporó un orificio en la tapa con forma de tuerca, donde se ajusta a una trampa de gas comercial distribuida principalmente en tiendas de producción casera de cerveza.
Esta estructuración de los elementos de la tapa permitió mayor facilidad para la manipulación del biorreactor, debido a la cercanía de los elementos al microcontrolador. De esa manera se cuenta con mayor orden en las conexiones electrónicas. Por otro lado, el diseño de las alturas de los tubos de la tapa (figura 7) permiten un funcionamiento correcto de los elementos del tanque en conjunto al microcontrolador. Esta configuración inicial, sin embargo, debido al modularidad del sistema es reemplazable por un sistema nuevo. Permitiendo tener respuesta ante las necesidades de la empresa.
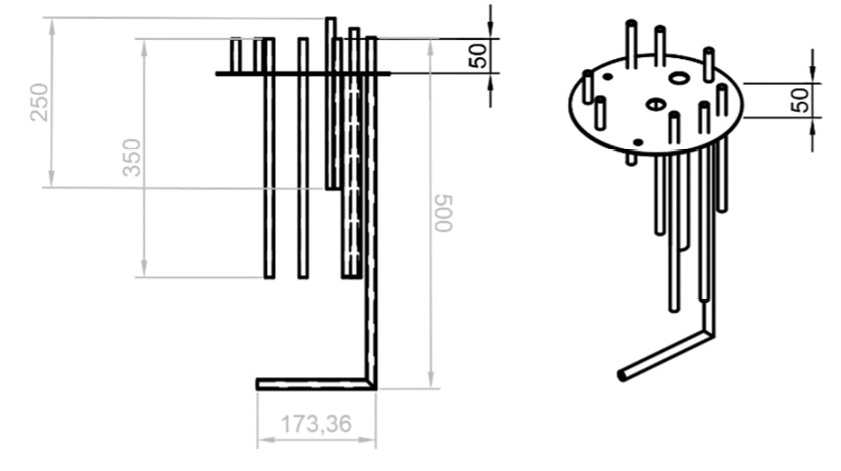
Figura 7. Dimensiones (mm) de la tapa: a. Longitud de los tubos en la tapa. b. Vista ortogonal: distribución de los elementos verticales en la tapa.
DMFM
Su construcción se basó en la durabilidad del sistema completo siguiendo los principios del diseño. Para esto, se construyó un módulo de menor costo (figura 8) donde se encuentren las piezas con menor resistencia y durabilidad, con el fin de evitar eliminar por completo el producto en caso de reemplazo de un sensor descontinuado.
En otras áreas se ha evaluado el concepto de modularidad como herramienta para vencer la obsolescencia, por ejemplo, Hirose & Mishima [46], analizan el concepto de modularidad tomando en cuenta las actualizaciones que conlleva un producto y el peso de las preferencias del usuario frente a la obsolescencia. Como solución, se planteó enfocar este factor en piezas individuales distribuyendo los procesos en cada una de las partes del biorreactor (Fermentación, Tanque; Control de Condiciones, DMFM; Configuración de los elementos del Tanque; Tapa), por lo que no será necesario reemplazar completamente el equipo en caso de cambios. De esta manera, se posibilita la futura construcción de otros DMFM bajo demanda, según el proceso y la etapa que se lleve a cabo, removiendo la necesidad de construir un nuevo biorreactor para nuevos requerimientos de sensibilidad.
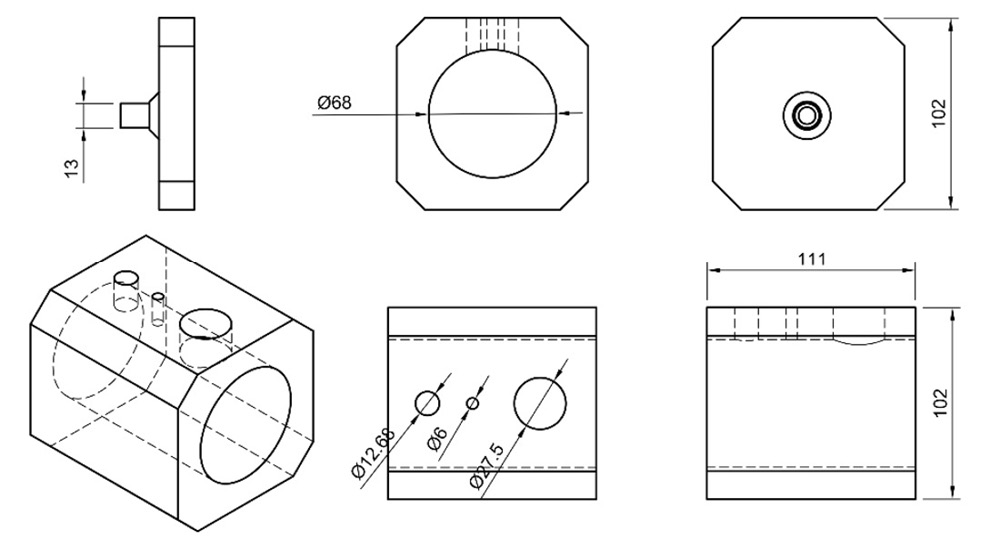
Figura 8. Dimensiones (mm) del DMFM.
Pruebas de esterilización
El proceso de esterilización es un criterio importante para el diseño y funcionalidad de un biorreactor. La importancia se centra en mantener el cultivo puro durante la fermentación [47], por lo que el diseño contempla la posibilidad de ingresar vapor de agua por medio de un vaporizador de mano genérico, facilitando la esterilización in situ. Para medir la eficiencia de esta metodología, se monitoreó la temperatura del tanque durante la exposición a vapor y su eficiencia en la inhibición de crecimiento de contaminantes. El monitoreo de la temperatura (figura 9) evidenció fluctuaciones en la distribución del calor. Las mediciones no se mantienen entre las repeticiones, esto se observa como un bajo rendimiento, donde la segunda repetición presenta temperaturas menores a los 40 °C en contraste a la segunda repetición donde la temperatura mayor es de 57 °C. Sin embargo, el tiempo de exposición a altas temperaturas no es constante.
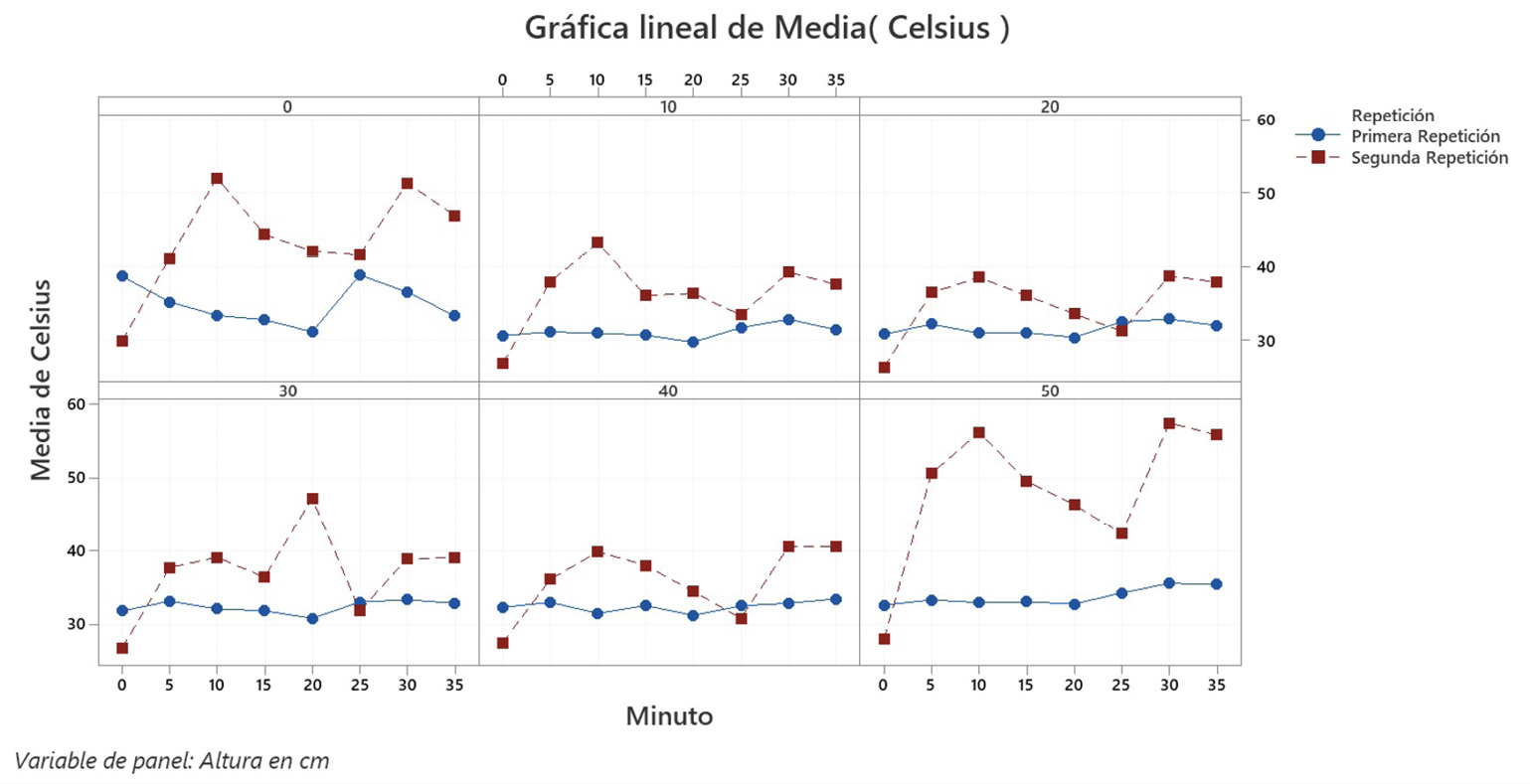
Figura 9. Comportamiento de la temperatura en el tiempo, según la altura, durante el proceso de esterilización por vapor.
Al comparar las temperaturas máximas alcanzadas en cada altura evaluada, se observó que el mayor valor, 57 °C se obtuvo en la tapa (50 cm). Es posible que esta distribución del calor se deba a que el diseño cuenta con la entrada de vapor justo debajo de los accesorios de la tapa, los cuales perciben el calor al ingreso del vapor (sección 50 cm).
La temperatura no fue constante durante el tiempo de exposición, dando como resultado fluctuaciones en ambas repeticiones, donde no son comparables las gráficas (figura 9). Las fluctuaciones descritas anteriormente también podrían asociarse con en el funcionamiento del vaporizador, ya que este no cuenta con ningún mecanismo que asegure una temperatura constante. El comportamiento fluctuante de diferencias de hasta ± 20 °C no permite fidelidad para un proceso con requerimientos de mayor estándar.
La cuantificación de la carga microbiana antes y después del proceso de esterilización facilitó el cálculo de la eficiencia del proceso por pieza muestreada (figura 10). Así, se muestra como resultado un promedio de eficiencia del 92%. Sin embargo, al analizar el resultado por pieza, se evidencia que, en la tapa, donde la eficiencia fue la menor observada, se alcanzó fue 85%, equivalente a un promedio de 31 UFC/5 cm2 con una desviación estándar de 54.4 UFC/5 cm2. El área interna del biorreactor es de aproximadamente 7.3 ×103 cm2 por lo que esta contaminación significaría 4.5 ×104 ± 7.9 ×104 UFC al iniciar la reacción.
Según Shih et al. [48] la temperatura ideal está en el rango de 121-134 °C como estándar en esterilización. Por lo tanto, al verificarse durante el monitoreo que la máxima temperatura alcanzada fue 57 °C, es posible atribuir la aparente reducción de contaminación a la aplicación del desinfectante basado en amonio cuaternario aplicado en la etapa química de la limpieza (Swipol). Según el documento facilitado por el proveedor HomeCare [49], el producto posee Cloruro de Dimetil Bencil Amonio en una concentración de 1 - 3.5% tras preparación 1:20 de agua. Espinoza & Danilo [50] reportan, a una concentración de 0.33% de Cloruro de Dimetil Bencil, una eficiencia germicida frente a E. coli de 99.775% tras 30 segundos de exposición, cuantificado según la metodología AOAC 960.09. Dado que los estudios realizados por la empresa son para evaluar microorganismos genéticamente modificados, se debe procurar la maximización de la eficiencia del proceso de esterilización, por lo que la aplicación de este método fue desestimada. Debido a esto, para las siguientes pruebas se realizan esterilizaciones por medio de autoclave.
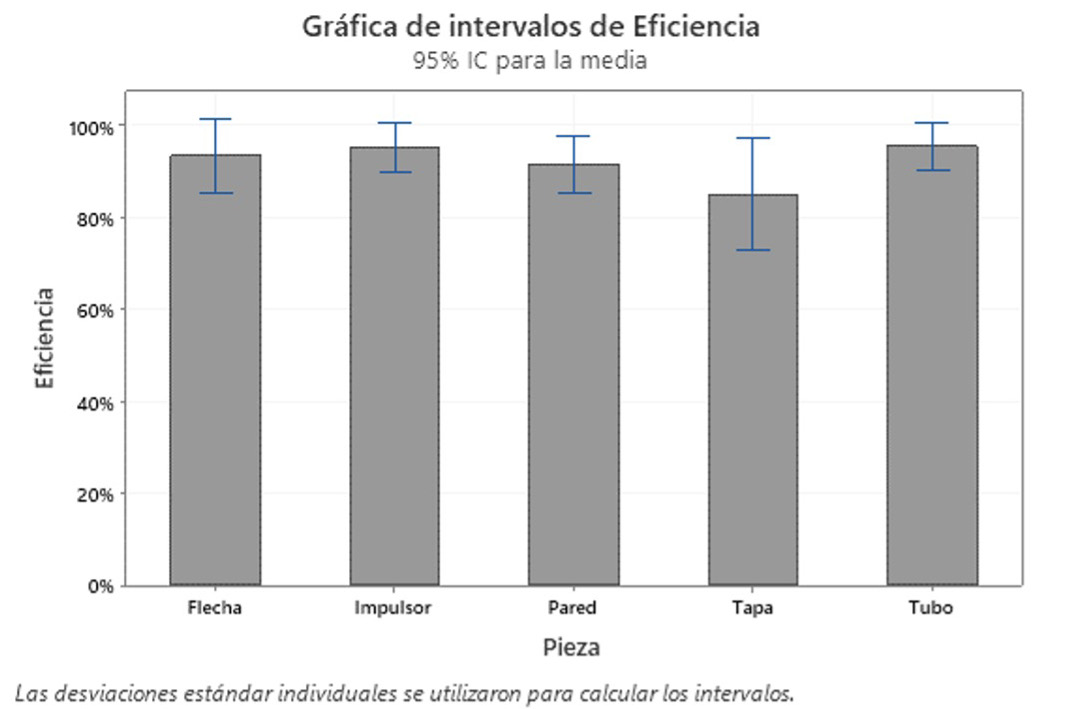
Figura 10. Eficiencia del proceso de esterilización.
Simulación de un bioproceso
Luego de tres ejecuciones de procesos libres de microorganismos introducidos se determinó que durante la ejecución del biorreactor no hay contaminación cruzada. No se evidenció crecimiento en ninguna de las repeticiones. Por lo que se determina la posibilidad de utilizar este método de esterilización como parte del proceso. Además, el resultado la calidad hermética del diseño al no ingresar contaminantes.
Uso del tanque
El diseño presenta un montaje sencillo debido a la facilidad de limpieza del diseño con bordes redondeados. Su montaje incorpora al microprocesador y como se explicó anteriormente, como resultado el diseño permite capturar datos, agitar y airear el sistema manteniendo la inocuidad. El sistema en su montaje (figura 11) presenta las etapas previsualizadas en los planos, descentralizando las funciones en cada una de las partes permitiendo modularidad. Se determina que el diseño no presenta fugas al realizar un montaje correcto.

Figura 11. Fotografía del tanque montado.
Bioproceso
Se realizaron tres fermentaciones con R. opacus (figura 12). Se observa en la curva correspondiente a la repetición 1, un periodo de latencia hasta aproximadamente las 14 h, a partir del cual inicial la fase exponencial que se extiende hasta las 64 h, donde comienza la fase estacionaria. La repetición 2 muestra un comportamiento similar al obtenido en la repetición 1. La tercera curva de crecimiento exhibe una fase mayor de latencia de 60 h, donde seguidamente entra en fase exponencial. La tercera curva presenta un mayor periodo de adaptación al medio, el cual está constituido por 40 g/L de azúcar, al no tener condiciones específicas el rendimiento de biomasa durante el crecimiento del inoculo en PBD es un factor determinante para la fase de adaptación del microorganismo debido al cambio de composición a un medio con solo fuente de carbono adicionada. Pese a la diferencia entre las cinéticas de crecimiento obtenidas, el resultado valida la capacidad del biorreactor de contener una fermentación, debido al aumento de luz absorbida en el transcurso de 3 a 6 días.
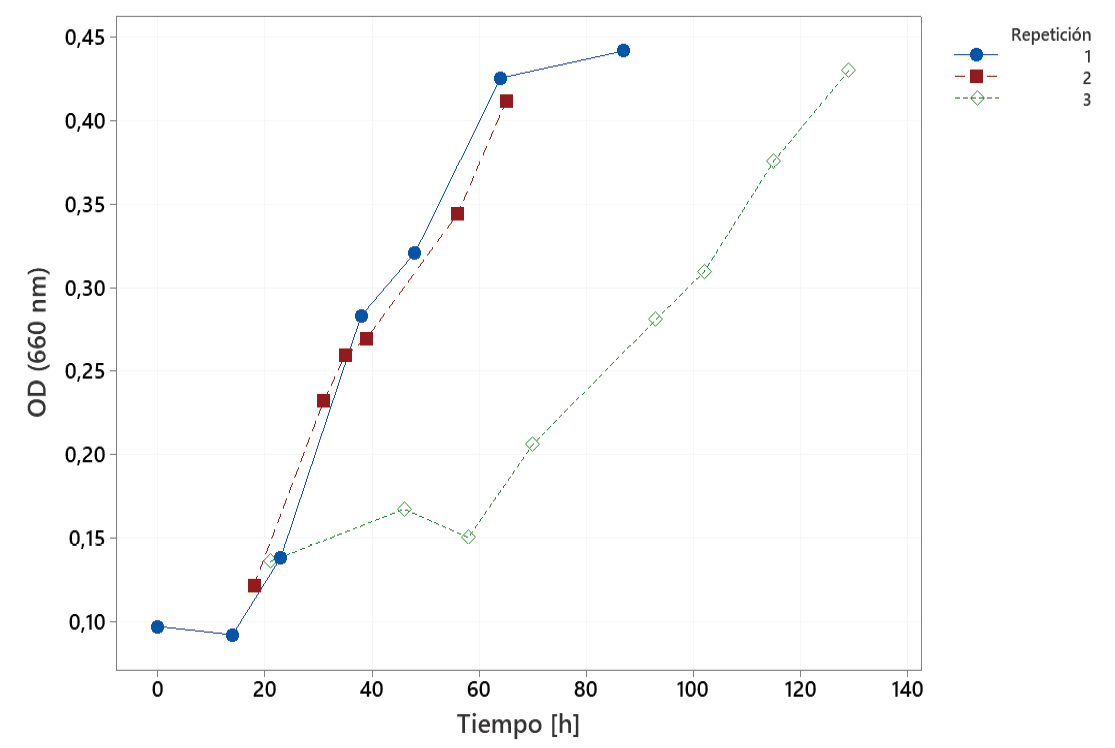
Figura 12. Curvas de crecimiento de R. opacus.
Para la comprobación del sensor de transmitancia se tomaron los datos de la primera fermentación. Debido a que el sistema no posee un módulo de medición de tiempo se asignó un intervalo numérico consecutivo. La figura 13 presenta los datos obtenidos, donde se observa una distribución creciente en el tiempo. Es importante mencionar que el sensor presenta una constante desconexión, la cual se refleja en la acumulación de datos en zonas más oscuras cercanas al valor 2. Esto concuerda con la alta exposición a movimiento mecánico generado por los motores dentro del sistema.
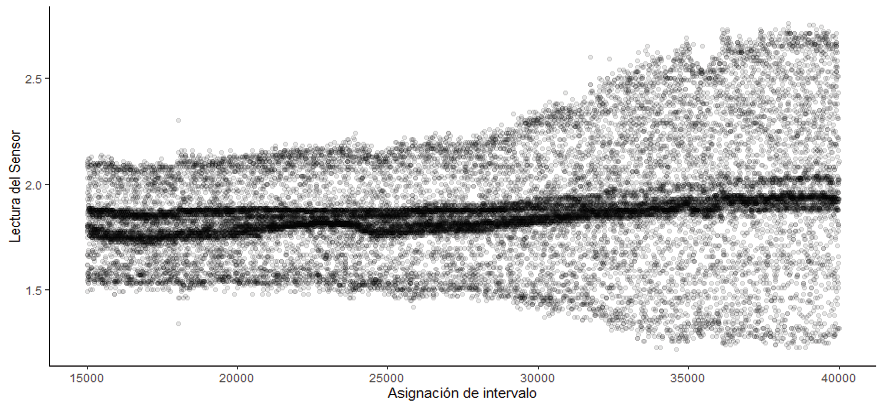
Figura 13. Curvas de crecimiento de R. opacus realizada por el sensor incorporado.
La presencia de ruido en la data recolectada se debió a variaciones de voltaje no relacionadas con la medición, comúnmente esto está relacionado a la configuración de los pines en el instrumento de prototipado (protoboard) por lo que es necesaria la fabricación de una placa PCB donde las conexiones sean soldadas a la placa [51]. Además, debido a que en cada experimento se generan altas vibraciones dado a la acción de los motores, se encuentra el requerimiento de migración del prototipo.
Conclusiones
Se propuso una metodología de esterilización in situ de bajo costo, usando equipo comercial y, al evaluar su funcionamiento, se logró concluir que el sistema de esterilización planteado no es recomendable para la empresa debido a la fluctuación de temperatura y porcentaje de eficiencia del 92%. Sin embargo, el uso de autoclave para esterilización presenta el rendimiento necesario para la empresa. Se determina la permanencia del estado de inocuidad a lo largo del proceso, ya que no presentó contaminación en las pruebas de medio estéril. De esta manera se establece la posibilidad de capturar los datos, por medio de microcontrolador, de la reacción (pH, Crecimiento y Temperatura) extrayendo medio del sistema y realizando el muestreo ex situ sin contraminar la fermentación. Con esto datos se demuestra que el tanque es capaz de brindar las condiciones para el cultivo de R. opacus, según las curvas de crecimiento. Con éxito se establece las bases para la construcción de un biorreactor con concepto modular asistido por microcontrolador para el crecimiento de R. opacus, con la capacidad de reproducir el diseño para los biorreactores que sean necesarios en el futuro.
Referencias
[1] J. S. Alford, “Bioprocess control: Advances and challenges,” Computers and Chemical Engineering, vol. 30, no. 10–12, pp. 1464–1475, Sep. 2006, doi: 10.1016/j.compchemeng.2006.05.039.
[2] A. Kumar Das and R. Mohanty, “A Review on the Production and Optimal Use of Ethyl Alcohol as a Surrogate Fuel in IC Engines Extracted From Organic Materials,” Indian J.Sci.Res, vol. 15, no. 2, pp. 46–52, 2017, Accessed: Dec. 21, 2019. [Online]. Available: https://www.researchgate.net/publication/320623386.
[3] F. Muhammad Anjum, R. Muhammad Amir, and M. Rafiq Khan, “An overview of anti-nutritional factors in cereal grains with special reference to wheat-A review,” 2010, Accessed: Dec. 21, 2019. [Online]. Available: https://www.researchgate.net/publication/233816063.
[4] L. Thi Tam, Y. Jun, and L. MinWon, “Anti-Inflammatory and Anti-Oxidative Activities of Phenolic Compounds from Alnus sibirica Stems Fermented by Lactobacillus plantarum subsp. argentoratensis,” Molecules, vol. 22, no. 9, p. 1566, Sep. 2017, doi: 10.3390/molecules22091566.
[5] S. Xia et al., “A critical review on bioremediation technologies for Cr(VI)-contaminated soils and wastewater,” Critical Reviews in Environmental Science and Technology, vol. 49, no. 12, pp. 1027–1078, Jun. 2019, doi: 10.1080/10643389.2018.1564526.
[6] Ł. Ławniczak, M. Woźniak-Karczewska, A. P. Loibner, H. J. Heipieper, and Ł. Chrzanowski, “Microbial Degradation of Hydrocarbons—Basic Principles for Bioremediation: A Review,” Molecules, vol. 25, no. 4, p. 856, Feb. 2020, doi: 10.3390/molecules25040856.
[7] Y. W. Chin, W. K. Kang, H. W. Jang, T. L. Turner, and H. J. Kim, “CAR1 deletion by CRISPR/Cas9 reduces formation of ethyl carbamate from ethanol fermentation by Saccharomyces cerevisiae,” Journal of Industrial Microbiology and Biotechnology, vol. 43, no. 11, pp. 1517–1525, Nov. 2016, doi: 10.1007/s10295-016-1831-x.
[8] S. Jaiswal, D. K. Singh, and P. Shukla, “Gene editing and systems biology tools for pesticide bioremediation: A review,” Frontiers in Microbiology, vol. 10, no. FEB, p. 87, Feb. 2019, doi: 10.3389/fmicb.2019.00087.
[9] G. Banerjee and P. Chattopadhyay, “Vanillin biotechnology: the perspectives and future,” Journal of the Science of Food and Agriculture, vol. 99, no. 2, pp. 499–506, Jan. 2019, doi: 10.1002/jsfa.9303.
[10] L. Londoño-Hernandez, G. Bolívar, and C. Ramírez, “Effect of solid state fermentation with Rhizopus oryzae on biochemical and structural characteristics of sorghum (Sorghum bicolor (L.) Moench),” Intl. J. Food. Ferment. Technol, vol. 8, no. 1, pp. 27–36, 2018, doi: 10.30954/2277-9396.01.2018.4.
[11] E. Carsanba, S. Papanikolaou, P. Fickers, B. Agirman, and H. Erten, “Citric Acid Production by Yarrowia lipolytica,” in Non-conventional Yeasts: from Basic Research to Application, Springer International Publishing, 2019, pp. 91–117.
[12] D. A. Rzechonek, A. Dobrowolski, W. Rymowicz, and A. M. Mirończuk, “Aseptic production of citric and isocitric acid from crude glycerol by genetically modified Yarrowia lipolytica,” Bioresource Technology, vol. 271, pp. 340–344, Jan. 2019, doi: 10.1016/j.biortech.2018.09.118.
[13] M. Cao, J. Feng, S. Sirisansaneeyakul, C. Song, and Y. Chisti, “Genetic and metabolic engineering for microbial production of poly-γ-glutamic acid,” Biotechnology Advances, vol. 36, no. 5. Elsevier Inc., pp. 1424–1433, Sep. 2018, doi: 10.1016/j.biotechadv.2018.05.006.
[14] S. Sirisansaneeyakul, M. Cao, N. Kongklom, C. Chuensangjun, Z. Shi, and Y. Chisti, “Microbial production of poly-γ-glutamic acid,” World Journal of Microbiology and Biotechnology, vol. 33, no. 9. Springer Netherlands, Sep. 2017, doi: 10.1007/s11274-017-2338-y.
[15] A. Schievano et al., “Electro-Fermentation – Merging Electrochemistry with Fermentation in Industrial Applications,” Trends in Biotechnology, vol. 34, no. 11. Elsevier Ltd, pp. 866–878, Nov. 01, 2016, doi: 10.1016/j.tibtech.2016.04.007.
[16] M. Tolosa, W. Chandler, D. Koebler, J. Cremonese, and B. March, “Apparatus for Detecting pH and Dissolved Oxygen US20190250103A1,” 2019. Accessed: Feb. 01, 2020. [Online].
[17] D. K. Rajan et al., “Monitoring pH, temperature and humidity in long-term stem cell culture in CO2 incubator,” in 2017 IEEE International Symposium on Medical Measurements and Applications, MeMeA 2017 - Proceedings, Jul. 2017, pp. 470–474, doi: 10.1109/MeMeA.2017.7985922.
[18] C. McBeth, R. al Dughaishi, A. Paterson, and D. Sharp, “Ubiquinone modified printed carbon electrodes for cell culture pH monitoring,” Biosensors and Bioelectronics, vol. 113, pp. 46–51, Aug. 2018, doi: 10.1016/j.bios.2018.04.052.
[19] E. P. Solomon, L. R. Berg, and D. W. Martin, Biología (9a. ed.)., vol. Novena Edi. CENGAGE Learning, 2013.
[20] A. M. Vazquez-Marquez et al., “Effect of stirring speed on the production of phenolic secondary metabolites and growth of Buddleja cordata cells cultured in mechanically agitated bioreactor,” Plant Cell, Tissue and Organ Culture, vol. 139, no. 1, pp. 155–166, Oct. 2019, doi: 10.1007/s11240-019-01673-9.
[21] P. O’Mara, A. Farrell, J. Bones, and K. Twomey, “Staying alive! Sensors used for monitoring cell health in bioreactors,” Talanta, vol. 176. Elsevier B.V., pp. 130–139, Jan. 01, 2018, doi: 10.1016/j.talanta.2017.07.088.
[22] A. ; Hasanzadeh, H. ; Junicke, and K. v Gernaey, “General rights Electrochemical biosensors for in-situ monitoring of stress responses in large bioreactors,” 2019. Accessed: Dec. 27, 2019. [Online].
[23] C. Klinger and U. Becken, “PH Sensor Recalibration Based on Exhaust CO 2 Concentration,” Genetic Engineering and Biotechnology News, vol. 38, no. 15, pp. 24–25, Sep. 2018, doi: 10.1089/gen.38.15.07.
[24] N. Udom, P. Chansongkrow, V. Charoensawan, and C. Auesukaree, “Coordination of the cell wall integrity and highosmolarity glycerol pathways in response to ethanol stress in Saccharomyces cerevisiae,” Applied and Environmental Microbiology, vol. 85, no. 15, 2019, doi: 10.1128/AEM.00551-19.
[25] C. L. Cooney, “Bioreactors: Design and operation,” Science, vol. 219, no. 4585. pp. 728–733, 1983, doi: 10.1126/science.219.4585.728.
[26] D. Soletto, L. Binaghi, A. Lodi, J. C. M. Carvalho, and A. Converti, “Batch and fed-batch cultivations of Spirulina platensis using ammonium sulphate and urea as nitrogen sources,” Aquaculture, vol. 243, no. 1–4, pp. 217–224, Jan. 2005, doi: 10.1016/j.aquaculture.2004.10.005.
[27] N. Pérez-Rodríguez, R. Pinheiro de Souza, A. M. Torrado, and J. M. Domínguez, “Ferulic acid transformation into the main vanilla aroma compounds by Amycolatopsis sp. ATCC 39116,” Applied Microbiology and Biotechnology, vol. 100, no. 4, pp. 1677–1689, Feb. 2016, doi: 10.1007/s00253-015-7005-3.
[28] S. Liu, Bioprocess Engineering: Kinetics, Sustainability, and Reactor Design: Second Edition. Elsevier Inc., 2016.
[29] G. T. Benz, “Bioreactor Design for Chemical Engineers - BioreactorDesignForChEs.pdf,” no. August, pp. 21–26, 2011.
[30] W. R. Finnerty, “The Biology and Genetics of the Genus Rhodococcus,” Annual Review of Microbiology, vol. 46, no. 1, pp. 193–218, Oct. 1992, doi: 10.1146/annurev.mi.46.100192.001205.
[31] M. Majidzadeh and M. Fatahi-Bafghi, “Current taxonomy of Rhodococcus species and their role in infections,” European Journal of Clinical Microbiology and Infectious Diseases, vol. 37, no. 11. Springer Verlag, pp. 2045–2062, Nov. 01, 2018, doi: 10.1007/s10096-018-3364-x.
[32] S. R. Subashchandrabose, K. Venkateswarlu, R. Naidu, and M. Megharaj, “Biodegradation of high-molecular weight PAHs by Rhodococcus wratislaviensis strain 9: Overexpression of amidohydrolase induced by pyrene and BaP,” Science of the Total Environment, vol. 651, pp. 813–821, Feb. 2019, doi: 10.1016/j.scitotenv.2018.09.192.
[33] S. R. Subashchandrabose, K. Venkateswarlu, K. Krishnan, R. Naidu, R. Lockington, and M. Megharaj, “Rhodococcus wratislaviensis strain 9: An efficient p-nitrophenol degrader with a great potential for bioremediation,” Journal of Hazardous Materials, vol. 347, pp. 176–183, Apr. 2018, doi: 10.1016/j.jhazmat.2017.12.063.
[34] W. E. Anthony et al., “Development of Rhodococcus opacus as a chassis for lignin valorization and bioproduction of high-value compounds,” Biotechnology for Biofuels, vol. 12, no. 1. BioMed Central Ltd., pp. 1–14, Aug. 05, 2019, doi: 10.1186/s13068-019-1535-3.
[35] J. Czajka, Q. Wang, Y. Wang, and Y. J. Tang, “Synthetic biology for manufacturing chemicals: constraints drive the use of non-conventional microbial platforms,” Applied Microbiology and Biotechnology, vol. 101, no. 20. Springer Verlag, pp. 7427–7434, Oct. 01, 2017, doi: 10.1007/s00253-017-8489-9.
[36] M. S. Kuyukina and I. B. Ivshina, “Application of Rhodococcus in Bioremediation of Contaminated Environments,” 2010, pp. 231–262.
[37] G. W. Roell et al., “A concerted systems biology analysis of phenol metabolism in Rhodococcus opacus PD630,” Metabolic Engineering, vol. 55, pp. 120–130, Sep. 2019, doi: 10.1016/j.ymben.2019.06.013.
[38] K. Kurosawa, P. Boccazzi, N. M. de Almeida, and A. J. Sinskey, “High-cell-density batch fermentation of Rhodococcus opacus PD630 using a high glucose concentration for triacylglycerol production,” Journal of Biotechnology, vol. 147, pp. 212–218, 2010, doi: 10.1016/j.jbiotec.2010.04.003.
[39] E. Bonilla-Pastor, “Diseño de un sistema de producción modular en una mediana empresa de confecciones,” Universidad de Lima, vol. 0, no. 025, p. 11, 2007, doi: 10.26439/ing.ind2007.n025.607.
[40] F. K. Pil and S. K. Cohen, “Modularity: Implications for imitation, innovation, and sustained advantage,” Academy of Management Review, vol. 31, no. 4, pp. 995–1011, 2006, doi: 10.5465/AMR.2006.22528166.
[41] Australian Stainless Steel Development Association (ASSDA), “316: The First Step Up,” 2020. https://www.assda.asn.au/technical-info/grade-selection/316-the-first-step-up (accessed Mar. 30, 2020).
[42] A. van Heiningen, D. Krothapalli, J. Genco, and A. Justason, “A chemical reactor analysis of industrial oxygen delignification,” Pulp and Paper Canada, vol. 104, no. 12, pp. 96–101, 2003.
[43] G. D. Najafpour, “Bioreactor Design,” in Biochemical Engineering and Biotechnology, Elsevier, 2007, pp. 142–169.
[44] L. J. Shah, “Heat transfer correlations for vertical mantle heat exchangers,” Solar Energy, vol. 69, no. SUPPLEMENT, pp. 157–171, Jul. 2001, doi: 10.1016/S0038-092X(01)00039-1.
[45] K. Thoring and R. M. Müller, “Understanding Design Thinking: A Process Model Based On Method Engineering,” 2011. Accessed: Nov. 09, 2020. [Online]. Available: https://www.designsociety.org/publication/30932/Understanding+Design+Thinking%3A+A+Process+Model+based+on+Method+Engineering.
[46] K. Hirose and N. Mishima, “Eco-efficiency evaluation of modular design smartphones,” in Procedia CIRP, Jan. 2019, vol. 84, pp. 1054–1058, doi: 10.1016/j.procir.2019.04.189.
[47] H. A. Ruíz-Leza, R. M. Rodríguez-Jasso, R. Rodríguez-Herrera, J. C. Contreras-Esquivel, and C. N. Aguilar, “Diseño de biorreactores para fermentación en medio sólido,” Revista Mexicana de Ingeniería Química, vol. 6, pp. 33–40, 2007, [Online]. Available: https://www.redalyc.org/articulo.oa?id=62060105.
[48] C. C. Shih, Y. Y. Su, L. C. Chen, C. M. Shih, and S. J. Lin, “Degradation of 316L stainless steel sternal wire by steam sterilization,” Acta Biomaterialia, vol. 6, no. 6, pp. 2322–2328, Jun. 2010, doi: 10.1016/j.actbio.2009.12.026.
[49] HomeCare, “Hoja de seguridad del producto Swipe Swipol,” 2017. https://www.jomsmx.com.mx/index.php/insumos/sanitizantes/product/download/file_id-1515 (accessed Nov. 10, 2020).
[50] P. Espinoza and B. Danilo, “Elaboración de un plan maestro de desinfección para la empresa de deshidratados Criswils,” Quito: UCE, 2019.
[51] C. T. Obe1, S. E. Oti2, C. U. Eya3, D. B. N. Nnadi, and O. E. Nnad, “A LOW-COST PRINTED CIRCUIT BOARD DESIGN TECHNIQUE AND PROCESSES USING FERRIC CHLORIDE SOLUTION | Nigerian Journal of Technology,” 2020, Accessed: Nov. 12, 2020. [Online]. Available: http://nijotech.com/index.php/nijotech/article/view/2467.
1 Instituto Tecnológico de Costa Rica. Costa Rica.
Correo electrónico: pablo@bogantesportuguez.com