Obtención de nanocelulosa a partir de raquis de palma africana y bagazo de caña
Nanocellulose production from African oil palm rachis and sugarcane bagasse
Eddy Gabriel Jirón-García1, Karina Rodríguez-Mora2, Cesar Bernal-Samaniego3
Fecha de recepción: 9 de febrero de 2021
Fecha de aprobación: 13 de junio de 2021
Jirón-García, E.G; Rodríguez-Mora, K; Bernal-Samaniego, C. Obtención de nanocelulosa a partir de raquis de palma africana y bagazo de caña. Tecnología en Marcha. Vol. 35-2. Abril-Junio 2022. Pág 167-181. https://doi.org/10.18845/tm.v35i2.5609
https://doi.org/10.18845/tm.v35i2.5609
Palabras clave
Biomasa; materiales; nanocelulosa; residuos; degradación.
Resumen
Se utilizó raquis de palma africana y bagazo de caña como materias primas para obtener nanofibrillas de celulosa por medio de un método híbrido combinando un tratamiento químico y una ruptura mecánica. La celulosa obtenida de ambas materias primas, luego de la hidrólisis fue caracterizada por Espectroscopía Infrarroja, Análisis Termogravimétrico, Microscopía Electrónica de Barrido, Microscopía de Fluorescencia y Difracción de rayos X. Se realizó una Microscopía Electrónica de Transmisión a las nanofibrillas para determinar el tamaño de las mismas. Se observó un porcentaje de remoción de lignina de 74,1 % para el raquis de palma africana y de 65,6 % para el bagazo de caña luego del tratamiento químico; lo que generó microcelulosa de 6-12 µm y de 10-18 µm para el raquis y el bagazo respectivamente. La ruptura mecánica con el sonificador de alta potencia produjo nanofibrillas de 19-24 nm para el raquis de palma y de 9,22-12 nm para el bagazo de caña; con un Índice de Cristalinidad de 70% en ambos casos.
Keywords
Biomass; materials; nanocellulose; waste; degradation.
Abstract
African oil palm rachis and sugarcane bagasse were used as raw materials to produce cellulose nanofibrils by hybrid method which combine chemical treatment and mechanical rupture. The cellulose obtained from both raw materials after hydrolysis was characterized by Infrared Spectroscopy, Thermogravimetric Degradation Analysis, Scanning Electron Microscopy, Fluorescence Microscopy and X-ray Diffraction. At the end of the mechanical rupture, Transmission Electron Microscopy was performed at the nanofibrils to determine their size. A lignin removal percentage of 74,1 % was observed for the african oil palm rachis and 65,6 % for the sugarcane bagasse after chemical treatment; which generated microcellulose of 6-12 µm and 10-18 µm for the rachis and bagasse respectively. The mechanical rupture treatment with the high-power sonifier produced nanofibrils of 19-24 nm for the palm rachis and 9,22-12 nm for the cane bagasse; with a Crystallinity Index of 70% in both cases.
Introducción
La economía costarricense basa uno de sus pilares en la agronomía y el cultivo. Según la Encuesta Nacional Agropecuaria (ENA) 2019 publicada en setiembre de 2020 el café, la palma africana y la caña de azúcar son los cultivos que más área abarcaron en el territorio nacional durante el 2019. Estos productos agroindustriales, según la Secretaría Ejecutiva de Planificación Sectorial Agropecuaria (SEPSA) en su Boletín Estadístico N°30, mantuvieron esta tendencia para el primer semestre de 2020.[1], [2].
En concordancia con lo anterior, la producción de aceite de palma fue estimada por la ENA en aproximadamente 1 033 721 toneladas métricas para el 2019 con una productividad promedio a nivel nacional de 14,37 toneladas métricas de fruta fresca por hectárea por año. Al procesar la fruta fresca se genera un residuo sólido de alrededor de 21 % en peso de la fruta que incluyen la fibra, el cuesco y el raquis [3], cuya disposición se da principalmente en patios de descomposición para ser utilizados como compostaje, en biodigestores [4] y en ocasiones se incinera para usarse como combustible [1], [5], [6]. Aunque, el raquis normalmente no se utiliza en el aprovechamiento energético, ya que contienen mucha humedad y su volumen lo hacen difícil de transportar, por lo que se hacen necesarias buscar alternativas que generen valor a este residuo [7].
De igual manera, la producción de azúcar se incrementó de 431 109 toneladas métricas en el periodo 2017/2018 a 445 000 toneladas métricas en el mismo periodo 2018/2019 [8] este aumento se debe a que en el procesamiento de la caña de azúcar en Costa Rica participan en forma activa 13 ingenios azucareros distribuidos a lo largo de todo el país [9]. La totalidad de esa caña que se procesa en los ingenios, generó una cantidad aproximada de 624 mil toneladas de bagazo de caña seco, convirtiendo este residuo en el más importante de la industria [10], [11]. Al igual que la palma, este residuo es utilizado para producir energía por medio de su incineración, pero dependiendo del manejo de la producción agroindustrial esto puede resultar en un aumento de emisiones; por lo que se ha optado por buscar alternativas más limpias para aprovecharlo [12].
En consecuencia, tanto el raquis de palma africana como el bagazo de caña se han convertido en materias primas importantes para el estudio de productos de mayor valor agregado y con mayor interés científico debido a su composición química y propiedades.
El bagazo es un residuo fibroso remanente de los tallos de caña, que se obtiene a la salida del último molino del tándem azucarero, el cual constituye un conjunto heterogéneo de partículas de diferentes tamaños que oscilan entre 1 a 25 mm, presentando una fracción promedio de aproximadamente 20 mm. Desde el punto de vista químico se compone de 46,6 % de celulosa, 25,2 % de hemicelulosas y 20,7 % de lignina en base húmeda [10], [13].
Debido a las características anteriores, el bagazo de caña ha sido utilizado de diversas formas aprovechando que es un recurso ecológico y renovable, entre ellas están, a parte de la generación eléctrica, la producción de pulpa de papel y productos basados en la fermentación (como etanol de segunda generación) [14].
Por otra parte, los residuos de palma africana (Elaeis guineensis) son varios e incluyen características similares en cuanto a composición. El raquis de palma, por ejemplo, posee una composición química heterogénea basada principalmente en tres biopolímeros que constituyen entre un 95 % - 98 % de su composición: celulosa, hemicelulosa y lignina. El restante 2 % - 5 % los constituyen moléculas de bajo peso molecular llamadas extractivos [15].
De los biopolímeros que conforman tanto el raquis de palma africana como el bagazo de caña de azúcar, uno de los más importantes en su composición es la celulosa [10], [15]. La celulosa y la lignina son los mayores constituyentes de las paredes celulares vegetales, por esta razón a los residuos provenientes de las plantas se les conoce como residuos lignocelulósicos [16], [17].
En los últimos años las investigaciones se han enfocado en la creación de materiales de mayor valor agregado a partir de materiales lignocelulósicos por medios innovadores que permitan un proceso más ecológico y al mismo tiempo de menor costo, por ejemplo la obtención de micro y nanocelulosa [16], [18], [19]. En consecuencia, en Costa Rica se han realizado investigaciones acerca de la obtención de nanocelulosa a partir de residuos de la piña, del banano, de la caña de azúcar, y de la palma africana [20]–[23]. Reforzamiento de poliuretanos elastoméricos con fibras naturales y microcelulosa para influir en las propiedades mecánicas [24], micro y nanocelulosa como reforzante para adhesivos de polivinilacetato y úrea-formaldheido [25], así como aditivo en mezclas para materiales de construcción [26] son algunos usos que se le ha dado.
La nanocelulosa es la forma nanométrica de la celulosa, la cual puede presentarse principalmente en tres formas: 1) celulosa nanocristalina (CNCs o NCCs) y nanocilindros de celulosa (CNWs) 2) nanofibrillas de celulosa (CNFs o NFC) y 3) celulosa bacteriana (BC). Por lo tanto se obtienen materiales con diferente cristalinidad, superficie química y propiedades mecánicas, haciéndolos atractivos en investigación [23], [27], [28].
Entre los procesos de obtención de nanocelulosa cristalina y nanofibrillas se encuentra la oxidación TEMPO (2,2,6,6-tetrametilpipelidina-1-oxilradical), hidrólisis enzimática o métodos mecánicos incluyendo ultrasonificación de alta intensidad, la homogenización de alta presión o molienda [23], [29]–[31]. Aunque el proceso más común es la hidrólisis de la pulpa, que puede ser ácida o alcalina, que remueve los componentes no celulósicos y las partes amorfas de las cadenas de celulosa.
Gran cantidad de trabajos se han llevado a cabo por medio de hidrólisis, Mandal y Chakrabarty [32] sintetizaron nanofibrillas de celulosa a partir de bagazo de caña de azúcar. Habibi [33], sintetizó nanofibrillas de celulosa con una dimensión de 10-30 nm y cientos de nanómetros de longitud. Además, por medio de la mezcla de HCl y HNO3 se han obtenido nanocristales de celulosa con excelente dispersión en agua [34].
Este artículo plantea la obtención de nanocelulosa a partir de raquis de palma africana y de bagazo de caña por medio de un método híbrido que combina un tratamiento de explosión a temperatura y presión moderadamente elevadas; utilizando una combinación de hidrólisis básica con NaOH y una hidrólisis ácida usando CH3COOH, y una ruptura mecánica de la pulpa de celulosa por medio de un sonificador de alta potencia.
Materiales y métodos
Obtención de nanocelulosa
Degradación
La muestra se seca y se muele a un tamaño de 10 mm aproximadamente, se agrega NaOH al 2 % (m/m) en una relación de 100 g por 3 L de disolución. Se somete a 150 lb de presión por 30 min. Se retira y se lava hasta pH neutro. La masa resultante se somete nuevamente a 100 lb de presión por 30 min utilizando ácido acético al 6 % (m/m). Se decanta y se lava con hipoclorito de sodio durante 30 min cambiando el hipoclorito cada 15 min. Finalmente, se lava hasta pH neutro.
Ruptura
La celulosa obtenida se coloca diluida en un sonificador de alta potencia marca QSonica modelo Q700, la cual utiliza una amplitud del 60%, 20MHz y 15 minutos en un baño de agua para evitar el calentamiento. Posteriormente, la nanocelulosa se centrifuga.
Caracterización
Caracterización química
•Extractivos, lignina, holocelulosa, hemicelulosa, celulosa y cenizas: se determinaron de acuerdo con las normas TAPPI, las normas empleadas fueron T 207 cm-99, T 413 om-02, T 222 om-02, T 280 pm-99 y T 203 cm-99.
Caracterización microscópica y espectroscópica
•Espectroscopia Infrarroja (IR): para obtener las bandas de los grupos funcionales asociados a los componentes de la fibra, así como ausencia y presencia de lignina se utilizó un equipo PerkinElmer modelo Frontier FT-IR-ATR. Se hicieron 10 escaneos por muestra con un fondo grande para obtener el espectro final. El escaneo fue desde 4000 cm-1 a 450 cm-1.
•Análisis Termogravimétrico (TGA): se utilizó un equipo TGA TA-Instruments Q5000 con un flujo de Nitrógeno ultrapuro de 10 mL/min utilizando una rampa de calentamiento de 5 °C/min desde 25 °C hasta 600 °C para obtener la degradación específica de cada compuesto por medio del área bajo la curva.
•Microscopia de florescencia: Para la determinación del cambio en la composición entre lignina y celulosa se empleó un microscopio de florescencia marca Zeiss modelo Axio Lab, Para la determinación de la celulosa se tiñó la fibra con M2R calcoflur al 0,01 % por 5 minutos, se dejó secar al aire y en la oscuridad por 24 horas, mientras que la medida de lignina se realizó por autoflorescencia.
•Microscopía electrónica de barrido (SEM): Se empleó un microscopio electrónico de barrido HITACHI modelo S700-N para determinar cambios morfológicos según el tratamiento por medio de micrografías a las fibras. Para esto, las fibras secas fueron colocadas en una cinta de carbono doble contacto y se realizó un recubrimiento con oro al vacío para finalmente ser colocadas en el microscopio electrónico.
•Microscopía electrónica de trasmisión (TEM): para determinar el tamaño de las fibras de nanocelulosa se utilizó un Microscopio Electrónico de Transmisión HITACHI HT 7700. Las fibras fueron suspendidas en agua destilada y posteriormente se colocó una microgota sobre una rejilla de carbono, se dejó secar al aire y se realizó una tinción negativa con ácido fosfotungstico para finalmente ser colocadas al microscopio electrónico.
•Difracción de Rayos X (XRD): Se utilizó un difractómetro de rayos X PANalytical modelo Empyrean para determinar la relación entre el tratamiento empleado y la cristalinidad de las muestras. Las muestras fueron colocadas en un portamuestras Zer-background y luego dentro de una cuna tipo reflexión-transmisión. El análisis de Difracción se realizó con un tubo de Cobre (λ=1,54 Å) a una potencia de 45 kV y 40 mA, con un barrido de 5°- 60°. Para el filtrado de radiación Kβ se utilizó un filtro de Niquel.
Resultados y Discusión
Caracterización Química
La caracterización de la materia prima se llevó a cabo con el objetivo de conocer su composición química, de forma tal que se pueda elegir un tratamiento adecuado, que involucre o no un procesamiento previo. El cuadro 1, muestra los resultados de la caracterización tanto del raquis de palma como del bagazo de caña. Entre los componentes de mayor interés para este trabajo se encuentra la lignina y la celulosa presentes en ambas muestras.
Cuadro 1. Caracterización de la materia prima.
|
Muestra |
Cenizas |
Extractivos |
Lignina |
Celulosa |
Hemicelulosa |
|
Raquis Palma |
3,87±0,23 |
5,42±0,33 |
22,6±1,1 |
31,4±1,3 |
25,8±1,3 |
|
Bagazo de caña |
4,59±0,65 |
1,52±0,10 |
24,0±2,7 |
30,4±1,5 |
32,1±1,5 |
Los dos materiales presentan un alto contenido de lignina si se compara con otros productos como el pinzote de banano y las hojas del rastrojo de piña los cuales poseen 15,6 % y 15,9 % respectivamente [23], [35]. Además, es importante destacar que todas estas muestras no presentaron un pre-tramiento mecánico que las llevara a un tamaño de partícula homogéneo ni que fuera realmente pequeño haciendo que el proceso de degradación sea más complejo y como consecuencia de ello se ve la necesidad de emplear el método de explosión a mayores presiones (150 lb de presión en la hidrólisis básica y 100 lb de presión en la hidrólisis ácida), de forma tal que las concentraciones de los reactivos se puedan mantener relativamente bajas (NaOH al 5 % y CH3COOH al 6 %).
Las concentraciones de los reactivos utilizados en la explosión son menos concentrados y menos dañinas al medio ambiente que otros utilizados en el mismo método para materias primas iguales o con un contenido de lignina similar que utilizan NaOH entre 20-25 % para la hidrólisis básica, y para la hidrólisis ácida pueden usar H2SO4 entre 10-75 % o HCl entre 10-17 % [20], [36].
En cuanto al contenido de celulosa, se nota que ambos materiales poseen una composición similar. Este valor se asemeja al reportado para otros productos como el raquis de banano y la cascarilla de café los cuales poseen 33,5 % y 25,7 % respectivamente. No obstante es menos que el reportado para las hojas del rastrojo de piña que ronda el 62 % [23], [36], [37]. Sin embargo, la diferencia en la extracción de celulosa de todos estos materiales radica en el contenido de lignina y en la disposición y arreglo de las fibras a nivel microscópico.
Espectroscopía Infrarroja (IR)
La figura 1 muestra el espectro infrarrojo de la celulosa obtenida tanto del raquis de palma como del bagazo de caña. En ella se muestran diferentes bandas características, por ejemplo, la banda ancha situada a 3324 cm-1 corresponde al enlace -OH, característicos de la celulosa y hemicelulosa, la banda de 2890 cm-1 que corresponde al estiramiento del enlace -CH en R3C-H y el pico en 1430 cm-1 correspondiente al enlace -CH2, ambos característicos de los compuestos polisacáridos.
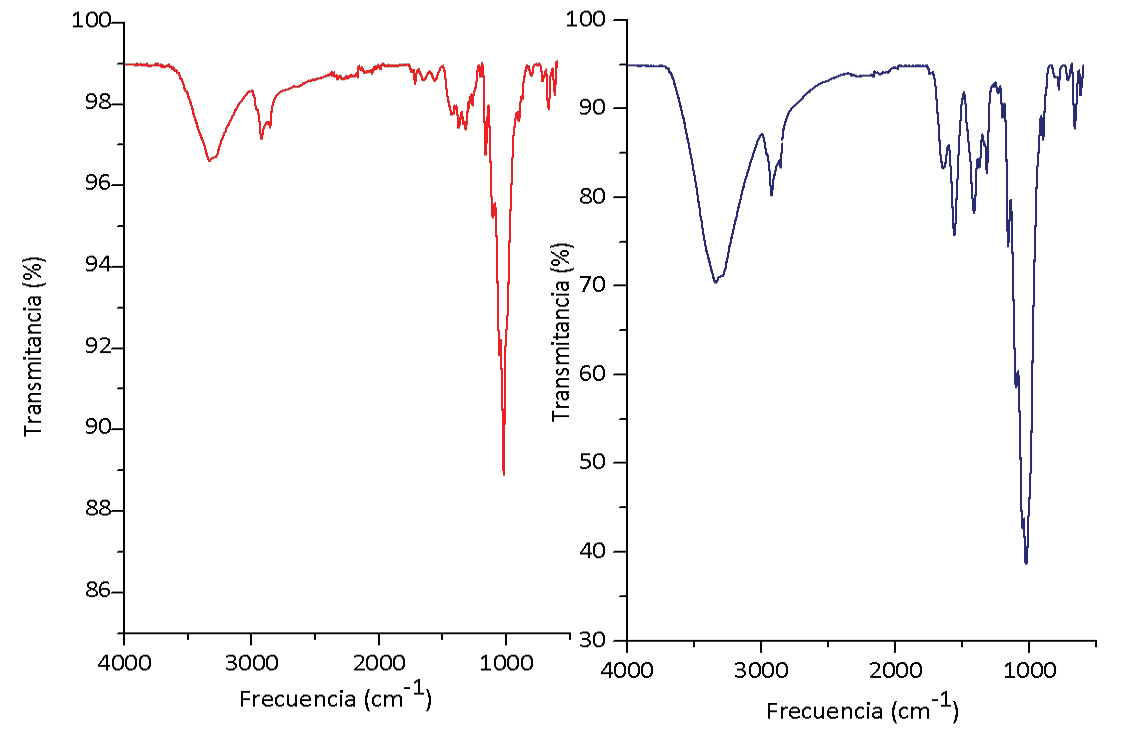
Figura 1. Espectro infrarrojo A) Bagazo de caña B) Raquis de palma africana.
La banda en 1152 cm-1 se relaciona con el estiramiento asimétrico C–O–C atribuido a la celulosa. La banda posicionada en 1001 cm-1 se atribuye al enlace -CO. Una banda en 896 cm-1 surge de los enlaces glicosídicos y es asociada con la parte amorfa de la estructura de la celulosa mientras que la banda a 1420 cm-1 es asociada la parte cristalina del material [38], [39]. Estos picos son todas las bandas de absorción características de la celulosa y es importante mencionar se encuentran presentes en ambas muestras.
No obstante, se notan diferencias en las bandas presentadas en 1635 cm-1 y 1600 cm-1 correspondiente al enlace C=C presente en los compuestos aromáticos. Además de la banda a 1250 cm-1 causada por el anillo del benceno presente, todas estas bandas son características de la lignina [20], [23], [40].
Lo que quiere decir que se obtuvo celulosa utilizando tanto bagazo de caña como raquis de palma como materia prima. Sin embargo, el proceso de deslignificación no se efectúo de igual forma en ambas generando al final bandas diferentes en los espectros. Esta diferencia en la deslignificación se puede corroborar en el Análisis Termogravimétrico (TGA) y se debe principalmente a que, a diferencia del raquis de palma, el bagazo de caña presenta una estructura microscópica más laminar que fibrilar (ver figura 5 y figura 6).
Análisis Termogravimétrico (TGA)
En la figura 2 se muestran los termogramas correspondientes a las muestras de celulosa obtenida a partir de bagazo de caña y raquis de palma después de los tratamientos químicos. Los materiales lignocelulósicos normalmente poseen tres caídas de masa en sus diagramas termogravimétricos [41], estas caídas son más notorias en el bagazo de caña que en el raquis de palama africana. La primera caída corresponde a la humedad del material, tanto la humedad externa como la humedad ocluida, por lo cual la rampa de temperatura es de 40 °C hasta los 130 °C. Esta humedad corresponde a un 6,8 % para el bagazo de caña y un 4,3 % para el raquis de palma africana, de ahí la diferencia entre la primera parte de las curvas. La segunda caída de masa se da cuando se descomponen los carbohidratos presentes en la muestra es decir la holocelulosa (celulosa + hemicelulosa) en un rango de temperatura entre 180 °C y 360 °C [42], correspondiente a un 54,9 % para el bagazo de caña y un 61,5 % para el raquis de palma africana respectivamente. Es importante mencionar que el amplio rango de descomposición de la holocelulosa se debe principalmente a que los puentes de hidrógeno y regiones cristalinas del material generan una estabilidad térmica importante en las fibras, este intervalo de temperaturas coincide con [43] y [44] quienes estudiaron la influencia de la cristalinidad en la estabilidad térmica de las nanofibras de celulosa de diversas residuos lignocelulósicos.
Finalmente, la última caída de masa en la figura 2 corresponde a la lignina residual en el material después de las hidrólisis y de los blanqueamientos. La lignina al ser un compuesto aromático de alto peso molecular y estructura química variable, se descompone en un intervalo de temperatura amplio entre 390 °C y 580 °C [45], [46].
El cuadro 2 muestra cuánta lignina le quedó al material, al mismo tiempo que se muestra el porcentaje de remoción de lignina con respecto al cuadro 1. Al observar la lignina residual se denota como ocurre mayor degradación en la palma africana, logrado una remoción de un 74,1 %, mientras que en el bagazo de caña se da una remoción del 65,6 %. Estos datos se pueden corroborar al observar la microscopía de florescencia de la figura 3.
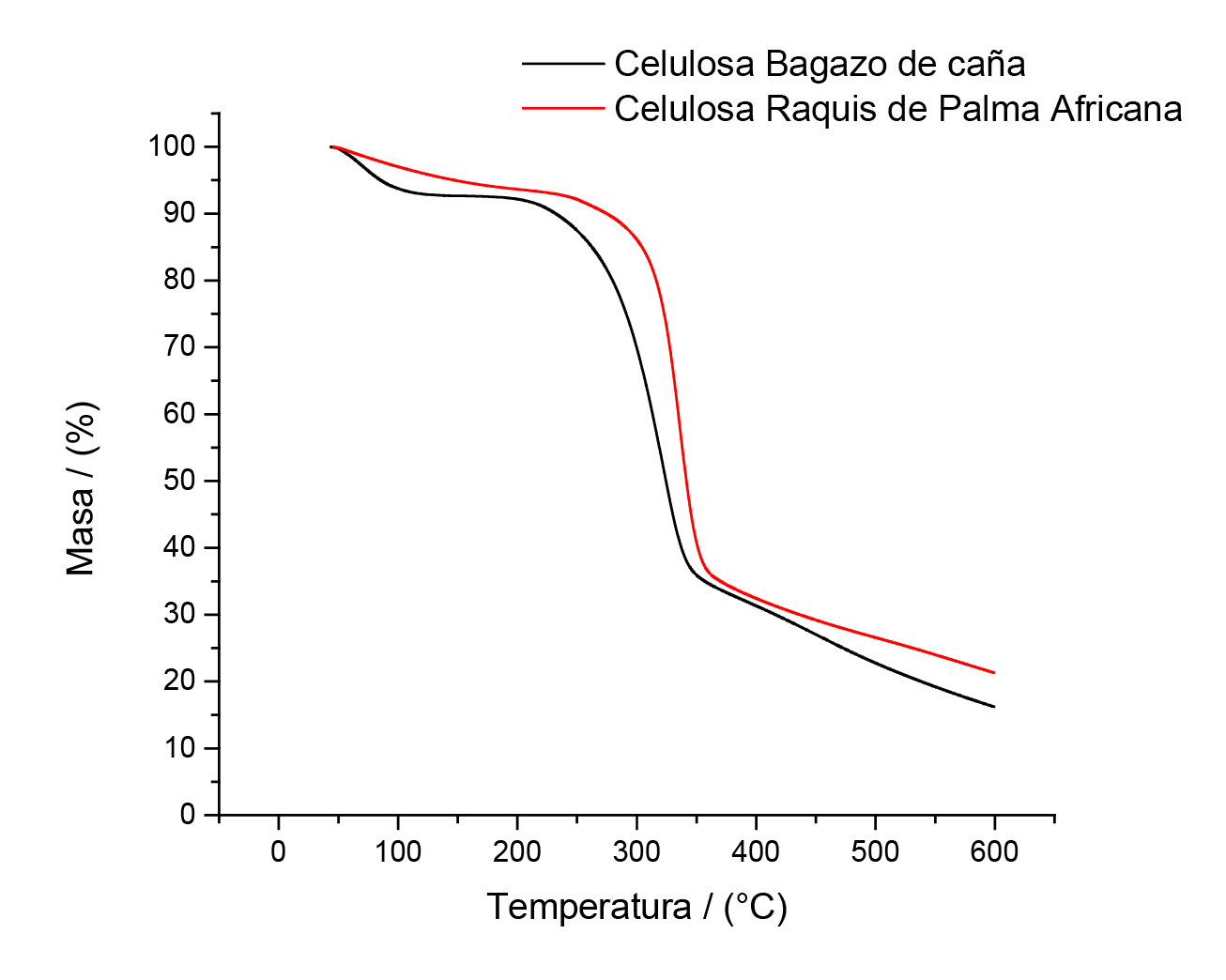
Figura 2. Diagramas termogravimétricos de las pulpas de generadas a partir de bagazo de caña y raquis de palma africana luego del tratamiento químico.
La extracción de celulosa (como se mencionó antes) depende del contenido de lignina y de la disposición y arreglo de las fibras a nivel microscópico. La caña de azúcar presentó mayor porcentaje de lignina en la materia prima, y al ser un compuesto cuya disposición es en láminas y no en fibras a diferencia del raquis de palma africana (ver microscopía electrónica de barrido) se disminuye la deslignificación producida en los tratamientos. No obstante, el porcentaje de remoción de lignina cuantificado con TGA es considerablemente alto, haciendo el método funcional para separar la celulosa de la lignina en ambas materias primas.
Cuadro 2. Resultados del análisis de los TGA.
|
TGA |
Porcentaje Lignina residual (%) |
Porcentaje de remoción (%) |
|
Celulosa de Raquis de palma africana |
5,8 |
74,1 |
|
Celulosa de bagazo de caña |
8,3 |
65,6 |
Microscopía de fluorescencia
La microscopía de fluorescencia se utilizó como método para seguir la degradación de la lignina en la muestra y por ende mayor exposición de la celulosa. El calcofluor tiene la capacidad de formar puentes de hidrógeno con polisacáridos β-1,4 y β-1,3 y generar una tinción para localizar celulosa [47]. En la figura 3 se muestra la manera en la que fluoresce la celulosa (azul) y la lignina (verde). En la figura 3.1, se nota una mayor coloración verde lo que significa una mayor concentración de lignina, ya que según [48] y [49] la magnitud de la fluorescencia es proporcional a la concentración de este componente.
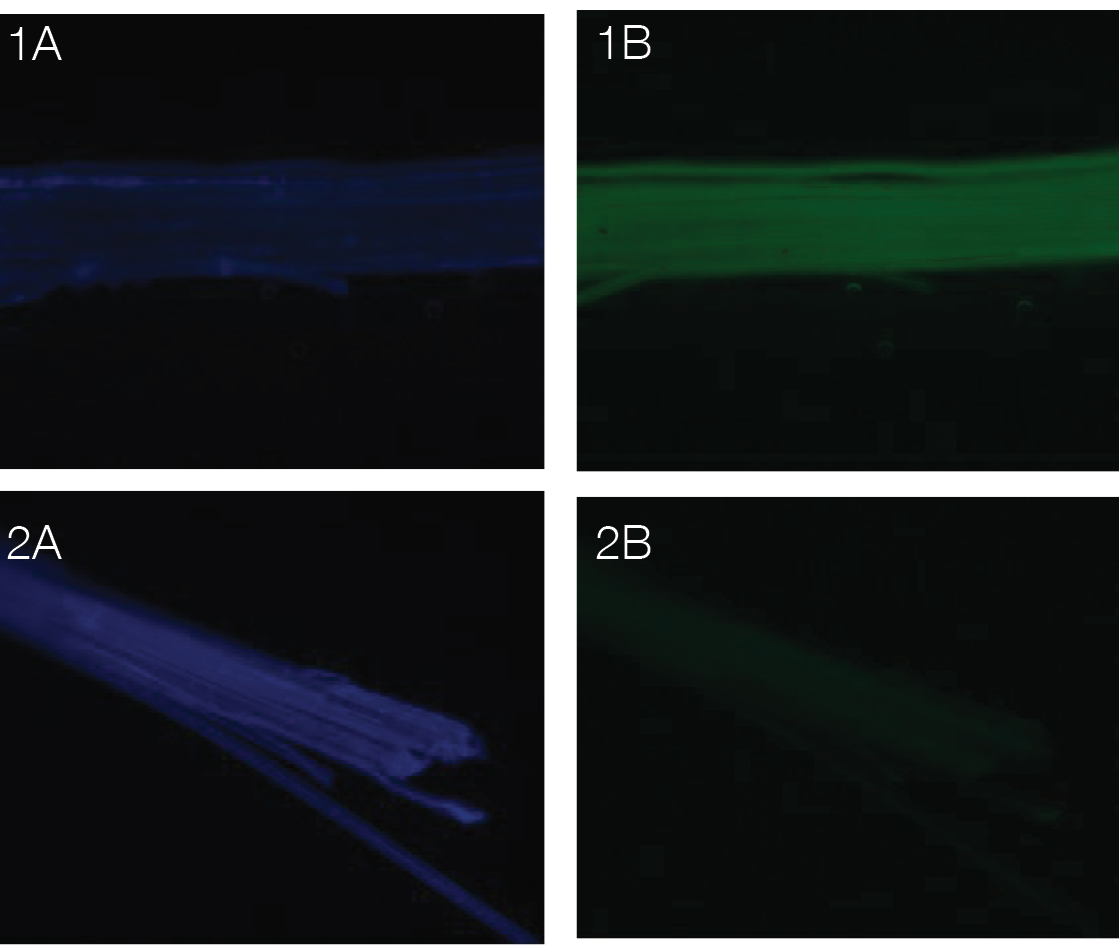
Figura 3. Microscopía de fluorescencia para el bagazo de caña1A y 1B sin tratamiento, 2A y 2B posterior a la hidrolisis básica (A. Celulosa B. Lignina).
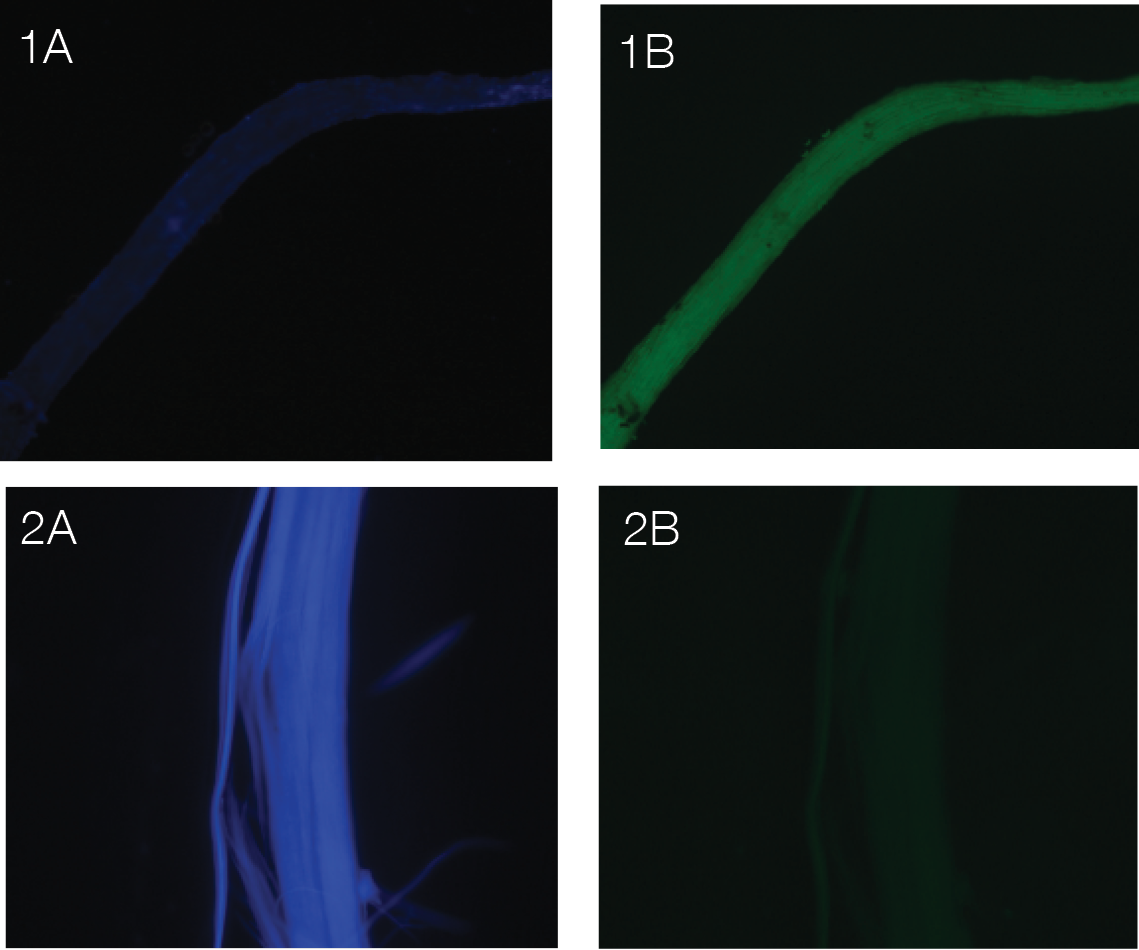
Figura 4 Microscopía de fluorescencia para el Raquis de palma. 1A y 1B sin tratamiento, 2A y 2B posterior a la hidrolisis básica (A. Celulosa B. Lignina).
Lo contrario pasa en la figura 3.2, en la cual el color azul es predominante y la lignina es poco visible, lo que indica que el tratamiento sí funciona para deslignificar el bagazo de caña, por lo tanto, esta figura apoya los resultados obtenidos en el Análisis Termogravimétrico. En el caso del raquis de palma (figura 4) se observa el mismo fenómeno, sin embargo, los cambios se ven con mayor intensidad de tal forma que la celulosa es casi imperceptible antes del tratamiento, pero al realizar la degradación de la lignina con NaOH se expone totalmente la celulosa y ahora, por el contrario, se dificulta observar la presencia de lignina residual en la parte superior de las fibras.
Microscopía electrónica de barrido (SEM)
En cuanto al análisis morfológico, se notan grandes diferencias tanto entre los tratamientos como entre las materias primas. La figura 6.1 muestra la manera en la que se separan las fibras de celulosa del raquis de palma, además de que ocurre una reducción en el tamaño de las fibras luego de cada tratamiento. Lo que produce que las fibras de raquis de palma pasen de 75-147 µm después de la hidrólisis básica a 6-12 µm después de la hidrólisis ácida. Esto se debe a que al degradar parte de la lignina y material gomoso que las mantenía unidas se da la separación en fibras más pequeñas.
Por otra parte, la figura 6.2 muestra al bagazo de caña, en el cual la reducción en el tamaño de las fibras es menos evidente, aunque sí se da ya que luego de la hidrólisis básica el tamaño es de 15-27 µm (sección más pequeña) y al finalizar el tratamiento ácido el tamaño disminuye a 10-18 µm. Esta disminución es menor a causa de que en el bagazo de caña no se ven fibras claras sino una especie de láminas, que estas a su vez se deben a la composición de la materia prima, pues si se observa la figura 5 se muestra como el material está compuesto por láminas que, por tanto, al degradarse se da la separación de las mismas, razón por la cual el bagazo degrado no presenta una estructura fibrilar.

Figura 5. Microscopía electrónica de barrido, de muestra de bagazo de caña sin tratar.
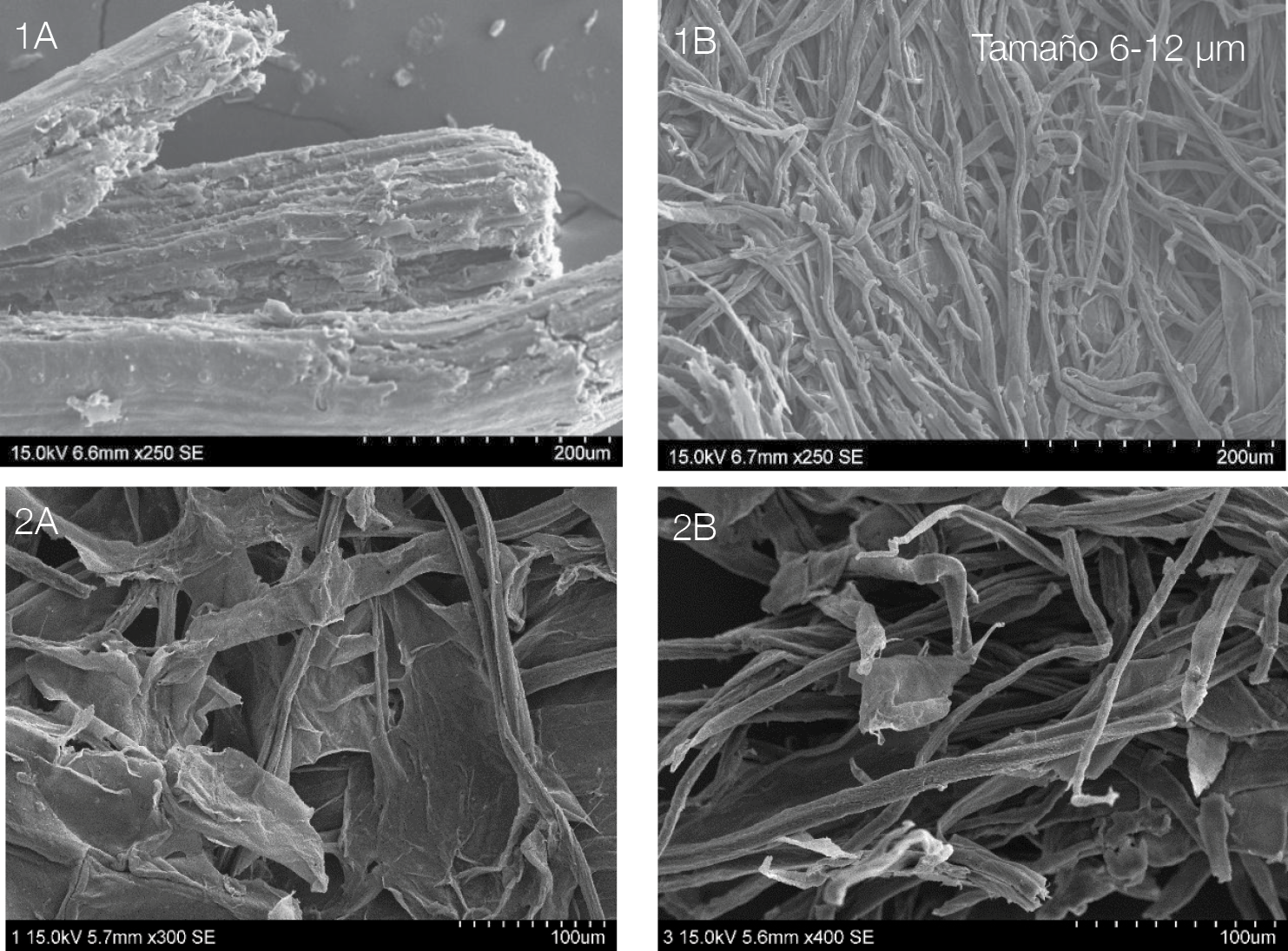
Figura 6. Microscopía electrónica de barrido.1A y 1B Raquis de palma africana, 2A y 2B Bagazo de caña (A. Hidrólisis básica B. Hidrólisis ácida).
Microscopía electrónica de transmisión (TEM)
Se observa en la figura 7 que se logra obtener nanocelulosa fibrilar, en donde los rangos de tamaño se encuentran entre 19-24 nm para las nanofibrillas obtenidas a partir de raquis de palma africana y entre 9,22-12 nm para las nanofibrillas obtenidas a partir del bagazo de caña. La obtención de nanofibras se debe principalmente a dos razones: (i) la hidrólisis ácida no corresponde a un tratamiento robusto, ya que se utiliza un ácido débil a una concentración relativamente baja (CH3COOH al 6 %), lo que no permite una separación de las regiones cristalinas de las fibras y como consecuencia se mantiene la fibra completa; (ii) se utilizó un tratamiento mecánico para reducir el tamaño de las microfibras y como resultado se mantienen tanto las regiones amorfas como cristalinas del material y solo se da una separación física en elementos más pequeños.
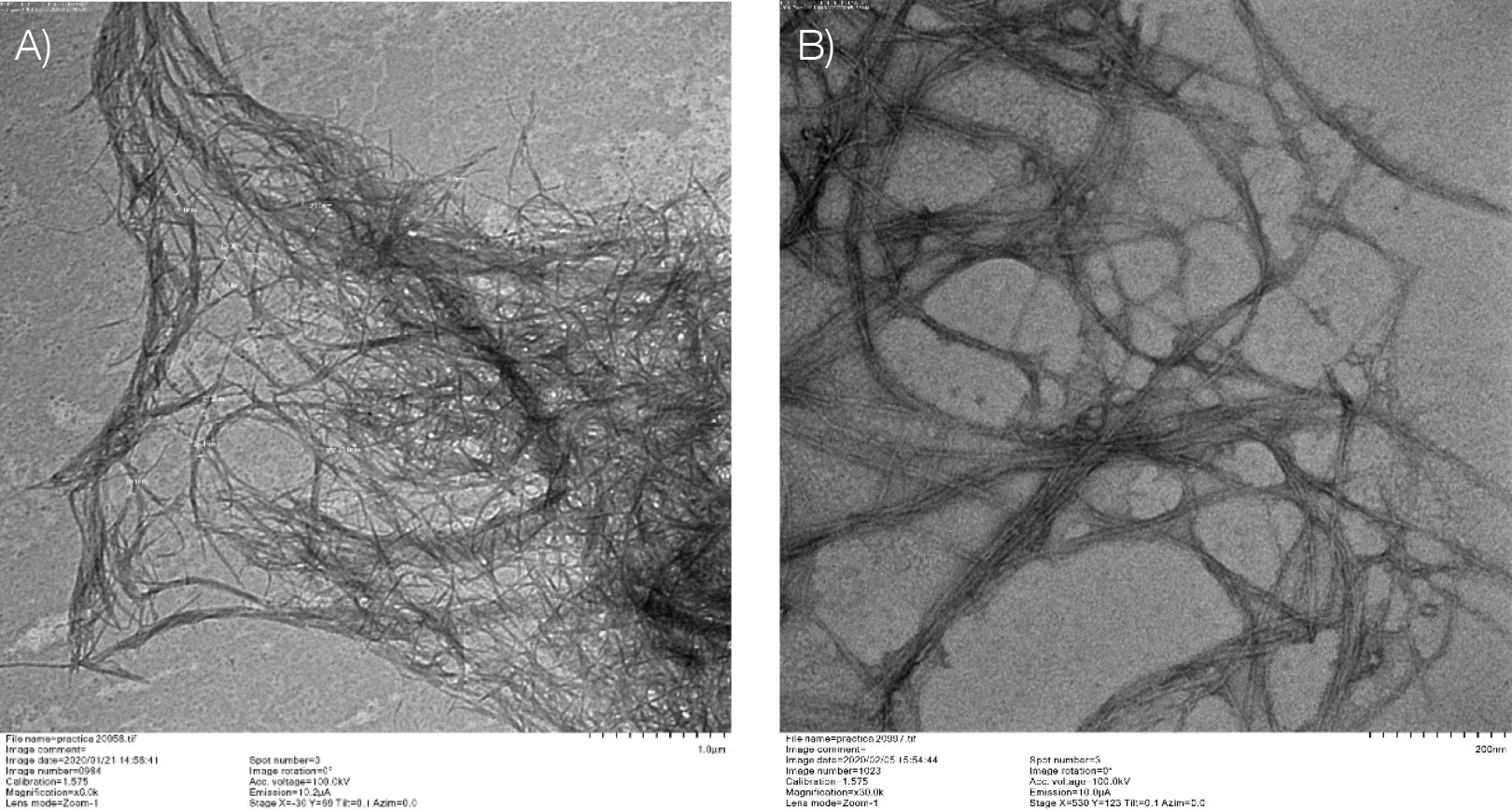
Figura 7. Microscopía electrónica de transmisión para la nanocelulosa. Muestra A: Raquis de palma africana Magnificación 6,0K., Muestra B: Bagazo de caña Magnificación 30.0K
Difracción de Rayos X (XRD)
Los difractogramas presentados en la figura 8 se utilizaron para determinar el Índice de Cristalinidad (IC), presentado en el cuadro 3. Este índice es una medida de la cristalinidad relativa de los materiales cuando se tiene una combinación de regiones cristalina y amorfas. Se observa en el raquis de palma africana que al realizar la degradación básica se aumenta el IC en un 18% mientras que al realizar el tratamiento ácido se aumenta un 12% para aumento de la cristalinidad total en el proceso de 30%.
Mientras que, para el caso del bagazo de caña al poseer mayor cristalinidad en la materia prima el primer proceso solo otorga un aumento en 4% del IC y un 10% con el tratamiento ácido. Para obtener un total de 14% en el aumento de cristalinidad.
El aumento en el IC con el primer tratamiento se da porque el NaOH después de cierta concentración es capaz de penetrar en la red de la celulosa para degradar carbohidratos en las regiones amorfas, producir una serie de complejos cristalinos bien definidos que contienen una serie de iones sodio y agua dentro de la red. Por otra parte, el aumento en el IC debido al segundo tratamiento se da a consecuencia de que los tratamientos ácidos son selectivos para degradar las regiones amorfas de las microfibras [50], [51]. Las señales encontradas en el espectro de Fibras tratadas con NaOH que no corresponden al pico cristalino ni amorfo de la celulosa se atribuyen a NaC [52] remanente de los lavados y neutralización del tratamiento básico, lo que generaría cristales de sal en la superficie.
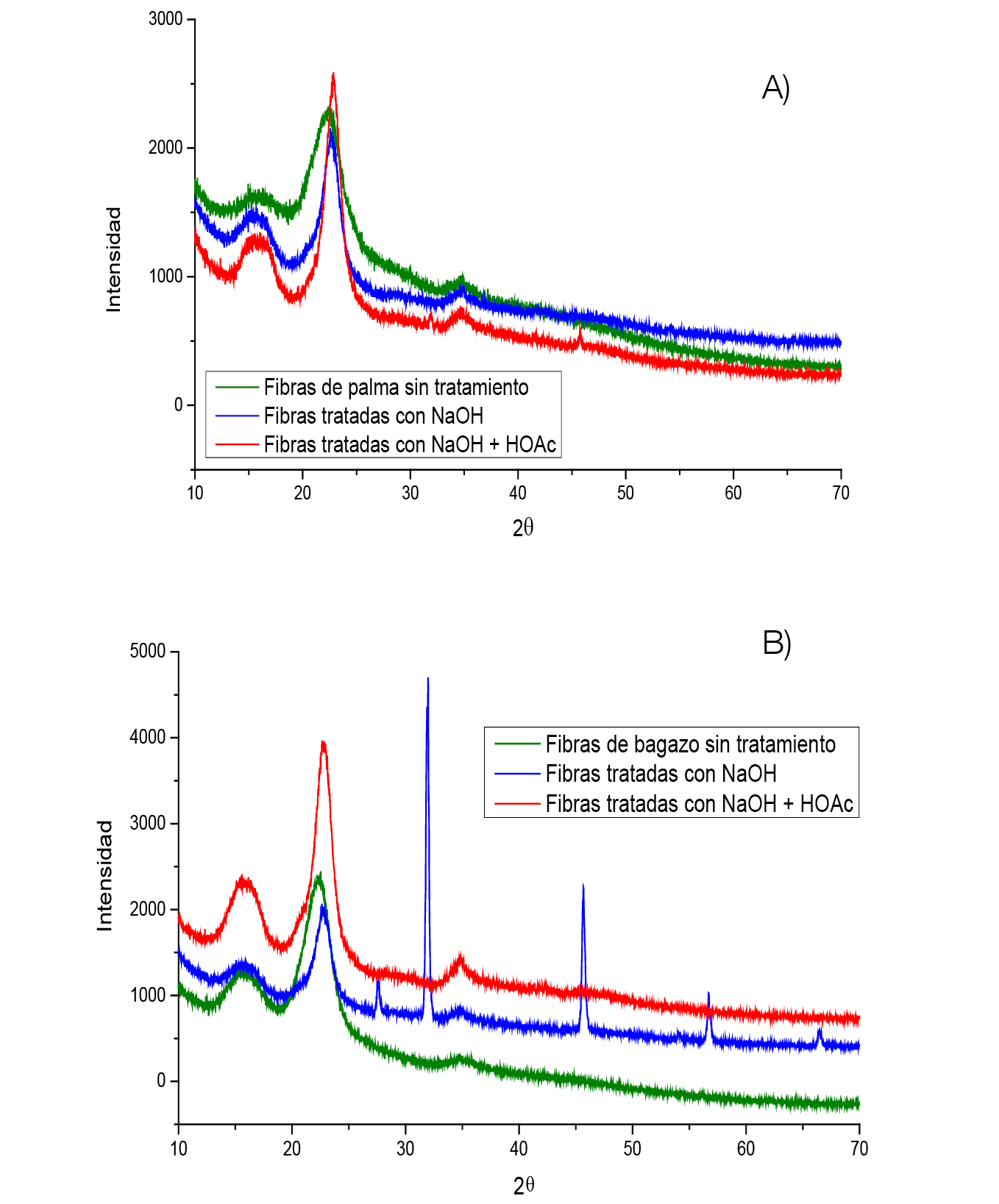
Figura 8. Difracción de rayos X. Muestra A: raquis de palma africana, muestra B: bagazo de caña.
Cuadro 3. Índice de cristalinidad para el raquis de palma africana y el bagazo de caña, acorde al tratamiento efectuado.
|
Cristalinidad (%) |
|||
|
Materia prima |
Sin tratar |
Tratamiento básico |
Tratamiento ácido |
|
Palma Africana |
40 |
58 |
70 |
|
Bagazo de caña |
56 |
60 |
70 |
Conclusiones y/o recomendaciones
La combinación de una hidrólisis básica con NaOH al 2 % (m/m) a 150 lb de presión y una hidrólisis ácida con CH3COOH al 6 % (m/m) a 100 lb de presión fue funcional para obtener celulosa a partir de un ráquis de palma africana que contenía 31,4±1,3 % de celulosa y 22,6±1,1 % de lignina, logrando un porcentaje de remoción de lignina de 74,1 %; dejando como consecuencia microfibras de celulosa de 6-12 µm. El mismo resultado se obtuvo con bagazo de caña que contenía 24,0±2,7 % de celulosa y 30,4±1,5 % de lignina. Al cual se le removió un 65,6% de lignina inicial y se obtuvo microcelulosa con estructura más laminar que fibrilar con un tamaño de 10-18 µm bajo las mismas condiciones. Esto demuestra una ventaja en la producción del material ya que usando reactivos comunes con concentraciones bajas y presiones moderadas se transformaron materiales lignocelulósicos considerados residuos en microcelulosa, la cual posee características fisicoquímicas que podrían resultar de interés en diversas aplicaciones.
Asimismo, al aplicar la sonificación se obtuvieron nanofibrillas de celulosa tanto del raquis de palma africana como del bagazo de caña con un tamaño de 19-24 nm y 9,22-12 nm respectivamente. Lo que conlleva a una clara transformación de la microcelulosa a escala nanométrica por un método que solo involucra agua como disolvente haciendo el proceso menos contaminante.
Además, se obtuvo una cristalinidad del 70 % en las nanofibrillas elaboradas a partir de las dos materias primas; destacando un aumento de 30 % del IC para el raquis de palma y de solo un 14 % para el bagazo de caña al finalizar los tratamientos químicos. Lo que revela que al usar reactivos a bajas concentraciones y presiones moderadas se obtiene microcelulosa pero esto influye muy poco en el aumento de cristalinidad cuando el material tiene un IC relativamente elevado ya que es un tratamiento poco robusto por sus condiciones.
Agradecimientos
A la Sede Caribe de la Universidad de Costa Rica. Al Instituto de Investigaciones en Ingeniería de la Universidad de Costa Rica (INII) y a su Unidad de Recursos Forestales (ReForesta).
Referencias
[1] INEC, “Encuesta Nacional Agropecuaria 2019. Resultados Generales de la Actividad Agrícola y Forestal,” San José, Costa Rica, 2020. [Online]. Available: https://www.inec.cr/sites/default/files/documetos-biblioteca-virtual/reena-cultivos2019.pdf.
[2] S. Mora Ramírez, R. Quesada Salas, L. Jaén Barrantes, and D. Monge Cordero, “Boletín Estadístico Agropecuario N° 30|Serie Cronológica 2016-2019,” 2020.
[3] C. I. Torres Pérez and L. A. Quintero Lopez, “Análisis de residuos sólidos de palma africana, como alternativa de aprovechamiento de energías renovables en el departamento del Cesar,” Ing. USBMed, vol. 10, no. 1, pp. 8–18, 2019, doi: 10.21500/20275846.3662.
[4] R. Rodríguez, “Aproveche desechos como energía,” La República, Dec. 28, 2013.
[5] CANAPALMA, “Antecedentes sobre el cultivo e industrialización de la palma africana en el país,” Quienes somos. http://www.canapalma.cr/?page_id=1195 (accessed Jan. 05, 2020).
[6] Programa CYMA Competitividad y Medio Ambiente, Plan de residuos sólidos-Informe de avance No1: Diagnóstico y áreas prioritarias. San José, Costa Rica: Editorama, 2007.
[7] C. Tenorio, R. Roque, and J. Valaert, “Characterisation of pellets made from oil palm residues in Costa Rica,” J. Palm Oil Res., vol. 28, pp. 198–210, Jun. 2016, doi: 10.21894/jopr.2016.2802.08.
[8] V. Gonzáles and J. Morin, “Costa Rica Sugar Annual Report: Executive Summary,” 2019. [Online]. Available: https://www.fas.usda.gov/data/costa-rica-sugar-annual-5.
[9] LAICA, “Ingenios,” Liga Agrícola Industrial de la Caña de Azucar. https://laica.cr/ingenios/ (accessed Jan. 02, 2019).
[10] F. D. Jiménez Rey, “ELABORACIÓN DE UN MATERIAL BIOLÓGICO A PARTIR DEL HONGO PLEUROTUS OSTREATUS PARA SU UTILIZACIÓN EN APLICACIONES DE INGENIERÍA,” Universidad de Costa Rica, 2018.
[11] R. G. Mejías Vásquez, “Evaluación del balance de energía del Sistema de Turbogeneración usado para la deficnición de la ‘Metodología Tarifaria para una Planta Modelo de Generación de Electricidad con Bagazo de Caña’ vigente en Costa Rica en el año 2015,” Universidad de Costa Rica, 2018.
[12] N. Bagotia, A. Kumar Sharma, and S. Kumar, “A review on modified sugarcane bagasse biosorbent for removal of dyes,” 2020, doi: 10.1016/j.chemosphere.2020.129309.
[13] J. Sandoval Salazar, “Potencial de aporte en generación eléctrica en Costa Rica por parte de los ingenios azucareros mediante biomasa,” Universidad de Costa Rica, 2014.
[14] A. Mandal and D. Chakrabarty, “Isolation of nanocellulose from waste sugarcane bagasse (SCB) and its characterization,” Carbohydr. Polym., vol. 86, no. 3, pp. 1291–1299, 2011, doi: 10.1016/j.carbpol.2011.06.030.
[15] D. Páliz Hidalgo, “Factibilidad del uso del raquis de palma africana en mezcla con agregados de construcción para la fabricación de ladrillos ecológicos,” Escuela Superior Politécnica de Chimborazo, 2014.
[16] B. Deepa et al., “Utilization of various lignocellulosic biomass for the production of nanocellulose: a comparative study,” Cellulose, vol. 22, no. 2, pp. 1075–1090, 2015, doi: 10.1007/s10570-015-0554-x.
[17] F. Jiang and Y.-L. Hsieh, “Chemically and mechanically isolated nanocellulose and their self-assembled structures,” Carbohydr. Polym., vol. 95, no. 1, pp. 32–40, 2013, doi: https://doi.org/10.1016/j.carbpol.2013.02.022.
[18] M. Jorfi and E. J. Foster, “Recent advances in nanocellulose for biomedical applications,” J. Appl. Polym. Sci., vol. 132, no. 14, pp. 1–19, 2015, doi: 10.1002/app.41719.
[19] H. V. Lee, S. B. A. Hamid, and S. K. Zain, “Conversion of lignocellulosic biomass to nanocellulose: Structure and chemical process,” Sci. World J., vol. 2014, 2014, doi: 10.1155/2014/631013.
[20] M. Camacho et al., “Synthesis and characterization of nanocrystalline cellulose derived from Pineapple peel residues,” J. Renew. Mater., vol. 5, no. 3–4, pp. 271–279, 2017, doi: 10.7569/JRM.2017.634117.
[21] P. Rigg-Aguilar, R. Moya, J. Vega-Baudrit, A. Navarro-Mora, and J. Gaitan-Alvarez, “European Pallets Fabricated with Composite Wood Blocks from Tropical Species Reinforced with Nanocrystalline Cellulose: Effects on the Properties of Blocks and Static Flexure of the Pallet,” Bioresour. Vol 14, No 2, 2019, [Online]. Available: https://ojs.cnr.ncsu.edu/index.php/BioRes/article/view/BioRes_14_2_3651_Rigg_Aguilar_European_Pallet_Composite_Wood_Blocks.
[22] P. Rigg-Aguilar et al., “Micro-and Nanofibrillated Cellulose (MNFC) from Pineapple (Ananas comosus) Stems and Their Application on Polyvinyl Acetate (PVAc) and Urea-Formaldehyde (UF) Wood Adhesives,” 2020, doi: 10.1155/2020/1393160.
[23] E. G. Jirón García, K. Rodríguez Mora, and C. Bernal, “Cellulose Nanofiber Production from Banana Rachis,” Int. J. Eng. Sci. Comput., vol. 10, no. 2, pp. 24683–24689, 2020.
[24] S. Michałowski, M. A. Mosiewicki, M. Kurańska, M. I. Aranguren, and A. Prociak, “Polyurethane composites synthesized using natural oil-based polyols and sisal fibers,” J. Renew. Mater., vol. 6, no. 4, pp. 426–437, 2018, doi: 10.7569/JRM.2017.634163.
[25] P. Rigg-Aguilar et al., “Micro- and Nanofibrillated Cellulose (MNFC) from Pineapple (Ananas comosus) Stems and Their Application on Polyvinyl Acetate (PVAc) and Urea-Formaldehyde (UF) Wood Adhesives,” J. Nanomater., vol. 2020, p. 1393160, 2020, doi: 10.1155/2020/1393160.
[26] E. Solís, “Efecto de la nanocelulosa obtenida del desecho del rastrojo de piñaen mezclas cementicidas de mortero hidráulico.,” Universidad de Costa Rica, 2018.
[27] T. Abitbol et al., “Nanocellulose , a tiny fiber with huge applications,” Curr. Opin. Biotechnol., vol. 39, no. I, pp. 76–88, 2016, doi: 10.1016/j.copbio.2016.01.002.
[28] P. Phanthong, P. Reubroycharoen, X. Hao, G. Xu, A. Abudula, and G. Guan, “Nanocellulose: Extraction and application,” Carbon Resour. Convers., vol. 1, no. 1, pp. 32–43, 2018, doi: 10.1016/j.crcon.2018.05.004.
[29] A. W. Carpenter, C. F. De Lannoy, and M. R. Wiesner, “Cellulose nanomaterials in water treatment technologies,” Environ. Sci. Technol., vol. 49, no. 9, pp. 5277–5287, 2015, doi: 10.1021/es506351r.
[30] Y. Liu et al., “Cascade utilization of lignocellulosic biomass to high-value products,” Green Chem., vol. 21, no. 13, pp. 3499–3535, 2019, doi: 10.1039/c9gc00473d.
[31] K. Rahbar Shamskar, H. Heidari, and A. Rashidi, “Study on Nanocellulose Properties Processed Using Different Methods and Their Aerogels,” J. Polym. Environ., vol. 27, no. 7, pp. 1418–1428, 2019, doi: 10.1007/s10924-019-01438-7.
[32] A. Mandal and D. Chakrabarty, “Studies on the mechanical, thermal, morphological and barrier properties of nanocomposites based on poly(vinyl alcohol) and nanocellulose from sugarcane bagasse,” J. Ind. Eng. Chem., vol. 20, no. 2, pp. 462–473, 2014, doi: https://doi.org/10.1016/j.jiec.2013.05.003.
[33] Y. Habibi, “Key advances in the chemical modification of nanocelluloses,” Chem. Soc. Rev., vol. 43, no. 5, pp. 1519–1542, 2014, doi: 10.1039/c3cs60204d.
[34] F. Jiang and Y. Lo Hsieh, “Chemically and mechanically isolated nanocellulose and their self-assembled structures,” Carbohydr. Polym., vol. 95, no. 1, pp. 32–40, 2013, doi: 10.1016/j.carbpol.2013.02.022.
[35] M. Mahardika, H. Abral, A. Kasim, S. Arief, and M. Asrofi, “Production of nanocellulose from pineapple leaf fibers via high-shear homogenization and ultrasonication,” Fibers, vol. 6, no. 2, pp. 1–13, 2018, doi: 10.3390/fib6020028.
[36] Q. Wang and Y. H. Zhang, “Extraction of nanocellulose from sugarcane bagasse,” Appl. Mech. Mater., vol. 633–634, pp. 550–553, 2014, doi: 10.4028/www.scientific.net/AMM.633-634.550.
[37] A. Cerda, L. Mejías, T. Gea, and A. Sánchez, “Cellulase and xylanase production at pilot scale by solid-state fermentation from coffee husk using specialized consortia: The consistency of the process and the microbial communities involved,” Bioresour. Technol., vol. 243, pp. 1059–1068, 2017, doi: 10.1016/j.biortech.2017.07.076.
[38] V. Hospodarova, E. Singovszka, and N. Stevulova, “Characterization of cellulosic fibers by FTIR spectroscopy for their further implementation to building materials,” Am. J. Anal. Chem., vol. 9, no. 06, p. 303, 2018.
[39] K. Singh, T. J. M. Sinha, and S. Srivastava, “Functionalized nanocrystalline cellulose: Smart biosorbent for decontamination of arsenic,” Int. J. Miner. Process., vol. 139, pp. 51–63, 2015, doi: 10.1016/j.minpro.2015.04.014.
[40] R. Zuluaga, J. L. Putaux, J. Cruz, J. Vélez, I. Mondragon, and P. Gañán, “Cellulose microfibrils from banana rachis: Effect of alkaline treatments on structural and morphological features,” Carbohydr. Polym., vol. 76, no. 1, pp. 51–59, 2009, doi: 10.1016/j.carbpol.2008.09.024.
[41] H. Quoc Lam, Y. Le Bigot, M. Delmas, and G. Avignon, “A new procedure for the destructuring of vegetable matter at atmospheric pressure by a catalyst/solvent system of formic acid/acetic acid. Applied to the pulping of triticale straw,” Ind. Crops Prod., vol. 14, no. 2, pp. 139–144, 2001, doi: 10.1016/S0926-6690(01)00077-2.
[42] M. M. Ibrahim, F. A. Agblevor, and W. K. El-Zawawy, “Isolation and characterization of cellulose and lignin from steam-exploded lignocellulosic biomass,” BioResources, vol. 5, no. 1, pp. 397–418, 2010, doi: 10.15376/biores.5.1.397-418.
[43] M. Poletto, A. J. Zattera, M. M. C. Forte, and R. M. C. Santana, “Thermal decomposition of wood: Influence of wood components and cellulose crystallite size,” Bioresour. Technol., vol. 109, pp. 148–153, 2012, doi: 10.1016/j.biortech.2011.11.122.
[44] A. Alemdar and M. Sain, “Biocomposites from wheat straw nanofibers: Morphology, thermal and mechanical properties,” Compos. Sci. Technol., vol. 68, no. 2, pp. 557–565, 2008, doi: https://doi.org/10.1016/j.compscitech.2007.05.044.
[45] R. Moya, A. Rodríguez-Zúñiga, and A. Puente-Urbina, “Thermogravimetric and devolatilisation analysis for five plantation species: Effect of extractives, ash compositions, chemical compositions and energy parameters,” Thermochim. Acta, vol. 647, pp. 36–46, 2017, doi: 10.1016/j.tca.2016.11.014.
[46] N. Števulova, V. Hospodárova, and A. Eštoková, “Study of thermal analysis of selected cellulose fibres,” Geosci. Eng., vol. 62, no. 3, pp. 18–21, 2016.
[47] C. H. Haigler, R. M. Brown, and M. Benziman, “Calcofluor White ST Alters the in vivo Assembly of Cellulose Microfibrils,” Science (80-. )., vol. 210, no. 4472, pp. 903–906, Jan. 1980, [Online]. Available: http://www.jstor.org.ezproxy.sibdi.ucr.ac.cr:2048/stable/1684445.
[48] J. F. Ma, G. H. Yang, J. Z. Mao, and F. Xu, “Characterization of anatomy, ultrastructure and lignin microdistribution in Forsythia suspensa,” Ind. Crops Prod., vol. 33, no. 2, pp. 358–363, 2011, doi: 10.1016/j.indcrop.2010.11.009.
[49] H. M. Hernández-Hernández et al., “Spectroscopic and Microscopic Study of Peroxyformic Pulping of Agave Waste,” Microsc. Microanal., vol. 22, no. 5, pp. 1084–1097, 2016, doi: 10.1017/S1431927616011818.
[50] P. Ahvenainen, I. Kontro, and K. Svedström, “Comparison of sample crystallinity determination methods by X-ray diffraction for challenging cellulose I materials,” Cellulose, vol. 23, no. 2, pp. 1073–1086, 2016, doi: 10.1007/s10570-016-0881-6.
[51] A. Kljun, T. A. S. Benians, F. Goubet, F. Meulewaeter, J. P. Knox, and R. S. Blackburn, “Comparative analysis of crystallinity changes in cellulose i polymers using ATR-FTIR, X-ray diffraction, and carbohydrate-binding module probes,” Biomacromolecules, vol. 12, no. 11, pp. 4121–4126, 2011, doi: 10.1021/bm201176m.
[52] J. J. Prías-Barragán, N. A. Echeverry-Montoya, and H. Ariza-Calderón, “Fabricación y caracterización de carbón activado y de nanoplaquetas de carbón a partir de Guadua angustifolia Kunth para aplicaciones en electrónica,” Rev. la Acad. Colomb. Ciencias Exactas, Físicas y Nat., vol. 39, no. 153, p. 444, 2015, doi: 10.18257/raccefyn.139.
1 Investigador. Ingeniería Química, Universidad de Costa Rica, Sede del Caribe. Costa Rica. Correo electrónico: eddy.jiron@ucr.ac.cr https://orcid.org/0000-0002-7524-9033
https://orcid.org/0000-0002-7524-9033
2 Investigador. Unidad de Recursos Forestales, Instituto de Investigaciones en Ingeniería, Universidad de Costa Rica. Costa Rica. Investigador. Ingeniería Química, Universidad de Costa Rica, Sede del Caribe. Costa Rica. Correo electrónico: karina.rodriguezmora@ucr.ac.cr https://orcid.org/0000-0001-9660-4623
https://orcid.org/0000-0001-9660-4623
3 Investigador. Ingeniería Química, Universidad de Costa Rica, Sede del Caribe. Costa Rica. Correo electrónico: cesar.bernal@ucr.ac.cr  https://orcid.org/0000-0001-7891-7618
https://orcid.org/0000-0001-7891-7618