Presencia de microplásticos en especies marinas del Parque Nacional Marino las Baulas
Presence of microplastics in marine species of the Marine National Park las Baulas
Angélica Astorga-Pérez1, Karol Ulate-Naranjo2, Lilliana Abarca-Guerrero3
Fecha de recepción: 5 de febrero de 2021
Fecha de aprobación: 15 de junio de 2021
Astorga Pérez, A; Ulate-Naranjo, K; Abarca-Guerrero, L. Presencia de microplásticos en especies marinas del Parque Nacional Marino las Baulas4. Tecnología en Marcha. Vol. 35-2. Abril-Junio 2022. Pág 27-38. https://doi.org/10.18845/tm.v35i2.5466
https://doi.org/10.18845/tm.v35i2.5466
Palabras clave
Microplástico; pelágico; biota marina; carnívoros; digestión química.
Resumen
La ingesta de microplásticos (MPs) en diversas especies marinas ha sido reportada en la literatura, sin embargo, el grado de contaminación en los sistemas y la biota asociada a estos es poco conocido. En este estudio se presentan los resultados de la presencia de microplásticos en siete especies de peces pelágicos y de una especie de crustáceo bentónico, todos de alto nivel trófico del Parque Nacional Marino Las Baulas.
Mediante digestión química e inspección visual se extrajeron microplásticos del sistema digestivo de 56 individuos. Un total de 90 piezas fueron extraídas del 89% de los peces (93% fibras) con 3,75±1,70 (SD) microplástico/pez. Se determinó una cantidad significativamente menor en los crustáceos con un total de 58 piezas extraídas del 76% de los individuos analizados con 2,64±1,36 (CF) microplástico/jaiba. Se realiza una búsqueda de microplásticos en tejidos musculares mediante la técnica de histología y se encontraron lesiones en el tejido muscular de los peces, pero los resultados no fueron atribuibles a MP, por ende, no se ahondará en estos datos.
Este artículo reporta la presencia de estos contaminantes en especies marinas de alto nivel trófico en la costa del Pacífico de Costa Rica, lo cual confirma la afectación por plásticos en la zona de estudio, reforzándose la necesidad de una gestión adecuada de los residuos sólidos generados por la población, tanto en la zona terrestre como en la zona marítima.
Keywords
Pelagic; marine biota; carnivorous; chemical digestion.
Abstract
The ingestion of microplastics has been reported in various marine species, however, the degree of contamination in the systems and the biota associated with them is little known. This study presents the results of the presence of microplastics in seven species of pelagic fish and one species of benthic crustacean, all high trophic level from Las Baulas Marine National Park.
By chemical digestion and visual inspection, microplastics were extracted from the digestive system of 56 individuals. A total of 90 pieces were extracted from 89% of the fish (93% fibers) with 3.75 ± 1.70 (SD) microplastic / fish. A significantly lower quantity was obtained in crustaceans with a total of 58 pieces extracted from 76% of the individuals analyzed with 2.64 ± 1.36 (CF) microplastic / crab. A search for microplastics in muscle tissues was carried out using the histology technique and lesions were found in the muscle tissue of the fish, but the results were not attributable to MP, therefore, these data will not be delved into.
This article reports the presence of these pollutants in marine species with a high trophic level on the Pacific coast of Costa Rica, which confirms the impact by plastics in the study area, reinforcing the need for an integral solid waste management system.
Introducción
El plástico es un polímero sintético muy cotizado en la industria debido a su resistencia, versatilidad y bajo costo [1]. Según los registros mundiales, desde el 2014 se producen anualmente más de 300 millones de toneladas de plástico, del cual se estima que un 50% de todo este material termina en el ambiente debido a su mal manejo; y aproximadamente entre 4,8 y 12,7 millones de toneladas métricas acaban en los ecosistemas marinos como microplásticos [2].
Los microplásticos (MPs) se definen como cualquier partícula sólida sintética o de una matriz polimérica, con un rango de tamaño entre 1 µm a 5 mm [3]. Estos consisten en partículas manufacturadas de dimensiones microscópicas consideradas fuentes primarias; como pellets utilizados en la industria y aplicaciones domésticas. Las fuentes secundarias son aquellos que se forman debido a las condiciones climáticas y la fragmentación de plásticos de mayor dimensión [3]–[5]. Los tipos de polímeros más utilizados mencionados previamente tienen alto peso molecular y no son biodegradables. Dentro del ecosistema marino comienzan a sufrir degradación foto-oxidativa por la irradiación solar ultravioleta (UV), seguido de degradación térmica y/o química [6], [7].
A pesar de que existe evidencia de contaminación de microplásticos alrededor del mundo, poco se ha investigado en su impacto en áreas marinas protegidas [8]. Estas zonas han sido establecidas con el fin de reducir la degradación de los hábitats y limitar la explotación de recursos. A pesar de lo anterior, están expuestas a la contaminación plástica existiendo informes de la infiltración de microplásticos en las redes alimentarias de las costas a pesar de encontrarse lejos de las ciudades y de las fuentes de contaminación puntuales [9].
La ingesta de MPs en los organismos marinos representa una preocupación en aumento debido a los riesgos toxicológicos asociados con estas micropartículas [10]. Existen estudios en donde se ha comprobado la ingesta de MPs al identificar diferentes tipos de partículas de polímeros en los intestinos y estómagos de varios organismos, como el zooplancton [11], mariscos [12] (incluyendo mejillones, ostras, almejas y cangrejos), coral [13], peces [14] y mamíferos marinos [15].
Otros estudios han encontrado MPs en órganos no relacionados con el tracto digestivo y que no participan en la digestión, como en las branquias del mejillón Mytilus edulis [16] y órganos como el hígado en peces demersales y pelágicos [17]. Además, se ha investigado la adherencia de MPs en tejidos suaves de las almejas, en donde se encontraron adherencias a órganos específicos como al tejido visceral, las quelas y el aductor. Estos contribuían al 50% del MPs en las almejas [18].
En Costa Rica se ha iniciado la investigación sobre microplásticos en años recientes. Se da inicio con estudios en la sardina gallera del Pacífico Central, en donde se determinó que un 100% de los organismos analizados contenían MPs en el sistema digestivo [19]. Se continuó con un monitoreo en arena de playas de las costas pacífica y caribeña de nuestro país, realizados por investigadores del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR) [20]. Por último, la Escuela de Biología Marina de la Universidad Nacional de Costa Rica (UNA) y el Laboratorio de Estudios Marinos Costeros (LEMACO) han trabajo con prácticas estudiantiles en la búsqueda de una metodología que les permita determinar estas piezas en organismos marinos [21].
El objetivo de esta investigación es contribuir con el conocimiento sobre la presencia de estos materiales, específicamente en especies marinas comerciales cuyas muestras han sido tomadas en una zona dedicada a la conservación, pero que cuenta con influencia antropogénica. En esta investigación se ofrecen datos sobre la presencia del MPs encontrados en los sistemas digestivos de las especies marinas muestreadas. Como es el caso del Parque Nacional Marinos las Baulas. En este parque existen diversos tipos de mangle y tiene la particularidad de que la mayoría de los terrenos que lo forman pertenece a empresas privadas [22].
Metodología
Los crustáceos Callinectes arcuatus (jaibas) son los organismos bentónicos elegidos para el estudio. Estos se escogieron debido a su abundancia en la zona, su consumo humano y facilidad de captura [23]. En el caso de los peces pelágicos, se capturaron por medio de pesca artesanal ya que permite obtener individuos que habitan en la columna con poca profundidad. Cabe destacar que no se definió una especie en particular debido a que se desconoce las especies predominantes en la zona, por ende, se priorizó la selectividad del método de captura.
Área de Estudio
Este estudio se realizó en el Parque Nacional Marino las Baulas (PNMB), del Área de Conservación Tempisque (ACT), ubicado en la provincia de Guanacaste, cantón de Santa Cruz, en los distritos de Cabo Velas y 27 de abril, a 8 km de la comunidad de Matapalo y a 20 km de Tamarindo vía terrestre y 5 km vía estero. En la figura 1 se muestra la ubicación del PNMB y los sectores en donde se recolectan los crustáceos (Playa Grande, 10°19’28.5”N 85°50’31.6”W) y los peces (Estero de Playa Grande, 10°18’44.0”N 85°50’03.7”W).
La gira de campo se realizó del 27 al 30 de enero del 2020. La recolección de los crustáceos se realizó trazando un transecto de 2 km paralelo con la playa durante los dos periodos de marea baja de cada día, este recorrido se realizó dos veces por cada visita. Para obtener los peces, se efectuaron jornadas de 6 horas de monitoreo a lo largo del Estero de Playa Grande durante los 4 días de la gira.
Al finalizar el periodo de muestreo de cada día, los crustáceos se colocaron en frascos con alcohol al 70%. A los peces se le tomaron las medidas morfológicas de longitud estándar, longitud furcal, longitud total y longitud dorsoventral, además, cada organismo fue enumerado y fotografiado. Se disectó el sistema digestivo (el cual incluye: estómago, intestino hígado, páncreas y ciegos pilóricos) y se colocó en envases con alcohol al 70%. Las muestras fueron trasladadas al laboratorio de la UNA en estos envases.
En total se lograron capturar 27 peces de 7 especies distintas Centropomus viridis, Lutjanus colorado, Centropomus armatus, Caranx caninus, Centropomus medius, Lutjanus novemfasciatus, Elops affinis y 29 crustáceos Callinectes arcuatus.
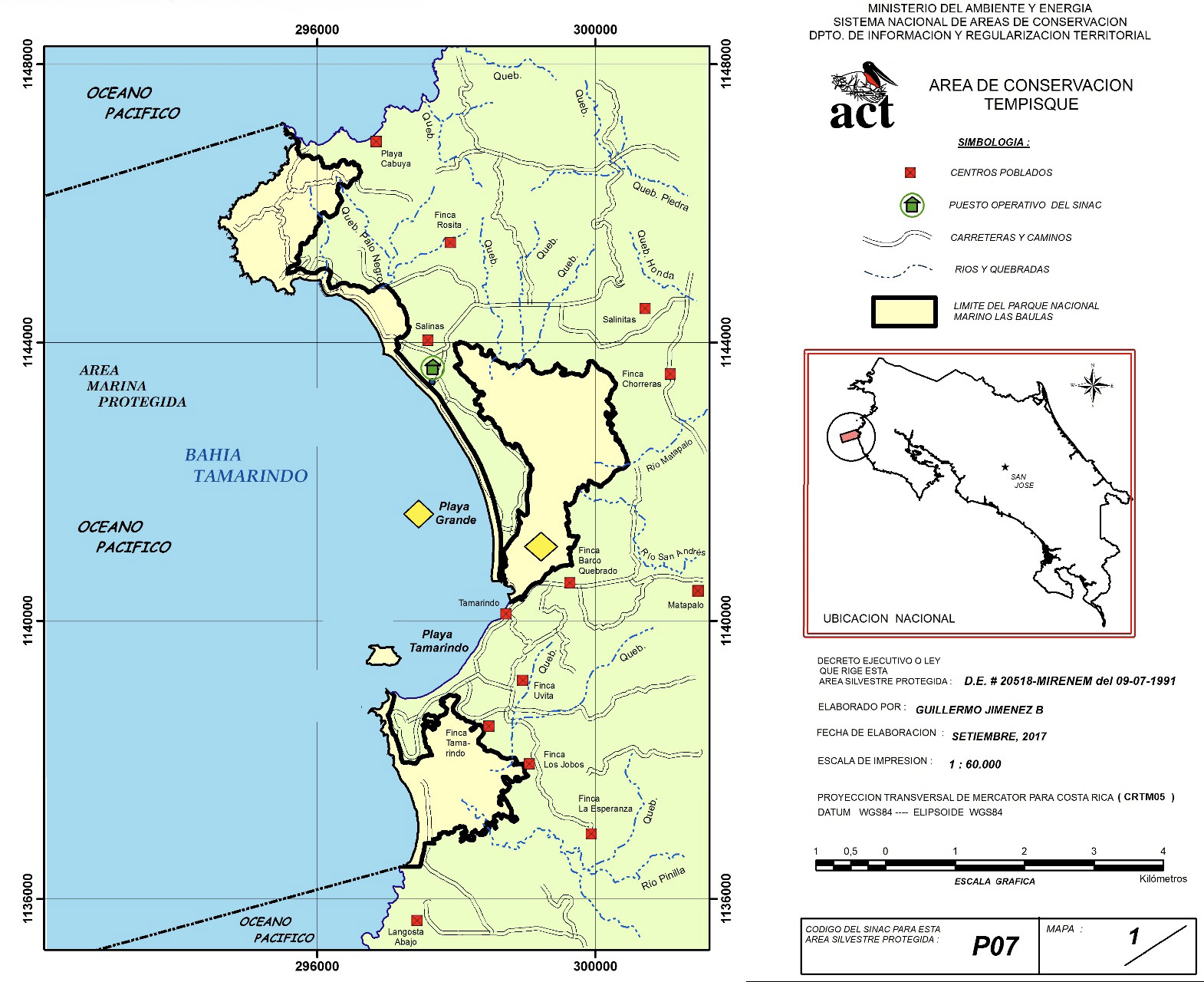
Figura 1. Área de estudio con los límites del área protegida del PNMB. Estrellas amarillas marcan los sectores en donde se recolectan las muestras. Fuente: SINAC, 2021.
Extracción de los microplásticos del sistema digestivo de los peces y cefalotórax de los crustáceos
En la figura 2 se muestran los pasos de la metodología empleada para la extracción de los MPs en el sistema digestivo de los peces y el cefalotórax de las jaibas. Esta se basó en metodologías propuestas en diversas investigaciones en biota marina [6], [24]–[28] incluyendo el uso de ácido acético para el tratamiento de la quitina [29] presente en el residuo post digestión de las muestras. Este consiste en una digestión química con KOH (ac,10%, m/m), durante 24 horas y 60 ̊C, con una posterior visualización por técnicas ópticas [25]. En los casos en que el resultado post digestión tenía alto contenido de quitina, se realizó un tratamiento con ácido acético (ac,4%, v/v) para convertir parte de la quitina en quitosano y mejorar el proceso de visualización.
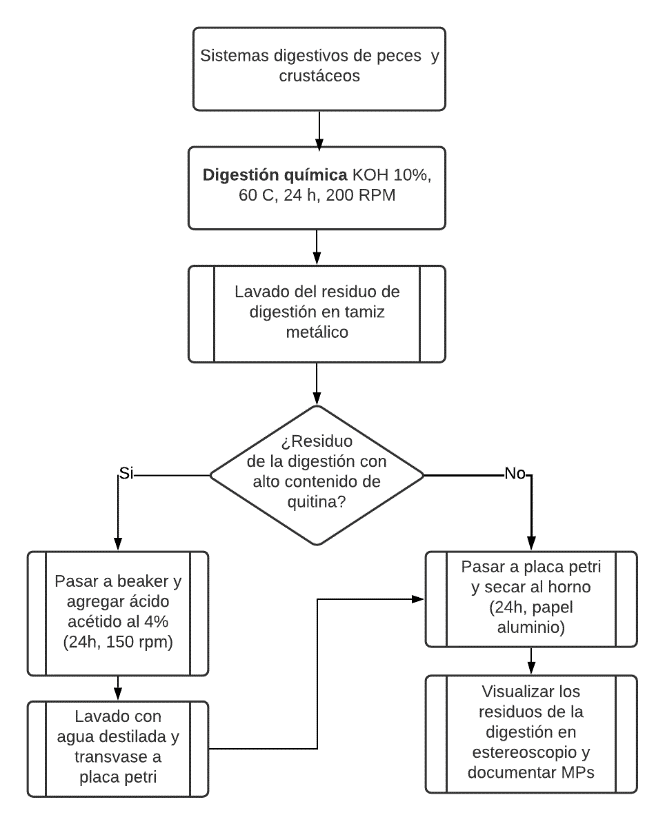
Figura 2. Metodología desarrollada para la determinación de MPs en especies marinas de alto nivel trófico. Fuente propia, basado en [6], [24]–[28].
Identificación física (color tamaño y forma) de los MPs
Para la visualización y búsqueda de MPs al microscopio se tomaron en consideración los lineamientos planteados en el Guía de Identificación de Microplásticos del Marine and Environmental Research Institute [25]. En esta guía se introducen al usuario las características físicas esenciales para describir los MPs, el equipo necesario para su visualización y la manera correcta de leer un filtro o placa Petri. Se hace mención que al identificar MPs se deben pinchar las piezas para determinar su textura ya que la mayoría de los MPs presentan una cierta flexibilidad y no se rompen. Además de que la mayoría de los MPs rebotan o brincan al ser pinchados. Si la pieza se rompe, no debe ser considerada como MP.
Resultados
Estimación de los microplásticos presentes en el sistema digestivo de las especies marinas muestreadas
En el cuadro 1 se muestran los principales resultados obtenidos en los organismos analizados con respecto a la longitud promedio de los individuos, la cantidad de MPs encontrados, la frecuencia de ocurrencia, el total de MPs extraídos y el promedio por individuo.
Se determinó la presencia de MPs en el sistema digestivo de los peces y en el cefalotórax de las jaibas. Un total 148 MPs fueron documentados, 90 en los peces y 58 en las jaibas. En los peces se obtuvo un promedio de 3.75±1.70 (SD) MP/pez, mientras que en estudios realizados en biota marina se reportan datos menores [30]–[32] por ejemplo Vlachogianni et al. [33] en el Mar Jordánico reporta un promedio de 1.3 piezas/pez en especies demersales. Por el contrario, solo Abbasi et al. y Anastasopoulou et al. [17], [34] reportan concentraciones superiores de MPs/individuo a la obtenida en este estudio. Referente a los crustáceos bentónicos costeros carnívoros (como la jaiba), se determinó un promedio de 2.64±1.36 MPs/jaiba. En crustáceos se han realizado estudios en especies de langostinos y crustáceos decápodos, sin embargo, debido al método de muestreo los resultados se reportaron como MPs/gramos de tejido analizado [35], [36]. Por lo tanto, la información no es comparable debido a los diferentes métodos utilizados.
Cuadro 1. Resultados obtenidos del muestreo de MPs sistemas digestivos de peces y jaibas.
|
Características |
Peces |
Jaibas |
|
Cantidad de sistemas digestivos analizados |
27 |
29 |
|
Longitud promedio de los individuos analizados |
(35.3 ± 10.5) cm |
(50.8 ± 9.3) mm |
|
Rango de longitud de los individuos analizados |
(19.8 - 72.3) cm |
(36.6 - 85.7) mm |
|
Cantidad de individuos con al menos 1 MP |
24 |
22 |
|
Frecuencia de ocurrencia de MPs |
89% |
76% |
|
Cantidad de MPs totales extraídos |
90 |
58 |
|
MPs promedio por individuo |
3.75 ± 1.70 |
2.64 ± 1.36 |
Para discriminar la ocurrencia de MPs en diferentes especies o áreas geográficas, se estableció utilizar el dato de frecuencia de ocurrencia de MP [24]. Para esta investigación, se encontraron 90 MPs en 24 de los peces muestreados. Por lo tanto, 89% de los peces contiene al menos un MP en el sistema digestivo. En el caso de las jaibas, se determinaron 58 MPs en 22 de los individuos analizados, lo cual representa un 76% de ocurrencia. Los valores reportados en otros lugares del mundo varían desde 0.9% a 76.6% en el sistema digestivo de peces de mayor interés comercial [37]. En el caso de crustáceos se reportan concentraciones desde 13% [45] hasta 67% [47].
De acuerdo con lo mencionado, estos resultados determinan una cantidad significativamente mayor de MPs/ individuo en los peces pelágicos en comparación con los crustáceos bentónicos (Prueba t-Student, p=0.0004), no hay una diferencia significativa (p=0.203) entre la frecuencia de ocurrencia de MPs entre los peces (organismos pelágicos) y las jaibas (organismos bentónicos). Debido a las diferencias entre especies, zonas muestreadas y métodos de captura, los valores obtenidos no son comparables con los valores reportados en otros estudios.
A pesar de que la zona de muestreo es un área en conservación, es esperado que se encuentren estos contaminantes en la biota. Esto por cuanto se ha demostrado la presencia de los plásticos en zonas inhabitadas, como las regiones polares [38], en las profundidades del océano y montañas prístinas [39].
En el caso específico del PNMB, existen razones puntuales que podrían estar relacionadas con estos resultados. La primera es la actividad antropogénica cercana al parque; ya que como se observa en la figura 1, este se encuentra ubicado cerca de la localidad de Tamarindo. Este distrito es frecuentado por un volumen considerable de turistas y locales, lo cual provoca que el parque sea una zona vulnerable a los problemas asociados a las actividades desarrolladas en sus cercanías; como la gestión de los residuos sólidos, la descarga de aguas residuales y aguas grises, entre otros [40].
En general, los ecosistemas de manglar, debido a la geomorfología y las características de las raíces de sus árboles, pueden estar atrapando y reteniendo más residuos sólidos que otros. Adicionalmente, estos ecosistemas reciben desechos tanto de fuentes terrestres como marinas. Las fuentes terrestres son debidas a actividades antropogénicas, cuyos residuos son arrastrados por la escorrentía de los ríos que desembocan directamente al manglar. Adicionalmente, las fuentes marinas transportan materiales provenientes del océano, que por corrientes arrastra residuos de otros lugares, y los introduce, con las diferentes mareas, en las estrechas entradas del manglar, quedando atrapados [41], [42].
Analizando la zona de estudio y las posibles fuentes de contaminación, se pudo observar que la entrada de agua dulce del PNMB es aportada por los afluentes de dos quebradas y de los ríos, de poco caudal, Matapalo y Andrés. En las cercanías del PNMB se encuentra el poblado de Tamarindo, conocido por su alta afluencia turística, pero debido a su ubicación, baja altitud y al no estar conectado con otros afluentes, este pueblo no incide directamente en estos cuerpos de agua. Por estas razones, no se considera que el río sea la mayor fuente de contaminación del manglar, sino, el aporte del océano, el cual depende de las corrientes marinas influenciadas por la Contracorriente Ecuatorial del Norte (CCEN) [43].
Según lo mencionado anteriormente se puede considerar que esta zona acumula residuos concentrando contaminantes que pueden afectar el ecosistema. Lo cual reafirma que la contaminación por plásticos afecta a los países, aún a pesar de las fronteras, debido al transporte de larga distancia de residuos en los diferentes sistemas [44].
Identificación física (color, tamaño y forma) de los MPs
En el cuadro 2 se presentan algunas características físicas de todos los MPs encontrados.
Cuadro 2. Características físicas de los MPs encontrados.
|
Parámetros |
Peces |
Jaibas |
|
Rango de tamaño de los MPs |
(5 254-128) µm |
(3 597-101) µm |
|
Promedio del tamaño de los MPs |
1188 µm |
1130 µm |
|
Colores |
Azul (predominante) café, negro, rojo, transparente, blanco |
Negro y azul (predominantes), blanco, rojo, transparente |
|
Cantidad de MPs extraídos con forma de fibras |
84 (93%) |
54 (93%) |
|
Cantidad de MPs extraídos con forma de partículas |
6 (7%) |
4 (7%) |
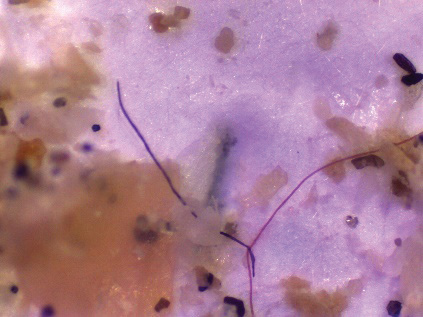


Figura 4, 5, 6. Variedad de MPs encontrados en los organismos analizados.
En las figuras 4, 5, 6 se muestran algunos de los MPs extraídos del sistema digestivo de los peces y en el cefalotórax de las jaibas. En el cuadro 2, se determina un amplio rango de tamaño de MPs, siendo en promedio aproximadamente 1 mm. Además, el límite inferior determinado es cercano a los 100 µm. El tamaño y el color de las micropartículas son características físicas que usualmente se reportan en los estudios para describir lo encontrado [33], [45], [46]. Esta información puede ser útil en caso de comparar sitios de muestreo, organismos, o incluso, analizar fuentes de contaminación en el laboratorio [25].
De los MPs extraídos en ambos organismos, un 93% son fibras y un 7% partículas. La predominancia de fibras coincide con lo reportado en otros estudios [23]–[28] en donde se atribuye la incidencia de esta forma de MPs con su la facilidad de transporte y distribución en el océano.
Según el hábitat en donde se alimentan los organismos, así puede ser su disponibilidad de ingerir ciertos tipos de MPs [23]. Los organismos pelágicos habitan en aguas libres y no tocan el fondo marino, por ende, su exposición es a los MPs flotantes, como es el caso de las fibras. Los organismos bentónicos habitan en el fondo marino, por lo que están más expuestos a los MPs más densos con capacidad de hundirse y que se encuentran en los sedimentos del fondo marino [24].
Las especies de peces analizadas en este estudio son carnívoros de alto nivel trófico y consumen crustáceos como las jaibas [47], por lo tanto, las posibles fuentes de ingesta de estas microfibras son las piezas distribuidas en la columna de agua y las que contienen los crustáceos. Por el contrario, las fuentes de ingesta de MPs de los crustáceos (como las jaibas) es menor ya que se encuentran en el fondo marino [23].
Conclusiones
Este estudio demuestra que una mala gestión de los residuos sólidos afecta a especies marinas aun en zonas de conservación, se determinó además, la presencia de MPs en el sistema digestivo de las especies analizadas.
Se observa la presencia de estos contaminantes dentro del sistema digestivo del 89% de los individuos de peces y en un 76% de los crustáceos analizados. En total se logran determinar 3.75 ± 1.70 MPs/pez y 2.64 ± 1.36 MPs/crustáceo. En concordancia con estudios previos mencionados anteriomente, predomina la presencia de fibras en los peces y en los crustáceos, ya que representan un 93% de los MPs determinados. Además, el tamaño promedio de MPs es de aproximadamente 1 mm y los colores predominantes son azul y negro.
Recomendaciones
•Costa Rica cuenta con una serie de políticas públicas e instrumentos de gestión y planificación relacionada con la gestión de residuos, pero carece de un Plan Nacional de Residuos Marinos. Por lo anterior, se insta a la formulación de un Plan Nacional de Acción para reducir la contaminación que llega a nuestros mares.
•Continuar con estudios para la determinación de MPs en especies marinas de alto nivel trófico en Costa Rica ya que nos proporcionan información sobre la incidencia de estos contaminantes en hábitats y especies de interés comercial. Esta puede ser utilizada para determinar indicadores ambientales, fuentes de contaminación y desarrollar métodos de gestión para abordar este problema.
Agradecimientos
Gracias a la Escuela de Ciencias Biológicas de la Universidad Nacional, por la prestación de sus instalaciones y materiales de trabajo, más específicamente al Laboratorio de Biotecnología de Docencia (LABID), Laboratorio de Histología y Laboratorio de Estudios Marino Costeros (LEMACO). A M.Sc. Catalina Víquez Murillo, especialista veterinaria, por su ayuda con la lectura e interpretación de las placas de histología. Gracias a los financiadores para la obtención de muestras: Environmental Science and Resource Management Program de California State University Channel Islands y al Great Basin Institute de Reno, Nevada. También agradecemos al Sistema Nacional de Áreas de Conservación (SINAC), específicamente al Área de Conservación Tempisque por el otorgamiento de los permisos de investigación para la extracción de las muestras, bajo los permisos: ACT-OR-DR-021-2019 y ACT-OR-DR-019-2020.
Referencias
[1] M. Cole, P. Lindeque, C. Halsband, y T. S. Galloway, «Microplastics as contaminants in the marine environment: A review», Marine Pollution Bulletin, vol. 62, n.o 12. pp. 2588-2597, dic. 2011, doi: 10.1016/j.marpolbul.2011.09.025.
[2] O. S. Ogunola, O. A. Onada, y A. E. Falaye, «Mitigation measures to avert the impacts of plastics and microplastics in the marine environment (a review).», Environ. Sci. Pollut. Res. Int., vol. 25, n.o 10, pp. 9293-9310, abr. 2018, doi: 10.1007/s11356-018-1499-z.
[3] N. B. Hartmann et al., «Are We Speaking the Same Language? Recommendations for a Definition and Categorization Framework for Plastic Debris», Environ. Sci. Technol., vol. 53, n.o 3, pp. 1039-1047, feb. 2019, doi: 10.1021/acs.est.8b05297.
[4] J. P. G. L. Frias y R. Nash, «Microplastics: Finding a consensus on the definition», Mar. Pollut. Bull., vol. 138, pp. 145-147, ene. 2019, doi: 10.1016/j.marpolbul.2018.11.022.
[5] R. C. Thompson et al., «Lost at Sea: Where Is All the Plastic?», Science (80-. )., vol. 304, n.o 5672, p. 838, may 2004, doi: 10.1126/science.1094559.
[6] A. L. Andrady, «Microplastics in the marine environment», Marine Pollution Bulletin, vol. 62, n.o 8. pp. 1596-1605, ago. 2011, doi: 10.1016/j.marpolbul.2011.05.030.
[7] A. A. Shah, F. Hasan, A. Hameed, y S. Ahmed, «Biological degradation of plastics: A comprehensive review», Biotechnology Advances, vol. 26, n.o 3. Elsevier, pp. 246-265, may 01, 2008, doi: 10.1016/j.biotechadv.2007.12.005.
[8] A. M. Saley et al., «Permalink Publication Date Microplastic accumulation and biomagnification in a coastal marine reserve situated in a sparsely populated area», Mar. Pollut. Bull., vol. 146, pp. 54-59, 2019, doi: 10.1016/j.marpolbul.2019.05.065.
[9] T. Agardy, G. N. di Sciara, y P. Christie, «Mind the gap: Addressing the shortcomings of marine protected areas through large scale marine spatial planning», Mar. Policy, vol. 35, n.o 2, pp. 226-232, mar. 2011, doi: 10.1016/j.marpol.2010.10.006.
[10] Z. Akdogan y B. Guven, «Microplastics in the environment: A critical review of current understanding and identification of future research needs», Environmental Pollution, vol. 254. Elsevier Ltd, p. 113011, nov. 01, 2019, doi: 10.1016/j.envpol.2019.113011.
[11] X. Sun, Q. Li, M. Zhu, J. Liang, S. Zheng, y Y. Zhao, «Ingestion of microplastics by natural zooplankton groups in the northern South China Sea», Mar. Pollut. Bull., vol. 115, n.o 1-2, pp. 217-224, feb. 2017, doi: 10.1016/j.marpolbul.2016.12.004.
[12] J. Li et al., «Microplastics in mussels along the coastal waters of China», Environ. Pollut., vol. 214, pp. 177-184, jul. 2016, doi: 10.1016/j.envpol.2016.04.012.
[13] J. Reichert, J. Schellenberg, P. Schubert, y T. Wilke, «Responses of reef building corals to microplastic exposure», Environ. Pollut., vol. 237, pp. 955-960, jun. 2018, doi: 10.1016/j.envpol.2017.11.006.
[14] E. Hermsen, S. M. Mintenig, E. Besseling, y A. A. Koelmans, «Quality Criteria for the Analysis of Microplastic in Biota Samples: A Critical Review», Environmental Science and Technology, vol. 52, n.o 18. American Chemical Society, pp. 10230-10240, sep. 18, 2018, doi: 10.1021/acs.est.8b01611.
[15] M. C. Fossi et al., «Fin whales and microplastics: The Mediterranean Sea and the Sea of Cortez scenarios», Environ. Pollut., vol. 209, pp. 68-78, feb. 2016, doi: 10.1016/j.envpol.2015.11.022.
[16] M. A. Browne, A. Dissanayake, T. S. Galloway, D. M. Lowe, y R. C. Thompson, «Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis (L.)», Environ. Sci. Technol., vol. 42, n.o 13, pp. 5026-5031, jul. 2008, doi: 10.1021/es800249a.
[17] S. Abbasi, N. Soltani, B. Keshavarzi, F. Moore, A. Turner, y M. Hassanaghaei, «Microplastics in different tissues of fish and prawn from the Musa Estuary, Persian Gulf», Chemosphere, vol. 205, pp. 80-87, ago. 2018, doi: 10.1016/j.chemosphere.2018.04.076.
[18] P. Kolandhasamy, L. Su, J. Li, X. Qu, K. Jabeen, y H. Shi, «Adherence of microplastics to soft tissue of mussels: A novel way to uptake microplastics beyond ingestion», Sci. Total Environ., vol. 610-611, pp. 635-640, ene. 2018, doi: 10.1016/j.scitotenv.2017.08.053.
[19] S. Rodriguez, «Microplásticos llenan sistema digestivo de sardinas del Pacífico Central tico, revela estudio», Amelia Rueda, 2020. https://www.ameliarueda.com/nota/sardinas-pacifico-central-microplasticos-digestivo-ucr-costa-rica-noticias (accedido sep. 05, 2021).
[20] CICA, «Inicia análisis de microplásticos en playas de Costa Rica – Centro de Investigación en Contaminación Ambiental», 2019. http://cica.ucr.ac.cr/?p=6303 (accedido sep. 05, 2021).
[21] LEMACO, «LEMACO:Servicios ofrecidos», 2021. https://www.biologia.una.ac.cr/index.php/servicios-ofrecidos-lemaco (accedido sep. 05, 2021).
[22] G. Quesada, «La importancia del Parque Nacional Marino Las Baulas», Acontecer, 2010. https://www.uned.ac.cr/acontecer/opinion/articulos/577-la-importancia-del-parque-nacional-marino-las-baulas (accedido sep. 05, 2021).
[23] S. Fischer y M. Wolff, «Fisheries assessment of Callinectes arcuatus (Brachyura, Portunidae) in the Gulf of Nicoya, Costa Rica», Fish. Res., vol. 77, n.o 3, pp. 301-311, 2006, doi: 10.1016/j.fishres.2005.11.009.
[24] F. Bessa, T. Kogel, J. Frias, y A. Lusher, «Harmonized protocol for monitoring microplastics in biota», Micropoll-Multilevel Assess. microplastics Assoc. Pollut. Balt. Sea View Proj., n.o April, pp. 1-30, 2019, doi: 10.13140/RG.2.2.28588.72321/1.
[25] M. & E. R. Institute, «Guide to Microplastic Identification (Dissecting Microscope)», p. 14, 2012.
[26] F. M. Baalkhuyur et al., «Microplastic in the gastrointestinal tract of fishes along the Saudi Arabian Red Sea coast», Mar. Pollut. Bull., vol. 131, n.o April, pp. 407-415, 2018, doi: 10.1016/j.marpolbul.2018.04.040.
[27] P. Agamuthu, «Marine debris, plastics, microplastics and nano-plastics: What next?», Waste Management and Research, vol. 36, n.o 10. SAGE Publications Ltd, pp. 869-871, oct. 01, 2018, doi: 10.1177/0734242X18796770.
[28] A. G. M. Caron, C. R. Thomas, K. L. E. Berry, C. A. Motti, E. Ariel, y J. E. Brodie, «Validation of an optimised protocol for quantification of microplastics in heterogenous samples: A case study using green turtle chyme», MethodsX, vol. 5, pp. 812-823, 2018, doi: 10.1016/j.mex.2018.07.009.
[29] M. Á. Ramírez, A. T. Rodríguez, L. Alfonso, y C. Peniche, «La quitina y sus derivados, biopolímeros con potencialidades de aplicación agrícola», 2010.
[30] O. Güven, K. Gökdağ, B. Jovanović, y A. E. Kıdeyş, «Microplastic litter composition of the Turkish territorial waters of the Mediterranean Sea, and its occurrence in the gastrointestinal tract of fish», Environ. Pollut., vol. 223, pp. 286-294, 2017, doi: 10.1016/j.envpol.2017.01.025.
[31] A. Markic et al., «Double trouble in the South Pacific subtropical gyre: Increased plastic ingestion by fish in the oceanic accumulation zone», Mar. Pollut. Bull., vol. 136, pp. 547-564, nov. 2018, doi: 10.1016/j.marpolbul.2018.09.031.
[32] C. A. Peters, P. A. Thomas, K. B. Rieper, y S. P. Bratton, «Foraging preferences influence microplastic ingestion by six marine fish species from the Texas Gulf Coast», Mar. Pollut. Bull., vol. 124, n.o 1, pp. 82-88, nov. 2017, doi: 10.1016/j.marpolbul.2017.06.080.
[33] T. Vlachogianni et al., «Marine litter on the beaches of the Adriatic and Ionian Seas: An assessment of their abundance, composition and sources», Mar. Pollut. Bull., vol. 131, n.o A, pp. 745-756, 2018, [En línea]. Disponible en: https://doi.org/10.1016/j.marpolbul.2018.05.006.
[34] A. Anastasopoulou, C. Mytilineou, C. J. Smith, y K. N. Papadopoulou, «Plastic debris ingested by deep-water fish of the Ionian Sea (Eastern Mediterranean)», Deep. Res. Part I Oceanogr. Res. Pap., vol. 74, pp. 11-13, abr. 2013, doi: 10.1016/j.dsr.2012.12.008.
[35] D. Wójcik-Fudalewska, M. Normant-Saremba, y P. Anastácio, «Occurrence of plastic debris in the stomach of the invasive crab Eriocheir sinensis», Mar. Pollut. Bull., vol. 113, n.o 1-2, pp. 306-311, dic. 2016, doi: 10.1016/j.marpolbul.2016.09.059.
[36] N. A. C. Welden y P. R. Cowie, «Environment and gut morphology influence microplastic retention in langoustine, Nephrops norvegicus», Environ. Pollut., vol. 214, pp. 859-865, jul. 2016, doi: 10.1016/j.envpol.2016.03.067.
[37] C. Walkinshaw, P. K. Lindeque, R. Thompson, T. Tolhurst, y M. Cole, «Microplastics and seafood: lower trophic organisms at highest risk of contamination», Ecotoxicol. Environ. Saf., vol. 190, p. 110066, mar. 2020, doi: 10.1016/j.ecoenv.2019.110066.
[38] A. L. Lusher, V. Tirelli, I. O’Connor, y R. Officer, «Microplastics in Arctic polar waters: The first reported values of particles in surface and sub-surface samples», Sci. Rep., vol. 5, oct. 2015, doi: 10.1038/srep14947.
[39] S. Allen et al., «Atmospheric transport and deposition of microplastics in a remote mountain catchment», Nat. Geosci., vol. 12, n.o 5, pp. 339-344, may 2019, doi: 10.1038/s41561-019-0335-5.
[40] J. C. Picón Cruz y V. J. Baltodano Zúñiga, «Planificación turística en zonas costeras de Costa Rica. Algunas referencias a Playa Tamarindo (Santa Cruz, Guanacaste)», InterSedes, vol. 7, n.o 13, pp. 149-170, 2006.
[41] C. Calderón, O. Aburto, y E. Ezcurra, «El valor de los manglares», Biodiversitas, n.o 82, pp. 1-6, 2009.
[42] C. Martin et al., «Exponential increase of plastic burial in mangrove sediments as a major plastic sink.», Sci. Adv., vol. 6, n.o 44, 2020, doi: https://doi.org/10.1126/sciadv.aaz5593.
[43] E. Proyecto y B. Marino, «CARACTERIZACIÓN ECOLÓGICA DEL SECTOR MARINO DEL PARQUE NACIONAL MARINO LAS BAULAS DE GUANACASTE Serie Técnica 15», 2015.
[44] P. Li, X. Wang, M. Su, X. Zou, L. Duan, y H. Zhang, «Characteristics of Plastic Pollution in the Environment: A Review», Bulletin of Environmental Contamination and Toxicology. Springer, 2020, doi: 10.1007/s00128-020-02820-1.
[45] A. L. Lusher, M. McHugh, y R. C. Thompson, «Occurrence of microplastics in the gastrointestinal tract of pelagic and demersal fish from the English Channel», Mar. Pollut. Bull., vol. 67, n.o 1-2, pp. 94-99, feb. 2013, doi: 10.1016/j.marpolbul.2012.11.028.
[46] J. Bellas, J. Martínez-Armental, A. Martínez-Cámara, V. Besada, y C. Martínez-Gómez, «Ingestion of microplastics by demersal fish from the Spanish Atlantic and Mediterranean coasts», Mar. Pollut. Bull., vol. 109, n.o 1, pp. 55-60, ago. 2016, doi: 10.1016/j.marpolbul.2016.06.026.
[47] W. Fischer, F. Krupp, W. Schneider, C. C. Sommer, K. . Carpenter, y V. Niem, «Guia FAO para Identification de Especies para lo Fines de la Pesca. Pacifico Centro-Oriental», Rome, 1995.
1 Instituto Tecnológico de Costa Rica, Escuela de Química. Costa Rica.
Correo electrónico: angelica.astorga.perez@gmail.com  https://orcid.org/0000-0003-2373-0455
https://orcid.org/0000-0003-2373-0455
2 Universidad Nacional, Escuela de Ciencia Biológicas. Costa Rica.
Correo electrónico: karol.ulate.naranjo@una.ac.cr https://orcid.org/0000-0001-5687-555X
https://orcid.org/0000-0001-5687-555X
3 Instituto Tecnológico de Costa Rica. Costa Rica.
Correo electrónico: labarca@itcr.ac.cr  https://orcid.org/0000-0001-5129-3104
https://orcid.org/0000-0001-5129-3104