Pesca de Octopus sp. en las costas de Cuajiniquil, Guanacaste, Costa Rica
Octopus sp. fishing on the coast of Cuajiniquil, Guanacaste, Costa Rica
Adrián Mora-Gamboa1, Milagro Carvajal-Oses2,
Rooel Campos-Rodríguez3
Fecha de recepción: 8 de junio de 2020
Fecha de aprobación: 13 de setiembre de 2020
Mora-Gamboa, A; Carvajal-Oses, M;
Campos-Rodríguez, R. Pesca de Octopus sp. en las costas de Cuajiniquil, Guanacaste, Costa Rica. Tecnología en Marcha. Vol. 34-3 Julio-Setiembre 2021. Pág 96-107. https://doi.org/10.18845/tm.v34i3.5205
https://doi.org/10.18845/tm.v34i3.5205
Palabras clave
Cefalópodo; biometría; esfuerzo pesquero; flota artesanal.
Resumen
En Cuajiniquil, Pacífico Norte de Costa Rica; se practica la pesquería del pulpo Octopus sp. mediante el buceo y el arte de pesca denominado “bichero”, sin embargo, este recurso no ha contado con las medidas necesarias para un manejo sostenible. El objetivo de la investigación es aportar información biológica sobre Octopus sp. que permita un aprovechamiento sostenible en Costa Rica. Se realizaron muestreos mensuales durante seis meses entre mayo del 2018 y marzo del 2019 de Octopus sp. con ayuda de la flota artesanal en la zona de estudio. Se determinaron los siguientes parámetros biométricos: peso (g), la longitud dorsal del manto (cm), longitud total (cm) y ancho (cm). Se identificó el sexo por medio de la presencia/ausencia del hectocótilo y se obtuvo la relación talla-peso. Solo existieron diferencias significativas en el ancho (cm) de los organismos de acuerdo al sexo (p<0,05), la proporción entre sexos no mostró diferencias significativas (p≥0,05), y la relación talla-peso resultó ser alométrico negativo para ambos sexos. Estadísticamente (p<0,05) las tallas menores de organismos se identificaron en la época lluviosa, específicamente noviembre. El arte de pesca utilizado es no selectivo, los datos mostraron que se están pescando organismos de menos tamaño que los establecidos y recomendados en la literatura. En un posible plan de manejo se recomienda no extraer organismos en el mes de noviembre pues existe alta presencia de organismos juveniles y es requerido establecer medidas sostenibles de extracción.
Keywords
Cephalopod; biometry; fishing effort; artisanal fleet.
Abstract
In Cuajiniquil, North Pacific of Costa Rica; Octopus sp. through diving and the fishing gear called “hook”, however, this resource has not contacted the necessary measures for sustainable management. The objective of the research is to provide biological information about Octopus sp. that allows a sustainable use in Costa Rica. Monthly samplings were carried out for six months between May 2018 and March 2019 of Octopus sp. with the help of the artisanal fleet in the study area. The following biometric parameters were determined: weight (g), the dorsal length of the mantle (cm), total length (cm) and width (cm). Sex was identified through the presence / absence of hectocotyl and the length-weight relationship was obtained. There are only determined differences in the width (cm) of the organisms according to sex (p <0,05), the sex ratio without different differences (p≥0,05), and the height-weight relationship turned out to be negative allometric for both sexes. Statistically (p <0,05) the smallest sizes of organisms were identified in the rainy season, specifically November. The fishing gear used is not selective, the data showed that organisms of smaller sizes than those established and recommended in the literature are being removed. In a possible management plan, it is recommended not to extract organisms in the month of November because there is a high presence of juvenile organisms and it is required to establish sustainable extraction measures.
Introducción
Los octópodos están presentes en regiones tropicales y templadas; son parte de una pequeña clase de moluscos marinos, corresponden a especies bentónicas que habita una gran variedad de fondos, desde rocosos, arenosos hasta praderas submarinas, y en un rango de profundidades muy variado, desde la orilla hasta los 200 metros [1]. Según [2] cuando se encuentra en fondos arenosos es capaz de excavar guaridas para acumular restos de presas. Según estos mismos autores los pulpos pasan la mayor parte de las horas de sol en sus guaridas, saliendo a cazar al anochecer.
Presentan una gran variedad de coloraciones, no obstante, debido a su relación filogenética complica la identificación de las especies por lo que actualmente se utilizan metodologías moleculares cada vez más avanzadas, así por ejemplo el caso de Octopus vulgaris el cual se ha dificultado catalogarlo con el estatus de verdadera especie o como un complejo de especies [3].
Se estima que entre los 110-150 días de vida los organismos estén comenzando la madurez sexual, o bien alcanzan la talla de primera madurez, pueden tener dos picos reproductivos al año [4] [5] y la mayoría de las especies viven entre 10 y 15 meses y mueren después del desove [6].
Además, son animales con capacidad para camuflarse; adaptan su visión a diferentes niveles de luz; poseen una línea lateral (análoga a los peces) para escuchar y detectar a larga distancia la presencia de los depredadores; son los únicos cefalópodos con memoria quimiotáctil y presentan un sentido del olfato desarrollado [7].
La mayoría de los cefalópodos, responden rápidamente a las variaciones ambientales debido a que tienen un ciclo de vida corto y se cree que podrían ser especies bioindicadoras del cambio climático [4]. Se ha demostrado que altas temperaturas podrían influenciar en el tiempo de su desarrollo embrionario (de días a meses) e inclusive afectar a los juveniles [8].
En Costa Rica la pesca de pulpo se realiza sobre todo en la especie Octopus vulgaris; y de manera general Octopus sp. se ha capturado principalmente en las zonas de Sámara, El Coco y Cuajiniquil [9]. Además, existe una carencia de estudios científicos en Octopus sp. lo que ha dificultado establecer las medidas pertinentes para un adecuado ordenamiento pesquero y es que como lo indica [10] datos básicos como tallas mínimas de captura, época y potencial de reproducción son fundamentales para un manejo adecuado de cualquier recurso.
Este trabajo tiene como objetivo aportar información biológica de Octopus sp. y su pesquería, que permita el establecimiento de fundamentos científicos para el establecimiento de un manejo sostenible del recurso.
Metodología
Área de estudio
El área de estudio abarcó la plataforma continental y la zona costera alrededor de pueblo de Cuajiniquil, distrito de San Elena, Cantón de la Cruz, provincia de Guanacaste, Costa Rica y cuyas coordenadas geográficas correspondieron a 10°38’37’’ N. 85°38’17’’W (Figura 1). Los ejemplares de Octopus sp., muestreados fueron capturados por la flota artesanal de Cuajiniquil utilizando el buceo y el “gancho” o fisga como arte de pesca, el cual consistió en una varilla de hierro de 60-80 cm de largo aproximadamente, en cuyo extremo se encuentra un anzuelo amarrado con alambre. La pesca se realizó cerca de las áreas rocosas, a una profundidad entre 2 a 20 metros. Las embarcaciones utilizadas fueron de fibra de vidrio y madera de entre 6 a 7 m de eslora, equipadas con un motor fuera de borda de entre 70 a 115 caballos de fuerza y participaron de 3 a 4 buzos por embarcación. Los registros se llevaron a cabo en los meses de mayo, agosto, setiembre y noviembre del 2018; y entre febrero y marzo del 2019. Se realizaron mediciones biométricas para 137 individuos.
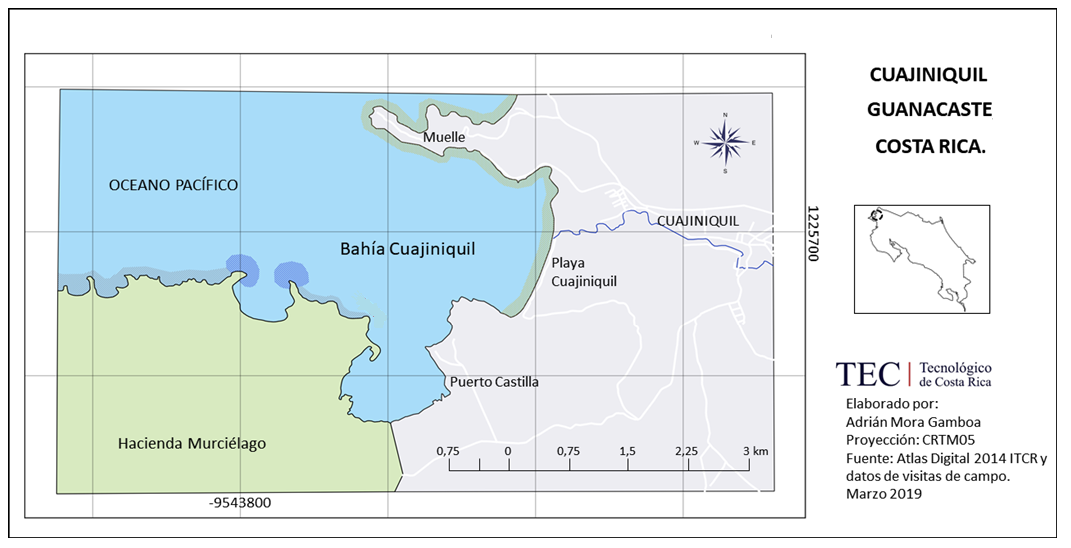
Figura 1. Área de estudio, Cuajiniquil, Guanacaste, Costa Rica.
Parámetros biométricos
Se registraron las siguientes variables para todos los organismos capturados, peso (g) para lo cual se utilizó una balanza digital con capacidad mínima de 20 gramos y máxima de 30 kg, para la longitud dorsal del manto (LDM) (cm); el ancho del manto (cm) y longitud total (cm) se utilizó un ictiómetro de madera con precisión de centímetros y una longitud total de 1 metro. Se determinó el sexo mediante la presencia o ausencia del órgano sexual denominado hectocótilo.
Relación talla-peso
Los datos obtenidos de longitud y peso total se examinaron mediante la hoja de cálculo de Microsoft Excel, con el fin de determinar el tipo de crecimiento tanto isométrico como alométrico de acuerdo al sexo. Un valor de b = 3 indica crecimiento isométrico, mientras que los valores de b<3 indican crecimiento alométrico negativo y valores de b > 3 indican crecimiento alométrico positivo [11] [12] [13]. Las estimaciones fueron conducidas para obtener la ecuación potencial de las relaciones corporales [11]:
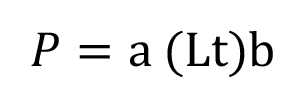
Donde:
P: peso en gramos
a: Factor de condición
Lt: longitud total en cm
b: pendiente.
Esfuerzo Pesquero y Caracterización de la flota
La captura por unidad de esfuerzo (CPUE) de los meses que comprendió la toma de datos, se estimó relacionando la captura (C) en kilogramos (kg) y el esfuerzo de pesca (E) en horas efectivas de pesca según la ecuación de [14].
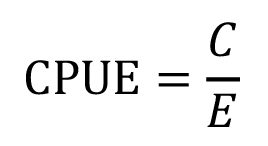
Se analizó las frecuencias de captura de acuerdo al peso (g), LDM (cm) y el sexo, esto con el fin de determinar el nivel de selectividad del arte de pesca utilizado.
Análisis estadístico
Se utilizaron las variables de longitud, peso, LDM, y ancho y se compararon de acuerdo a la época climática (época seca: febrero y marzo; época lluviosa: mayo, agosto, setiembre, noviembre), mes muestreado y sexo. Se verificó la normalidad y homocestacidad de los datos. Solamente, la longitud cumplió con ambos aspectos por tanto se utilizó la Prueba de Fisher para dicha variable. En cuanto a las otras variables se aplicó la prueba no paramétrica de Kruskal Wallis.
Para la proporción de hembras- machos se realizó una prueba Chi-cuadrado (χ²) para determinar si la proporción de sexos difiere a 1:1. Fueron excluidos del análisis los individuos en que no fue posible identificar el sexo. Para todos los análisis se consideró un nivel de significancia (α) de 0,05. Se utilizó el programa estadístico del INFOSTAT [15].
Resultados y discusión
Parámetros biométricos
Se registró un total de 137 individuos de Octopus sp.; 56 machos para un porcentaje del 41%, 63 hembras para un total de 46% de la muestra y 18 indefinidos que representaron el 13%. Al comparar estadísticamente todos los meses analizados, no existieron diferencias significativas en la proporción de machos y hembras (p≥0,05). [16] indican que la proporción de sexos depende de la región geográfica, del tipo de muestreo que se realice y según [17] también es dependiente de la disponibilidad de refugios. Sin embargo, al evaluar los meses de manera unitaria, en noviembre (p<0,05) se reportaron mayor cantidad de machos, lo anterior puede estar relacionado al cuidado parental característico en los octópodos [18] realizado posiblemente en el mes anterior. Durante este periodo de cuidado la hembra protege la puesta de huevos hasta la eclosión, sin alimentarse [19] lo habitual es que utilicen sus propias reservas energéticas para mantenerse vivas y con ello, asegurar un desarrollo embrionario exitoso, poco antes del desove dejan de alimentarse y permanecen exclusivamente en el cuido, casi al mismo tiempo, o poco después que estos eclosionan, ocurre la muerte de la hembra [20].
Los meses de septiembre (21 ♂ y 25 ♀) y marzo (10 ♂ y 15 ♀) correspondieron a los de mayor captura lo cual coincide con lo reportado [21] en su estudio de Octopus vulgaris en Venezuela, mientras que mayo (4 ♂ y 3 ♀), y agosto (4 ♂ y 4♀) los de menor captura. Noviembre (9 ♂ y 5 ♀) y febrero (8 ♂ y 11♀) presentaron valores intermedios. Solo existieron diferencias estadísticamente significativas (p<0,05) en el ancho de los individuos, siendo mayor en hembras, esto podría estar relacionado con alimentación y condiciones reproductivas [22] [23] (cuadro 1).
Cuadro 1. Resumen estadístico de los parámetros biométricos de acuerdo al sexo.
|
Parámetro biométrico |
Sexo |
p value |
|
|
Macho |
Hembra |
||
|
Longitud dorsal de manto (cm) |
9,17 ±2,56 |
9,71 ±3,07 |
0,21 |
|
Longitud total (cm) |
47,2 ± 10,96 |
48,1 ± 9,51 |
0,66 |
|
Ancho (cm) |
6,60±1,60 |
6,83±1,38 |
0,02 |
|
Peso (g) |
453,78 ±224,1 |
420 ±197,08 |
0,09 |
De acuerdo a la época climática, estadísticamente (p <0,05) se obtuvieron mayores valores en verano tanto para el ancho (7,18 ± 1,64 cm ♂ y 7,22±1,37 cm ♀) como para el peso (0,49 ± 0,28 kg ♂ y 0,53±0,26 kg ♀) de los individuos muestreados (figura 2).
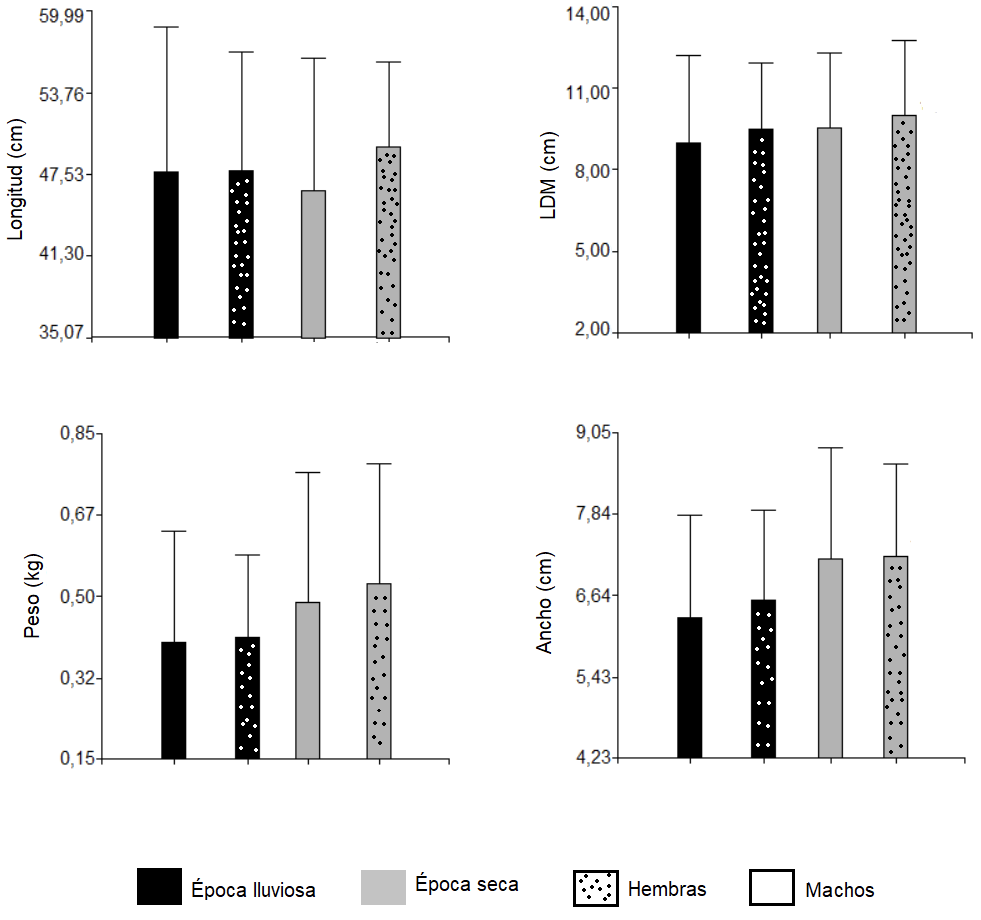
Figura 2. Parámetros biométricos de acuerdo a la época climática en Octopus sp.
La diferencia en ancho y peso, puede estar relacionado a que es en la época lluviosa cuando se dan los mayores picos reproductivos, hay mayor presencia de juveniles y por lo tanto menores tallas con respecto al verano [24] y además las hembras podrían estar alimentándose menos [20] por el cuidado parental que posiblemente se da en esta misma época. Según [24] el periodo reproductivo en O. vulgaris es irregular, pero puede ser mayor a partir de abril y setiembre/octubre. [16] señala que los pulpos desovan a finales de verano y se da la eclosión en época de invierno cuando se dan variaciones de temperaturas, salinidad y existe mayor plancton disponible. Apoyando los resultados anteriores, noviembre correspondió estadísticamente (p <0,05) al mes donde se reportaron los menores pesos, LDM y ancho de los organismos (mayor presencia de organismos jóvenes); mientras que febrero se identificaron los organismos de mayores pesos, LDM y ancho (p <0,05) (figura 3).

Figura 3. Parámetros biométricos de Octopus sp. de acuerdo al mes muestreado.
Relación talla-peso
El valor de b, para machos (b=1,934) y hembras (b=2,176) indicó un crecimiento alométrico negativo (b<3) (Figura 4), lo cual indica que incrementa su talla de una forma más acelerada que su peso. Este tipo de crecimiento ha sido observado en otras especies de octópodos, como O.hubbsorum [25] [26], O. briareus, O. joubini y O. digueti [27]; y es el más comúnmente descrito en cefalópodos, debido a que presentan un crecimiento diferencial entre brazos y manto [28]. El coeficiente b puede variar dentro de poblaciones de la misma especie y de acuerdo a ciclos reproductivos [29]. El estudio de las relaciones longitud-peso brinda información de forma indirecta sobre crecimiento, madurez, desarrollo gonadal y nutrición, siendo útil además para estimar el cambio esperado para grupos de organismos marinos, logrando evaluar la biomasa y stock poblacional [30] [31].
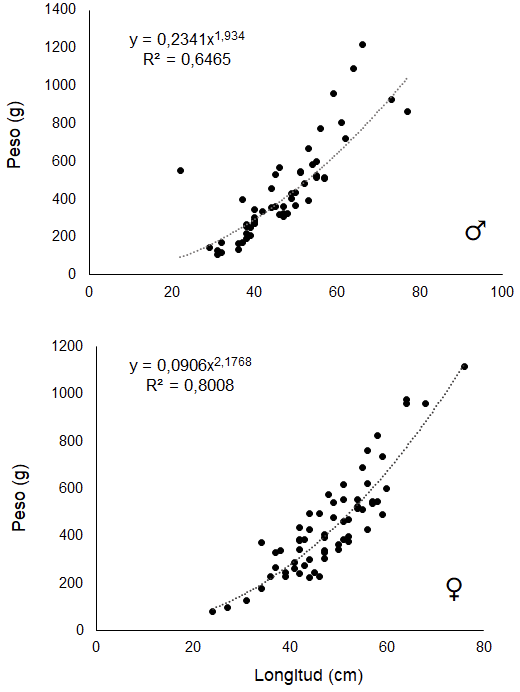
Figura 4. Relación talla – peso para Octopus sp, en Cuajiniquil, Guanacaste.
Descripción del Esfuerzo Pesquero y caracterización de la flota artesanal y pesquería
En la costa de Cuajiniquil la pesca de pulpo es artesanal de subsistencia, no existe una flota formalmente estructurada como en otras pesquerías, sino que la misma se dedica a diferentes pescas objetivo [32].
El método de pesca utilizado (gancho o bichero) (figura 5), ha sido criticado y prohibido en diferentes partes del mundo debido a su baja selectividad, sin embargo, aún es utilizado ya que en la actualidad no existe una reglamentación para la pesquería en el litoral Pacífico de Costa Rica [33] [20] [34] y sería improbable hacer extensivas las medidas de regulación establecidas en el Golfo de Nicoya, debido a la diferencia en las condiciones oceanográficas, geomorfológicas, ambientales y operativas con la zona de estudio.

Figura 5. “Bichero”, arte de pesca utilizado para la captura artesanal de pulpo.
Según datos del [35] se registran 17 licencias de pesca que permite la extracción de pulpo, sin embargo, existen aproximadamente 40 pescadores artesanales de pulpo en Cuajiniquil lo cual quiere decir que solo el 35% de estos realiza la actividad de una forma legal. Así por ejemplo, los pescadores de langosta y escama en Cuajiniquil incurren en la captura de pulpo de manera ilegal cuando las capturas de sus especies objetivo son bajas o reducidas y como lo han mencionado [36], ello puede tener un efecto negativo directo sobre las hembras desovantes y posteriormente sobre la progenie y el reclutamiento.
Según [17] los pulpos que se encuentran a profundidades menores a 50 metros tienden a hacer leves movimientos horizontales solamente para alimentarse lo que los hace más vulnerable, por ello este mismo autor recomienda las áreas protegidas para esta especie.
El mayor esfuerzo de pesca se presentó en setiembre posiblemente relacionado al método de muestreo, a las condiciones favorables para el pulpo de temperatura, salinidad y alimento [17] o a ciclos reproductivos y mayores cuidados parentales [20] lo que podría facilitar su captura; mientras que los meses de mayo y agosto correspondió al menor esfuerzo pesquero (Figura 6), y según información recolectada entre los mismos pescadores los meses de diciembre y enero es donde la pesca se centra en otros recursos de peces debido a la disminución de pulpo. Lo anterior coincide con [16] al señalar que en diciembre y enero hay una disminución de organismos (posiblemente por aumento de pesca no artesanal en otros puntos marinos) y a partir de febrero gradualmente aumentan las poblaciones.
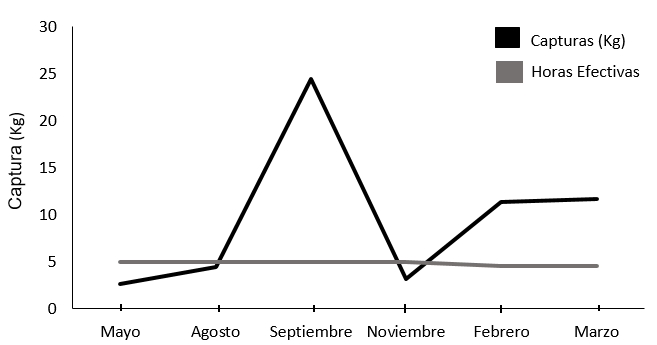
Figura 6. Esfuerzo de Pesca por mes de la flota artesanal de pulpo en Cuajiniquil según muestreos realizados.
Las observaciones de campo sugieren que existe un porcentaje de organismos que se extraen que posiblemente no hayan alcanzado tallas de comercialización adecuadas, de acuerdo a [37] la talla mínima de madurez sexual para O. vulgaris en el Golfo de México es de 248 g en machos y en hembras de 612 g, y para este estudio aproximadamente el 40% en los machos tienen pesos menores a 300 g y para hembras cerca del 80% tenían pesos menores a 540 g (46% menos de 300 g) ; según [21] en el caso de O. vulgaris alcanzan la zona de pesca alrededor de los 9 cm de longitud, sin embargo en la presente investigación 50% para ambos sexos tenían LDM menores a 9 cm (Figura 7), estos factores pueden estar asociados al tipo de flota, donde operan y el arte de pesca empleado si es o no selectivo, sin embargo existe un fuerte componente humano, y esto se traduce en la falta de normativas y de las buenas prácticas de pesca responsable, de las cuales Costa Rica se encuentra inscrito en el Código de Conducta de Pesca Responsable desde el año 1999 y las directrices voluntarias para lograr la sostenibilidad de la pesca en pequeña escala desde el año 2014, el buceo con “bichero” como método de pesca para la captura de pulpo es ilegal en muchas partes del mundo, ya que afecta directamente a organismos en periodo de reproducción o cuidado de sus huevos [38].
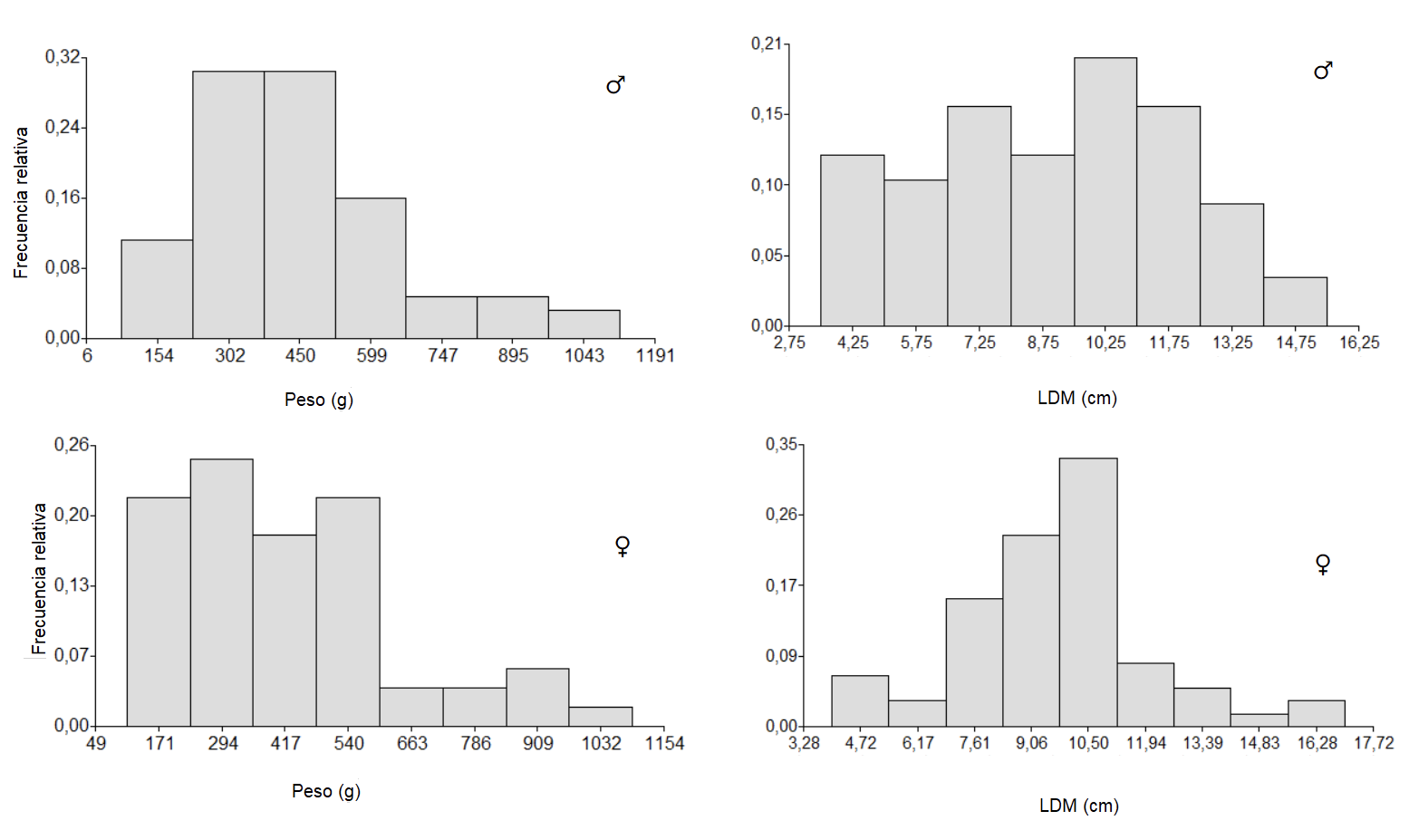
Figura 7. Frecuencia de pesos (g) y LDM (g) en los individuos capturados de acuerdo al sexo en la presente investigación.
La relevancia de considerar los aspectos de mercado en la pesca y el manejo de sus recursos ha sido planteada por [39], sin embargo, en el caso del pulpo esto no es una norma común. No obstante, no se debe descartar el efecto que el mercado tiene en la demanda de organismos sub-legales o con tallas por debajo de lo establecido en la literatura, dado que hay compradores dispuestos a consumir y comercializar organismos pequeños, igualmente al existir un mercado alternativo diferente al usual, los pescadores tienen mayores incentivos para pescar con la posibilidad de ganar un poco más con estos compradores (pacotilleros) que generalmente compran pulpo pequeño y que no son supervisados o penalizados por su actividad.
En la costa de Cuajiniquil, la pesca de pulpo es una alternativa para diversificar la producción de los pescadores artesanales, ocupando un lugar importante junto a otros recursos convencionales, por lo que es necesario regular su aprovechamiento para lograr una producción sostenida. Se sugiere adoptar algunas medidas de conservación y manejo del recurso, preferiblemente de manera voluntaria entre los pescadores, tales como limitar el esfuerzo pesquero (número de pescadores, permisos), establecer tallas mínimas de captura, cuotas de captura por pescador, proponer una época de veda, con la finalidad de proteger dentro de límites razonables tanto a las hembras maduras, como las que se encuentran incubando.
Conclusiones
La pesquería artesanal de pulpo en Cuajiniquil de Guanacaste, es una de las actividades principales para la activación de la economía local, sin embargo, ésta se realiza sin un manejo apropiado y la única medida de control consiste en el otorgamiento de la licencia de pesca, y se desconocen aspectos claves para una pesquería sostenible como son: el stock pesquero, tallas de captura, zonificación y el establecimiento de áreas marinas protegidas. Sumado a lo anterior, el arte de pesca utilizado para la captura de pulpo impide una selección de organismos, lo cual fue corroborado en la presente investigación en donde entre el 40 y 50% de los individuos muestreados no cumplían con el peso (g) o con la LDM (cm) recomendada en la literatura por otros autores para su extracción.
De acuerdo a los meses muestreados en el presente trabajo, noviembre es un mes con alta presencia de organismos juveniles por lo tanto septiembre y octubre podrían ser meses donde exista alta actividad de cuidado parental de huevos. A pesar, de que en el presente trabajo no se muestreó todo el año, con los datos obtenidos se podría recomendar no extraer organismos de Octopus sp. durante meses de la época lluviosa como setiembre, octubre y noviembre. Se hace necesario, realizar más muestreos ya que la literatura indica que para el pulpo común podría existir más de un pico reproductivo al año.
Referencias
[1] Organización Mundial para la Alimentación y la Agricultura, La ordenación pesquera: Las áreas marinas protegidas y la pesca, FAO, Roma, Italia, 2012.
[2] M. Mereu, B. Agus, P. Addis, S. Cabiddu, A. Cau, M. Follesa, and D. Cuccu, “Movement estimation of Octopus vulgaris Cuvier, 1797 from mark recapture experiment”, Journal of Experimental Marine Biology and Ecology, vol. 470, pp. 64–69, 2015. https://doi.org/10.1016/j.jembe.2015.05.007
[3] M. Acosta-Jolré, R. Sahade, R. Jurgen, and M. Chiappero, “A contribution to the understanding of phylogenetic relationships among species of the genus Octopus (Octopodidae: Cephalopoda)”, Scientia Marina, vol. 76, pp. 311-318, 2012. https://doi.org/10.3989/scimar.03365.03B
[4] B. Seibel, “Cephalopod susceptibility to asphyxiation via ocean incalescence, deoxygenation and acidification”, Physiology, vol. 31, pp. 418-429, 2016. https://doi.org/10.1152/physiol.00061.2015
[5] E. Grist, and G. Jackson, “Energy balance as a determinant two-phase growth in cephalopods”, Marine and Freshwater Research, vol. 55, pp. 395-402, 2004. https://doi.org/10.1071/MF03154
[6] D. De Luca, G. Catanese, G. Procaccini, and G. Fiorito, “Octopus vulgaris (Cuvier, 1797) in the Mediterranean Sea: Genetic Diversity and Population Structure”, PloS one, vol. 11, pp. 0149496, 2016. https://doi.org/10.1371/journal.pone.
[7]G. Polese, C. Bertapelle, and A. Di Cosmo, “Role of olfaction in Octopus vulgaris reproduction”, General and Comparative Endocrinology, vol. 210, pp. 55–62, 2015. https://doi:10.1016/j.ygcen.2014.10.006
[8] T. Repolho et al. “Developmental and physiological challenges of octopus (Octopus vulgaris) early life stages under ocean warming”, Journal of Comparative Physiology , vol. 184, pp. 55–64,2013. https://doi.org/10.1007/s00360-013-0783-y
[9] Mar Viva, Instituto Costarricense de Pesca y Acuicultura, y Ministerio de Comercio e Industria de Costa Rica, Guía de identificación de filetes de pescado y mariscos, San José, Costa Rica, 2012.
[10] L. Rocha, “Estructura de tallas, talla de primera madurez y fecundidad de Octopus hubbsorum (Mollusca: Cephalopoda) de la costa de Oaxaca, México”, tesis de Licenciatura, Universidad de Mar, Oaxaca, México, 2013.
[11] W. Ricker, “Computation and interpretation of biological statistics of fish population”, B. Fish. Res. Board. Can., vol. 191, pp.1-382, 1975.
[12] H. Andrade, “Age determination in the snapper Lutjanus guttatus (Pisces, Lutjanidae) and investigation of fishery management strategies in the Pacific Coast of Guatemala”, M.S. Thesis, Universidad de Tromsø, Noruega, 2003.
[13] P. Sparre, and C. Venema, Introducción a la evaluación de recursos pesqueros tropicales. FAO, Roma, Italia, 1995.
[14] J. Gulland, Manual de métodos para la evaluación de las poblaciones de peces. FAO, Zaragoza, España, 1971.
[15] J. Di-Rienzo, F. Casanoves, M. Balzarini, L. González, M. Tablada, and Y. Robledo, “Programa estadístico InfoStat”, FCA, Universidad Nacional de Córdoba, Argentina, 2018.
[16] S. Lourenço, A. Moreno, L. Narciso, A. González, and J. Pereira, “Seasonal trends of the reproductive cycle of Octopus vulgaris in two environmentally distinct coastal areas”, Fisheries Research, vol. 127-128, pp. 116–124, 2012. https://doi:10.1016/j.fishres.2012.04.006
[17] M. Mereu, B. Agus, P. Addis, S. Cabiddu, A. Cau, M. Follesa, and D. Cuccu, “Movement estimation of Octopus vulgaris Cuvier, 1797 from mark recapture experiment”, Journal of Experimental Marine Biology and Ecology, vol. 470, pp. 64–69, 2015. https://doi 10.1016/j.jembe.2015.05.007
[18] V. Boletzky, “Recent studies on spawning, embryonic development and 71 hatching in the cephalopoda”, Adv. Mar. Biol., vol. 25, pp. 85-115, 1989.
[19] K. Mangold, “Octopus vulgaris”, in: Cephalopod life cycles, Londres, Inglaterra: Academic Press, 1983, pp. 335-364.
[20] T. Cortez, “Biología y Ecología del pulpo común Octopus mimus Gould, 1852 (Mollusca: Cephalopoda) en aguas litorales del norte de Chile”, Ph.D. dissertation, Universidad de Vigo, España, 1995.
[21] L. González, F. Guevara, and L. Troccoli, “Biología y pesquería del pulpo Octopus vulgaris (Octopoda: Octopodidae) en las costas del estado Nueva Esparta, Venezuela”, Revista de Biología Tropical, vol. 63, pp. 427-442, 2015.
[22] B. García-García, y F. Aguado-Giménez, “Influence of diet on growing and nutrient utilization in the common octopus (Octopus vulgaris)”, Aquaculture, vol. 211, pp. 171-182, 2002.
[23] A. Rodríguez, I. Pozuelo, M. Prado, J. Gómez, A. Bruzon, “The gametogenic cycle of Octopus vulgaris (Mollusca: Cephalopoda) as observed on the Atlantic coast of Andalusia (south of Spain)”, Marine Biology, vol. 147, pp. 927-933, 2005.
[24] A. Quetglas, F. Alemany, A. Carbonell, P. Merella, and P. Sánchez, “Biology and fishery of Octopus vulgaris Cuvier, 1797, caught by trawlers in Mallorca (Balearic Sea, Western Mediterranean)” Fisheries Research, vol. 36, pp. 237–249, 1998.
[25] J. Domínguez-Contreras, “Reproducción del pulpo Octopus hubbsorum Berry, 1953 en Bahía Magdalena, B.C.S., México”, thesis M.S, Universidad de Baja California, 2011.
[26] L. Ibarra, “Análisis de edad y crecimiento de Octopus hubbsorum (Berry, 1953) y Octopus bimaculoides (Pickford y McConnaeghey, 1949) con lecturas de anillos en los estiletes”, thesis M.S, Universidad Nacional Autónoma de Baja California, México, 2011.
[27] J. Forsythe, and R. Hanlon, “Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides”, Marine Biology, vol. 98, pp 369–379, 1988. https://doi.org/10.1007/BF00391113
[28] P. Boyle, and P. Rodhouse, “Cephalopods: Ecology and Fisheries”, Blackwell: Oxford, 2005.
[29] M. Sá, G. Barbieri, and J. Verani, “Análise do comportamento de Cyprinus carpio, Prochilodus cearensis e Colossoma macropomum em experimento de policultivo, embasado nos factores de condição”, Bol. Inst. Pesca., vol. 26, pp.181-187, 2000.
[30] T. Treer, N. Sprem, H. Torcu-Koc, Y. Sun, and M. Piria, “Length-weight relationships of freshwater fishes of Croatia”, Journal of Application Ichthyology, vol. 24, pp. 626-628, 2008.
[31] J. Abboola, and M. Anetekhai, “Length-weight relationships of some fresh and brackish water fishes in Badagry Creek, Nigeria”, Journal of application Ichthyology, vol. 24, pp. 623-625, 2008.
[32] J. Díaz-Uribe, D. Audelo-Ramos, y G. González-Medina, “Informe técnico final del proyecto: Caracterización de la pesca ribereña de la costa oaxaqueña: Río Copalita - Pinotepa Nacional”, Universidad del Mar: Pto. Angel, Oaxaca, México, 1999.
[33] J. Gonçalves, “Octopus vulgaris Cuvier, 1797 (pulpo común): Sinopse da biología e exploração”, Ph.D. dissertation, , Universidad dos Açores, Horta, Portugal, 1991.
[34] E. López-Uriarte, “Ciclo vital y pesca del pulpo Octopus hubbsorum Berry 1953 (Cephalopoda: Octopodidae) en la costa de Jalisco, México”, Ph.D. dissertation, Universidad de Guadalajara, Jalisco, México, 2006.
[35] Instituto Costarricense de Pesca y Acuicultura, “Sistema Integrado de Servicios Pesqueros y Acuícolas”, consulta al SISPA, Puntarenas, Costa Rica, 2019.
[36] S. Salas, M. Cabrera, L. Palomo, and E. Torres, “Uso de indicadores para evaluar medidas de regulación en la pesquería de pulpo en Yucatán, dada la interacción de flotas”, Proceedings of the Gulf and Caribbean Fisheries Institute, vol. 61, pp. 111-121, 2008.
[37] M. Jiménez-Badillo, R. Río-Rodríguez, M. Gómez- Solano, A. Cu-Escamilla, y D. Méndez-Aguilar, “Madurez gonádica del pulpo Octopus vulgaris en el Golfo de México: análisis macroscópico y microscópico”, Universidad Autónoma de Campeche: México, 2008.
[38] A. Sánchez, “Estudio Biológico – Pesquero de Octopus sp. En el complejo Lagunar Bahía Magdalena – Almejas, B.C.S. México”, Tesis para obtener título en Biología Marina, Universidad Autónoma de Baja California Sur, México, 2013.
[39] C. Pedroza, and S. Salas, “Responses of the fishing sector to transitional constraints: From reactive to proactive change, Yucatan fisheries in Mexico”, Marine Policy, vol. 35, pp. 39-49, 2010.
1 Maestría en Gestión de Recursos Naturales y Tecnologías de Producción. Instituto Costarricense de Pesca y Acuicultura (INCOPESCA), Departamento de Extensión y Capacitación, Puntarenas, Costa Rica.
Correo electrónico: amora@incopesca.go.cr https://orcid.org/0000-0002-4811-7975
https://orcid.org/0000-0002-4811-7975
2 Académica Escuela Ciencias Biológicas de la Universidad Nacional de Costa Rica/ Parque Marino del Pacífico, Puntarenas, Costa Rica.
Correo electrónico: milagro.carvajal.oses@una.cr https://orcid.org/0000-0002-8294-9863
https://orcid.org/0000-0002-8294-9863
3 Doctor en Ciencias Naturales para el Desarrollo, docente e investigador de la Escuela de Agronegocios. Coordinador del Área Académica Agroforestal Instituto Tecnológico de Costa Rica. Costa Rica.
Correo electrónico: rocampos@tec.ac.cr https://orcid.org/0000-0003-4460-2313
https://orcid.org/0000-0003-4460-2313