Principales microorganismos entomopatógenos de Tecia solanivora y sus mecanismos de acción
Main entomopathogenic microorganisms of Tecia solanivora and their mechanisms of action
Emmanuel Jose Guerra-Luran1, Jovanna Acero-Godoy2
Fecha de recepción: 31 de enero de 2020
Fecha de aprobación: 28 de abril de 2020
Guerra-Luran, E. J; Acero-Godoy, J. Principales microorganismos entomopatógenos de tecia solanivora y sus mecanismos de acción. Tecnología en Marcha. Vol. 34-2. Abril-Junio 2021. Pág. 137-146. https://doi.org/10.18845/tm.v34i2.4981
Palabras clave
Actividad entomopatógena; Tecia solanivora; control biológico.
Resumen
La papa (Solanum tuberosum) es uno de los cultivo de mayor importancia en Colombia y a nivel mundial, se destaca por ser una de las fuentes vegetales de proteínas y carbohidratos. S. tuberosum se ve afectado por una gran cantidad de plagas, entre ellas se encuentra Tecia solanivora, este importante fitopatógeno fue identificado en Guatemala - (Centroamérica). El presente artículo está centrado en exponer el control biológico utilizado para contrarrestar el ataque de T. solanivora, que abarca el uso de microorganismos y la producción de exo-productos microbianos. Actualmente los principales microorganismos antagónicos de T. solanivora son: Bacillus thuringiensis (Bt), granulovirus, y los nematodos Steinernema sp y Heterorhabditis sp. Para lograr la infección, estos microorganismos deben sobrevivir las condiciones adversas del ambiente, colonizar su entorno y finalmente evadir la respuesta inmune del huésped, lo anterior lo logran produciendo diferentes exo-productos con actividades antimicrobianas, líticas y tóxicas, entre otros. Esta importante característica le permite a un agricultor mantener las poblaciones del insecto a niveles inferiores.
Keywords
Entomopathogenic activity; Tecia solanivora; biological control.
Abstract
Potato (Solanum tuberosum) is one of the most important crop in Colombia and worldwide, stands out as one of the vegetable sources of proteins and carbohydrates. S. tuberosum is affected by a large number of pests; among them is Tecia solanivora, this important phytopathogen was identified in Guatemala - (Central America). This article is focused on exposing the biological control used to counter the attack of T. solanivora that covers the use of microorganisms and the production of exo-microbial products. Actually the main antagonistic microorganisms of T. solanivora are: Bacillus thuringiensis (Bt), granulovirus, and nematodes Steinernema sp and Heterorhabditis sp. To achieve the infection, these microorganisms must survive the adverse conditions of the environment, colonize the environment and and finally evade the host immune response, this is achieved by producing different exo-products with antimicrobial activities, lithic and toxic substances, among others. This important feature allows a farmer to maintain populations of the insect at lower levels.
Introducción
En el ámbito de la agricultura, la búsqueda de productos libres de pesticidas químicos ha llevado a la innovación de productos agrícolas que puedan controlar naturalmente determinada malezas, enfermedad, o plagas. Hoy en día se han evidenciado diferentes alternativas, una de las más eficientes se encuentra el control biológico, el cual se constituye como una forma eficiente de controlar determinada plaga mediante el uso de otro organismo o microorganismo. [1], [2], [3], [4].
Solanum tuberosum es una planta dicotiledónea, perteneciente a la familia Solanaceae [5]. A partir del crecimiento de sus raíces se originan nuevos tubérculos indispensables para la acumulación de nutrientes y sustancias [6]. Las condiciones óptimas para su desarrollo abarcan diferentes variables climáticas tales como la temperatura (entre 10°C hasta 15°C) y la altitud (entre 2000 y 3000 msnm). La papa es aprovechada por aproximadamente mil millones de consumidores en todo el mundo [7]. Durante la producción agropecuaria, S. tuberosum es atacado por agentes oportunistas que afectan el producto final y su comercialización, uno de estos oportunistas son los insectos, los cuales se centran en atacar diferentes partes de la planta [8]. Las familias de insectos Lepidoptera, Coleoptera e Hymenoptera son las principales oportunistas de la papa. [9], [10].
Tecia solanivora y su manejo integral
T. solanivora pertenece al orden Lepidóptera y familia Gelechiidae, este insecto es uno de los fitopatógenos de S. tuberosum. El ciclo de vida de T. solanivora consta de cuatro estados: huevo, larva este es subdivido en los instares larvales (L1, L2, L3 y L4), pupa y adultos. El ciclo inicia posterior a la eclosión de los huevos, emerge la larva L1, esta sale en busca de alimento al interior de los tubérculos y se alimenta de estos hasta llegar al instar L4. Posteriormente se convierte en pupa, para finalmente emerger como adulto (figura 1) [11], [12], [13].
Para el manejo de este insecto se observan múltiples opciones. Primordialmente, el uso de pesticidas, los cuales inhiben a T. solanivora actuando como una neurotoxina causando parálisis hasta inducir su muerte, entre los grupos más utilizados están: los organofosforados, piretroides y carbamatos [14], [15].
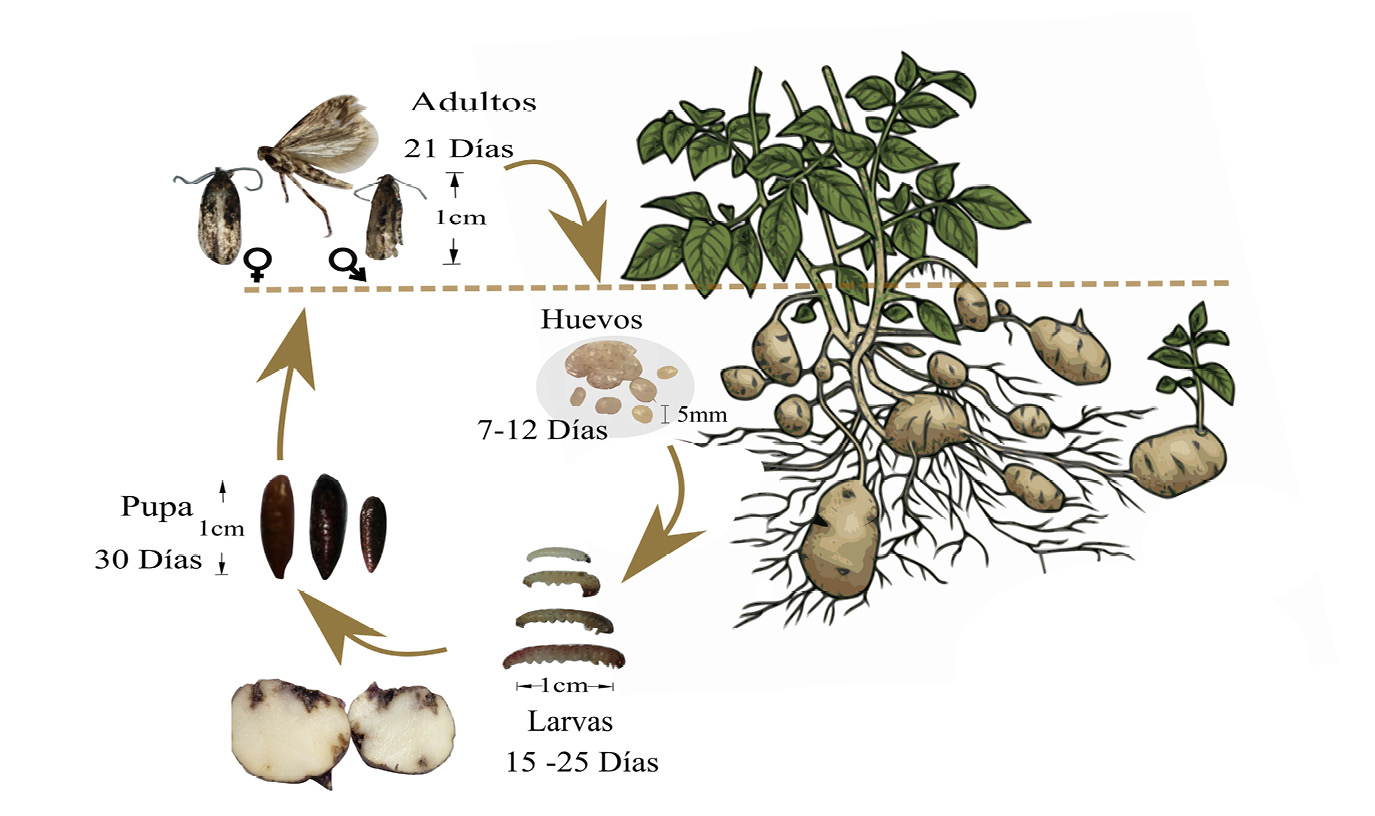
Figura 1. Ciclo de vida de T. solanivora.
Existen otras opciones innovadoras que han aportado significativamente al control de T. solanivora, entre ellas encontramos el control de tipo biológico que se basa en la implementación de bioplaguicidas constituidos de microorganismos con actividad antagónica contra el insecto. Actualmente, se conocen distintos grupos de microorganismos entomopatógenos de Tecia solanivora, estos poseen distintos mecanismos de acción para el insecto [16], [17].
Otra división del control de T. solanivora comprende la producción de plantas genéticamente modificadas, las cuales logran expresar en cierto tipo de proteína Cry de Bt [18]. Se han evaluado distintos métodos para esta modificación genética, uno de ellos es mediante la transferencia de ADN. Esto se logra mediante el uso de plásmidos, con la ayuda de la bacteria Agrobacterium tumefaciens, esta posee un plásmido denominado Ti y a través de este se logra la transferencia de genoma directamente a la planta [19]. Finalmente, se encuentra el control de tipo etológico, este comprende el uso de feromonas sexuales que actúan como trampas atrayentes para machos y hembras, evitando la copulación [20].
Actividad entomopatógena
La actividad entomopatógena en el ámbito de la agricultura, significa la regulación de determinada población de insectos plagas a través de determinado microorganismo, este posee exo-productos biológicamente activos, y se caracterizan por tener propiedades líticas y tóxicas, alguno de estos compuestos son: proteasas, lipasas, quitinasas, hemolisinas, entre otros. A continuación se activarán estos compuestos en condiciones in vivo, los cuales se verán implicados en la invasión del hemocele y la proliferación sistemática en todo el insecto hasta finalmente causar su muerte [12], [13]. Primordialmente, los microorganismos entomopatógenos son ingeridos por el insecto plaga, otro método de invasión es la penetración de la cutícula esto es realizado por determinados nematodos tales como: Steinernema sp y Heterorhabditis sp [22], [23], [24].
Bt y su mecanismo de acción
Una de las bacterias más estudiadas como biocontrolador de insectos es Bt, está clasificada como Gram positiva, aerobia facultativa, esporulante, esta ha sido aislada principalmente del suelo y del agua; la mayoría de las cepas de Bt producen cristales de proteínas, los cuales le otorgan su poder insecticida frente a insectos plaga, abarcando los órdenes Lepidóptera, Díptera, Coleóptera, Hemíptera, Himenóptera y Malófaga entre otros; las principales proteínas implicadas en esta acción, son: Cry I, Cry II, Cry III. Los genes que interactúan en la producción de estas proteínas, residen en plásmidos conjugativos. Hasta el 2014 se encontraron aproximadamente 700 toxinas Cry subclasificadas dentro de 72 grupos. Se han evidenciado cepas nativas de Bt como biocontroladoras de T. solanivora hallándose la cepa 146-15801 que mejor actúa [11], [13], [19], [20] [21].
El principal factor de virulencia es la producción de cristales, el cual al ser ingeridos por el insecto, se despliegan las sub-unidades de proteínas denominadas Cry y son activadas proteolíticamente en determinados ambientes de pH del intestino medio, se evidencia que las toxinas Cry I, se activa en el pH alcalino del intestino medio; mientras tanto la toxina Cry III tiene solubilidad en pH ácidos (3,9 hasta 4,2) y alcalinos (9,5 hasta 11,3) [27]. Los síntomas que un insecto susceptible presenta al ingerir los cristales de proteínas son: cese de ingesta, parálisis del intestino, aumento en las deposiciones, emesis, parálisis total y finalmente la muerte [25], [28], [29], [30].
El mecanismo de acción de Bt inicia cuando las larvas de T. solanivora ingieren las pro-toxínas provenientes de Bt, estas se solubilizan en el intestino medio por acción del pH y enzimas proteolíticas, liberando la toxina, a continuación, las toxinas se une a receptores específicos ubicados sobre las vesículas de la membrana de las microvellosidades apicales, al darse el reconocimiento inician la formación de poros (entre 1,0 ó 2,0 nm), causando permeabilidad de la membrana y lisis. Finalmente, las esporas de Bt ingresan a la hemolinfa, donde germinan y ocasiona septicemia y muerte en la larva (figura 2) [28], [31], [32], [33].
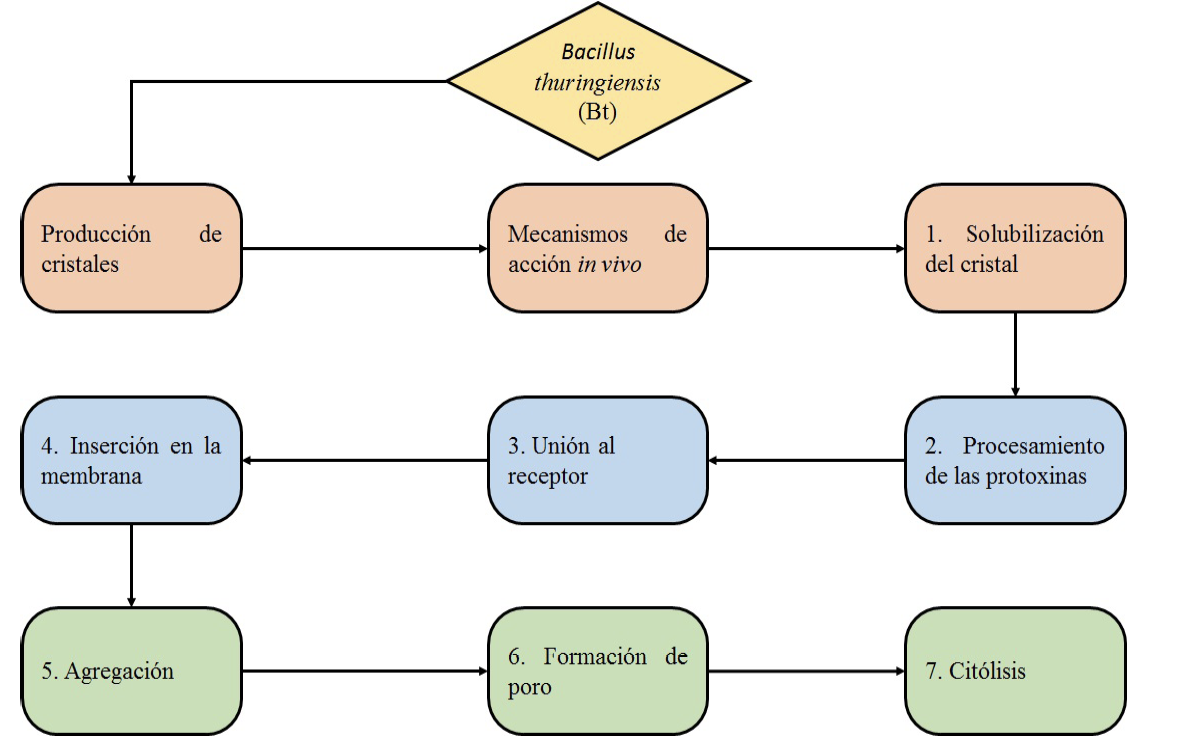
Figura 2. Mecanismos de acción de Bt implicados en la muerte de T. solanivora.
Bioprospección de Bt
López-Pasos y colaboradores en el 2013 [25] rescataron información sobre la aplicación de Bt con T. solanivora y se evidencia la actividad biológica en larvas de T. solanivora y cuyos resultados mostraron una mortalidad superior al 20 %. En la actualidad el principal uso de las proteínas de Bt, se ha fortalecido en la aplicación a plantas transgénicas, por otra parte también se han realizado recombinaciones de proteínas para la evitar la resistencia de esta plaga a las proteínas [20], [34], [35].
La implementación de Bt se logra gracias al uso de bioformulaciones, en un estudio realizado en el 2014 por Villanueva y colaboradores destaca las mezclas con Bt y granulovirus y se comprobó que al usar materiales excipientes como carbonato de calcio lograron ocasionar en condiciones de pos-cosecha mortalidad de larvas de T. solanivora hasta en un 82.7% [20].
Granulovirus (PhopGV)
Otra estrategia exitosa para el control de esta plaga es el uso de los virus, donde se destaca la familia Baculoviridae, caracterizada por poseer ADN de doble cadena y está compuesta por cuatro géneros, dentro de los que se destacan dos grupos: los nucleopoliedrovirus (NPV) y los granulovirus (GV), este último grupo tienen como blanco algunos insectos, sus formas infectivas son: viriones derivados de cuerpos de inclusión (CI) y viriones brotados (BV) [36], [37]. En el estudio filogenético se ha logrado establecer los genes involucrados en la afectación a un insecto plaga entre ellos encontramos el gen p143 que interviene en la replicación del ADN, el gen ie-2 que actúa como controlador del ciclo celular, el gen lef-7 que estimula en la replicación de ADN [36].
La infección inicia cuando las partículas virales que se encuentran en el ambiente están en forma de CI, y son ingeridas por el insecto, estas llegan al intestino y por acción del pH, se liberan los CI. Posteriormente, estos viriones atraviesan la membrana del intestino y se unen por fusión a las microvellosidades de las células epiteliales, en el núcleo de cada célula, comienza la transcripción de genes virales, las nucleocápsides formadas dentro de las células constituyen los nuevos BV, estos BV circularan a través de la hemolinfa diseminando la infección a los demás tejidos y órganos susceptibles como hemocitos, cuerpo graso entre otros produciendo una infección secundaria (figura 3) [37], [38], [39].
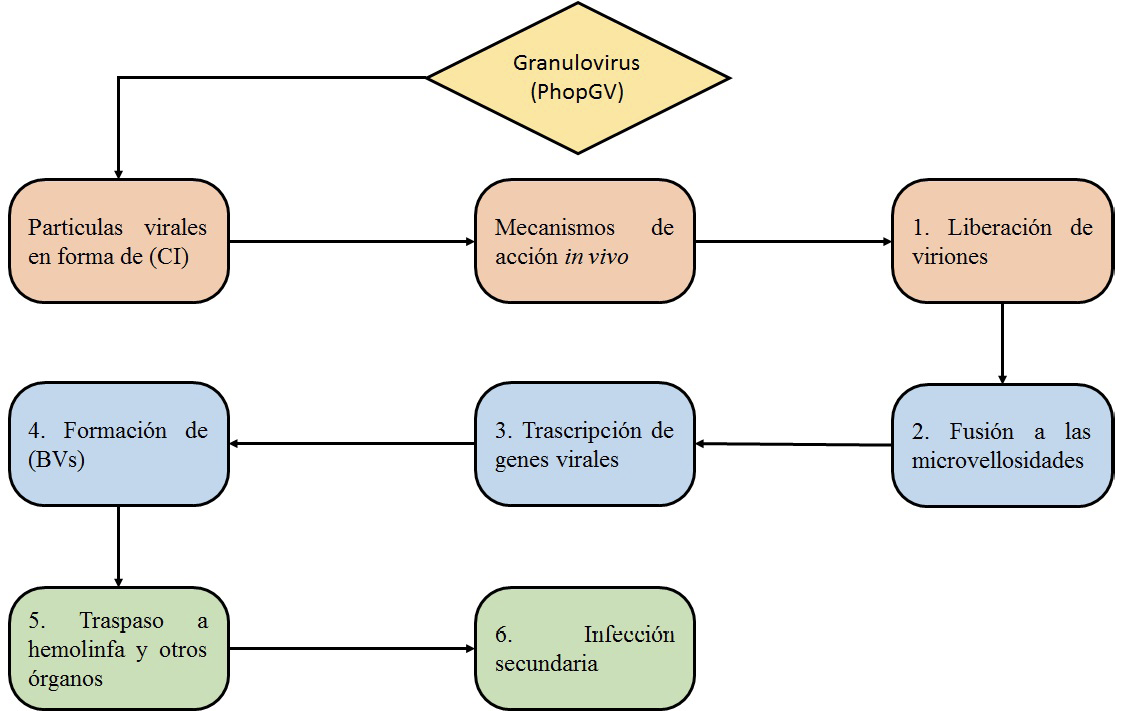
Figura 3. Mecanismos de acción de granulovirus implicados en la muerte de T. solanivora.
Bioprospección de Granulovirus
A partir de un estudio realizado por Espinel-Correal y colaboradores en el 2010, el Instituto Colombiano Agropecuario (ICA) estandarizó un producto de uso comercial, el cual presenta una eficacia en contra de T. solanivora del 90% y una duración de 24 meses a temperatura ambiente. Y hasta el 2017 se realizó un proceso de escalamiento al producto, pues se evidenció que adicionalmente presenta actividad antagónica a Tuta absoluta [23].
En un estudio realizado por Carpio C. y colaboradores en el 2013 desarrollaron un producto a partir de un granulovirus aislado, este producto fue preparado en un bioformulado compuesto por carbonato de calcio y algunos coadyuvantes tales como: cloruro de magnesio y lectina de soja encontrándose una mortalidad >98% siendo promisorio como opción al tratamiento [40].
Nematodos Mutualistas
Otro modelo importante de bacterias con actividad entomopatógena son Xenorhabdus y Photorhabdus, las cuales establecen relaciones mutualistas con nematodos de las familias Steinernema sp y Heterorhabditis sp respectivamente [41]. Ambos nematodos tienen ciclos de vida similares, y se divide en huevo, larva, estadios juveniles (J1, J2, J3, J4), y adultos, únicamente el tercer estadio juvenil (J3) de estos nemátodos son infectivos y buscan al hospedador, detectando sus excrementos y la producción de CO2 [42]. Steinernema spp sólo es capaz de entrar en el hospedador a través de las aberturas naturales: boca, ano y espiráculos, mientras que las especies de Heterorhabditis spp lo pueden hacer a través de la epidermis del insecto [43].
En cuanto al estudio del genoma de las bacterias mutualistas, en una investigación realizada por Peteira y colaboradores en 2014, las huellas genéticas de los aislados del nematodo y de la bacteria simbionte. En general, contienen relaciones filogenéticas para el control de insectos [44].
Para lograr la infección los nematodos logran el siguiente mecanismo de acción: Una vez Steinernema sp y Heterorhabditis sp localizan el insecto, penetran en él a través de la cutícula o aberturas naturales (boca, o ano). Posteriormente son liberadas las bacterias, las cuales producen y secretan toxinas, lipasas y proteasas. Estos causan una depresión del sistema inmune del insecto e inhiben el crecimiento del mismo, la proliferación de las bacterias en el hemocele y la disgregación de órganos y tejidos llevará finalmente a la muerte del insecto por septicemia finalmente, el nematodo se alimentara de los tejidos que la bacteria ha metabolizado (figura 4) [41], [45], [46].
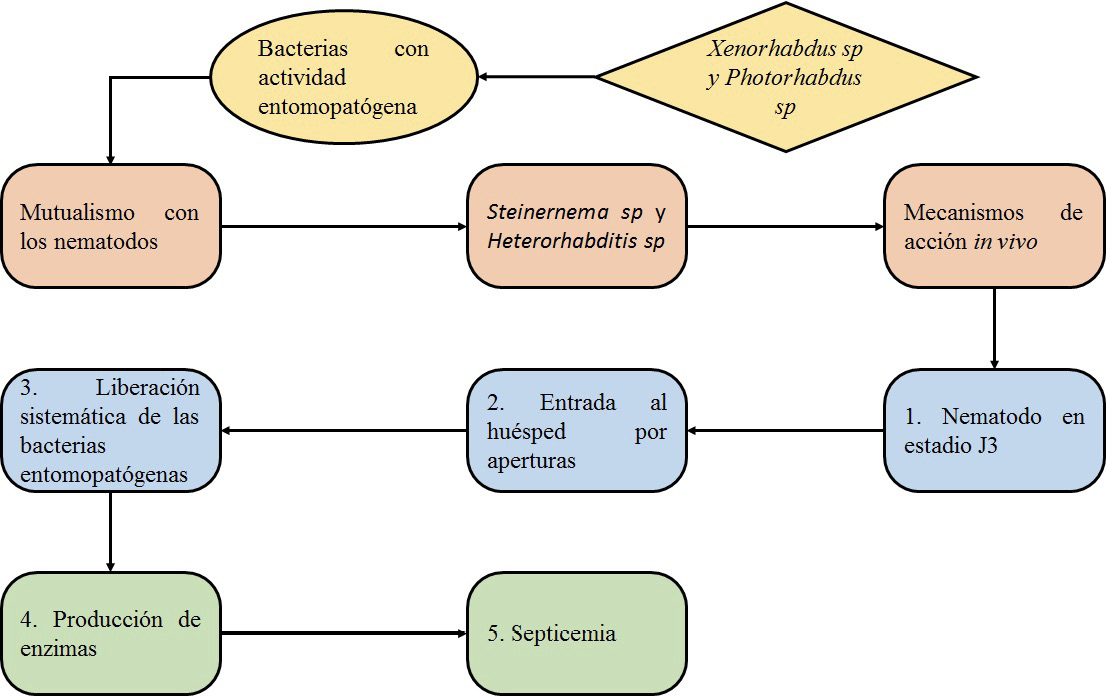
Figura 4. Mecanismos de acción de los nematodos mutualistas implicados en la muerte de T. solanivora.
Bioprospección de nematodos entomopatógenos
El uso de nematodos entomopatógenos en contra de T. solanivora en los últimos año se ha visto muy limitado, pues estos nematodos se han visto mayormente utilizados para atacar otro tipo de insectos plagas, uno de las principales estudios realizado por Fan XueJuan y colaboradores en el año 2000, estos implementaron a Steinernema spp y Heterorhabditis spp, y evidenciaron que estos son capaces de producir una mortalidad en T. solanivora hasta en un 70% a las 72 horas [47], [48], [49].
En el 2010 Argotti y colaboradores evaluaron estos nematodos en larvas de Galleria mellonella y larvas del cuarto instar de T. solanivora evidenciando una mortalidad superior al 90% y del 72% respectivamente [50].
Limitaciones al uso de microorganismos entomopatógenos
A pesar de su especificidad existen múltiples factores que pueden afectar el rendimiento para la aplicación de microorganismos entomopatógenos, principalmente los factores ambientales suelen reducir la eficacia tal como es el caso de Bt [20], [23], [28], [51], que se ve afectado por la radiación solar, otra limitación presente es el tiempo que tarda el microorganismo en causar la muerte, como tal es el caso de granulovirus, generalmente este virus suele causar la muerte del insecto entre los 12 y 21 días tiempo para que T. solanivora ocasione daño al tubérculo [23]; a su vez granulovirus se ve afectado por la luz ultravioleta que causa la inactivación afectando la replicación del ADN, para el caso de Xenorhabdus y Photorabdus, es indispensable la existencia de los nematodos que los transporta hasta el insecto, ocasionando que las aplicaciones de estos microorganismos en los cultivos sean más complejas [52], [53].
Referencias
[1] K. L. Giles, B. P. McCornack, T. A. Royer, y N. C. Elliott, “Incorporating biological control into IPM decision making”, Curr. Opin. Insect Sci., vol. 20, pp. 84–89, 2017, doi: 10.1016/j.cois.2017.03.009.
[2] L. A. Lacey, D. Grzywacz, D. I. Shapiro-Ilan, R. Frutos, M. Brownbridge, y M. S. Goettel, “Insect pathogens as biological control agents: Back to the future”, J. Invertebr. Pathol., vol. 132, pp. 1–41, 2015, doi: 10.1016/j.jip.2015.07.009.
[3] A. Kergunteuil, M. Bakhtiari, L. Formenti, Z. Xiao, E. Defossez, y S. Rasmann, “Biological control beneath the feet: A review of crop protection against insect root herbivores”, Insects, vol. 7, núm. 4, 2016, doi: 10.3390/insects7040070.
[4] P. A. Marchand, “Synthetic agrochemicals: a necessary clarification about their use exposure and impact in crop protection”, Environ. Sci. Pollut. Res., vol. 26, núm. 18, pp. 17996–18000, 2019, doi: 10.1007/s11356-019-05368-8.
[5] M. Cerón-Lasso, A. F. Alzate-Arbeláez, B. A. Rojano, y C. E. Ñuztez-Lopez, “Composición Fisicoquímica y Propiedades Antioxidantes de Genotipos Nativos de Papa Criolla (Solanum tuberosum Grupo Phureja) Physicochemical Composition and Antioxidant Properties of Native Diploid Potato (Solanum tuberosum Phureja Group)”, Inf. Tecnológica, vol. 29, núm. 23, pp. 205–216, 2018, doi: 10.4067/S0718-07642018000300205.
[6] T. Milton, El cultivo de papa en honduras. Honduras, 2016.
[7] E. S. Torres, J. Torres, C. Moreno, y R. Arango, “Desarrollo de líneas transgénicas de una variedad androestéril de papa, potencialmente resistentes a Tecia solanivora Povolny”, Agron. Colomb., vol. 30, núm. 2, pp. 163–171, 2012.
[8] ICA, “Manual Fitosanitario de la Papa.”, ICA, Línea Agrícola, p. 51, 2011, doi: 10.1017/CBO9781107415324.004.
[9] FAO, “El mundo de la papa”, Insumos y Factores Asoc. a la Prod. Agropecu., vol. 15, pp. 1–7, 2008.
[10] W. Pérez y G. Forbes, “Guía de identificación y control de las principales plagas que afectan a la papa en la zona andina”, Lima, Perú, 2011.
[11] D. Carrillo y E. Torrado-Leon, “Tecia solanivora povolny (lepidoptera: Gelechiidae), an invasive pest of potatoes solanum tuberosum L. in the northern andes”, en Potential Invasive Pests of Agricultural Crops, CABI Publishing, 2013, pp. 126–136.
[12] E. Trujillo García y S. Perera González, “Plagas y enfermedades de la papa . Identificación y control .”, Mosquera, Colombia, 2009.
[13] C. Camargo, D. Rincón, y E. Valencia, “Localización de hospedero por larvas neonatas de Tecia solanivora ( Lepidoptera: Gelechiidae )”, Corpoica Cienc. y Tecnol. Agropecu., vol. 11, núm. 1, pp. 5–10, 2010.
[14] University of Florida, Potential invasive pests of agricultural crops. Wallingford: CABI, 2013.
[15] DANE, “Boletín mensual insumos y factores asociados a la producción agropecuaria”, Bogotá, Colombia, 2019.
[16] D. Fischbein, “Introduccion a la teoria del control biologico de plagas”, en Manejo integrado de plagas forestales, INTA EEA B., vol. 15, J. Villacide y J. Corley, Eds. San Carlos de Bariloche. Río Negro. Argentina.: Instituto Nacional de Tecnología Agropecuaria, 2012, pp. 4–6.
[17] R. Ximhai, E. Nava-Pérez, C. García-Gutiérrez, ; Jesús, R. Camacho-Báez, y E. Lorena Vázquez-Montoya, “Bioplaguicidas: una opción para el control biológico de plagas”, Rev. Soc. Cult. y Desarro. Sustentable, vol. 8, pp. 17–29, 2012.
[18] M. Fernanda Ordóñez Ch, J. V Fernando Rosero, y T. Bacca, “Resistencia de cinco variedades de (Solanum spp., Solanaceae) al ataque de tecia solanivora (Lepidoptera: Gelechiidae)”, Univ. Caldas, vol. 16, pp. 108–119, 2012.
[19] D. D. Portela-Dussán, A. Chaparro-Giraldo, y S. A. López-Pazos, “La biotecnología de Bacillus thuringiensis en la agricultura”, Nova, vol. 11, núm. 20, p. 87, 2013, doi: 10.22490/24629448.1031.
[20] D. Villanueva, J. Torres, H. Rivera, V. Núñez, R. Arango, y F. Ángel, “Líneas Colombianas de papa genéticamente modificadas resistentes a Tecia solanivora (Lepidoptera: Gelechiidae) bajo campo confinado”, Rev. Colomb. Entomol., vol. 40, núm. 2, pp. 148–157, 2014.
[21] A. Rodríguez et al., “Proyecto Demostrativo Con Implementación De Bpa En El Cultivo Del Banano Las Buenas Prácticas Agrícolas (Bpa) En El Cultivo Del Banano”, Corporación Banan. Nac., vol. 2, pp. 2–3, 2010.
[22] R. P. Kamaliya, D. M. Jethva, N. M. Kachhadiya, V. R. Ahir, y G. S. Vala, “Bio-efficacy of Heterorhabditis indica against Groundnut White Grub”, Int. J. Curr. Microbiol. Appl. Sci., vol. 8, núm. 04, pp. 830–836, 2019, doi: 10.20546/ijcmas.2019.804.093.
[23] A. M. Cotes, Control Biologico de Fitopatogenos, Insectos y Acaros, AGROSAVIA. Mosquera, Colombia: AGROSAVIA, 2018.
[24] B. Ruffner et al., “Oral insecticidal activity of plant-associated pseudomonads”, Environ. Microbiol., vol. 15, núm. 3, pp. 751–763, mar. 2013, doi: 10.1111/j.1462-2920.2012.02884.x.
[25] S. López, A. Rojas, y A. Chaparro, “Actividad biológica de Bacillus thuringiensis sobre la polilla guatemalteca de la papa , Tecia solanivora Povolny ( Lepidoptera: Gelechiidae )”, Rev. Mutis, vol. 3, núm. 2, pp. 31–42, 2013.
[26] B. Senthil Kumar et al., “Characterization of Bacillus thuringiensis Cry1 class proteins in relation to their insecticidal action”, Interdiscip. Sci. Comput. Life Sci., vol. 5, núm. 2, pp. 127–135, jun. 2013, doi: 10.1007/s12539-013-0160-2.
[27] A. Bravo y J. Ceron, Bacillus thuringiensis En el control Biológico, Buena Semi. Bogotá, Colombia: Universidad Nacional de Colombia, 2013.
[28] A. H. Badran et al., “Continuous evolution of Bacillus thuringiensis toxins overcomes insect resistance”, Nature, vol. 533, núm. 7601, pp. 58–63, may 2016, doi: 10.1038/nature17938.
[29] J. A. Baum et al., “Binary toxins from Bacillus thuringiensis active against the western corn rootworm, Diabrotica virgifera virgifera LeConte”, Appl. Environ. Microbiol., vol. 70, núm. 8, pp. 4889–4898, ago. 2004, doi: 10.1128/AEM.70.8.4889-4898.2004.
[30] D. H. Sauka y G. B. Benintende, “Bacillus thuringiensis: Generalidades. Un acercamiento a su empleo en el biocontrol de insectos lepidópteros que son plagas agrícolas”, Rev. Argent. Microbiol., vol. 40, núm. 2, pp. 124–140, 2008.
[31] A. L. D. A. Melo, V. T. Soccol, y C. R. Soccol, “Bacillus thuringiensis: Mechanism of action, resistance, and new applications: A review”, Critical Reviews in Biotechnology, vol. 36, núm. 2. Taylor and Francis Ltd, pp. 317–326, mar. 03, 2016, doi: 10.3109/07388551.2014.960793.
[32] A. Bravo, S. Likitvivatanavong, S. S. Gill, y M. Soberón, “Bacillus thuringiensis: A story of a successful bioinsecticide”, 2011, doi: 10.1016/j.ibmb.2011.02.006.
[33] L. M. Fiuza, R. A. Polanczyk, y N. Crickmore, Bacillus thuringiensis and Lysinibacillus sphaericus: Characterization and use in the field of biocontrol. Springer International Publishing, 2017.
[34] C. J. Nova-López, J. M. Muñoz-Pérez, L. F. Granger-Serrano, M. E. Arias-Zabala, y R. E. Arango-Isaza, “Expresión de la proteína recombinante Cry 1Ac en cultivos de células de papa en suspensión: Establecimiento del cultivo y optimización de la producción de la biomasa y la proteína mediante la adición de nitrógeno”, DYNA, vol. 84, núm. 201, pp. 34–41, 2017, doi: 10.15446/dyna.v84n201.59829.
[35] B. Schaub y J. Kroschel, “Developing a biocontrol strategy to protect stored potato tubers from infestation with potato tuber moth species in the Andean region”, J. Appl. Entomol., vol. 142, núm. 1–2, pp. 78–88, feb. 2018, doi: 10.1111/jen.12426.
[36] S. Haase, A. Sciocco-Cap, y V. Romanowski, “Baculovirus Insecticides in Latin America: Historical Overview, Current Status and Future Perspectives”, Viruses, vol. 7, pp. 2230–2267, 2015, doi: 10.3390/v7052230.
[37] J. Gómez Valderrama y L. Villamizar, “Baculovirus: Hospederos y especificidad”, Rev. Colomb. Biotecnol., vol. 15, núm. 2, p. 143, dic. 2013, doi: 10.15446/rev.colomb.biote.v15n2.41273.
[38] L. Villamizar et al., “Desarrollo de un bioplaguicida a base de granulovirus para el control de la polilla guatemalteca de la papa (Tecia solanivora) en campo”, Foreign Affairs, vol. 91, núm. 5. Foreign Affairs, Mosquera, Colombia, p. 287, 2012, doi: 10.1017/CBO9781107415324.004.
[39] C. E. Correal, A. Marina, y C. Prado, “Efecto de la infección con granulovirus en el desarrollo de Tecia solanivora (Lepidoptera: Gelechiidae)”, Rev. Fac. Nac. Agron., vol. 62, núm. 1, pp. 4797–4805, 2009.
[40] C. Carpio et al., “Development of a viral biopesticide for the control of the Guatemala potato tuber moth Tecia solanivora”, J. Invertebr. Pathol., vol. 112, núm. 2, pp. 184–191, feb. 2013, doi: 10.1016/j.jip.2012.11.014.
[41] R. K. Raja et al., “Response of three cyprinid fish species to the Scavenger Deterrent Factor produced by the mutualistic bacteria associated with entomopathogenic nematodes”, J. Invertebr. Pathol., vol. 143, pp. 40–49, feb. 2017, doi: 10.1016/j.jip.2016.11.013.
[42] A. Sáenz y J. C. López, “Ciclo de vida y patogenicidad del aislamiento nativo Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabditidae)”, Rev. Colomb. Entomol., vol. 37, núm. 1, pp. 43–47, 2011.
[43] K. Bohorquez Benitez y A. del pilar Duarte Barrero, “Prospección de patógenos con potencial para el control biológico de la polilla guatemalteca de la papa (Tecia solanivora, Fam. Gelechiidae)”, Universidad Santo Tomás, Bogotá, 2016.
[44] B. I. Peteira et al., “Variabilidad molecular de aislamientos venezolanos de nematodos entomopatógenos y sus bacterias simbiontes 1 Molecular varibility of Venezuelan isolates of entomopathogenic nematodes and their symbiont bacteria”, 2014.
[45] S. R. Cagnolo, “Nematodos entomopatógenos (familias Steinernematidae y Heterorhabditidae) en Argentina. Recopilación de hallazgos de poblaciones naturales en medio siglo de prospecciones”, Rev. Fac. CIENCIAS EXACTAS, FÍSICAS Y Nat., vol. 6, núm. 1, pp. 1–8, 2019.
[46] Ž. Laznik y S. Trdan, “Attraction Behaviors of Entomopathogenic Nematodes (Steinernematidae and Heterorhabditidae) to Synthetic Volatiles Emitted by Insect Damaged Potato Tubers”, J. Chem. Ecol., vol. 42, núm. 4, pp. 314–322, abr. 2016, doi: 10.1007/s10886-016-0686-y.
[47] F. Xuejuan, A. Maggiorani, y S. Gudiño, “Uso de nemátodos entomopatógenos como una alternativa en el control de polilla (Tecia solanivora), importante plaga de la papa (Solanum tuberosum). mérida-venezuela”, Rev. For. Venez, vol. 44, núm. 1, pp. 115–118, 2000.
[48] E. San-Blas, C. Rosales, y T. Ángel, “Entomopathogenic nematodes in tropical agriculture: Current uses and their future in Venezuela”, en Nematode Pathogenesis of Insects and Other Pests: Ecology and Applied Technologies for Sustainable Plant and Crop Protection, Springer International Publishing, 2015, pp. 375–402.
[49] C. V. Edmunds, C. S. Wilding, y R. Rae, “Susceptibility of Chironomus plumosus larvae (Diptera: Chironomidae) to entomopathogenic nematodes (Rhabditida: Steinernematidae and Heterorhabditidae): Potential for control”, Eur. J. Entomol., vol. 114, pp. 526–532, 2017, doi: 10.14411/eje.2017.067.
[50] E. Argotti, P. Gallegos, J. Alcázar, y H. Kaya, “Patogenicidad de nematodos entomopatógenos del genero Steinernema y Heterorhabditis sobre larvas de Tecia solanivora en Ecuador”, Boletín Técnico, pp. 162–172, 2010.
[51] C. Ballardo, M. del C. Vargas-García, A. Sánchez, R. Barrena, y A. Artola, “Adding value to home compost: Biopesticide properties through Bacillus thuringiensis inoculation”, Waste Manag., vol. 106, pp. 32–43, abr. 2020, doi: 10.1016/j.wasman.2020.03.003.
[52] S. Edgington et al., “Diversity and distribution of entomopathogenic nematodes in Chile”, Nematology, vol. 12, núm. 6, pp. 915–928, oct. 2010, doi: 10.1163/138855410X498897.
[53] P. Kupferschmied, M. Maurhofer, y C. Keel, “Promise for plant pest control: Root-associated pseudomonads with insecticidal activities”, Front. Plant Sci., vol. 4, pp. 1–17, jul. 2013, doi: 10.3389/fpls.2013.00287.
1 Bacteriólogo y Laboratorista Clinico. Instituto de Diagnostico Medico (IDIME). Bogotá, Colombia. Correo electrónico: ejguluran@gmail.com  https://orcid.org/0000-0002-1647-6527
https://orcid.org/0000-0002-1647-6527
2 Docente en la Universidad Colegio Mayor de Cundinamarca. Bogotá, Colombia. Correo electrónico: jacerog@unicolmayor.edu.co https://orcid.org/0000-0003-1656-6888
https://orcid.org/0000-0003-1656-6888