Sintesis de Zeolitas utilizando como materia prima lodos de los procesos de anodizado de aluminio
Zeolites synthesis using as a raw material the aluminium anodizing sludges
Fausto Peñafiel-Villarreal1, Ramón Martínez-Mañez2
Fecha de recepción: 3 de agosto de 2018
Fecha de aceptación: 17 de noviembre de 2018
Peñafiel-Villarreal, F; Martínez-Mañez, R. Sintesis de Zeolitas utilizando como materia prima lodos de los procesos de anodizado de aluminio. Tecnología en Marcha. Vol. 32-3. Julio-Setiembre 2019. Pág. 12-23.
DOI: https://doi.org/10.18845/tm.v32i3.4476
Palabras clave
Lodo de anodizado; NaP1; GIS; Zeolita; Microscopía de escaneado electrónico de barrido (MEB); difracción de rayos X (DRX); absorción atómica; difractograma.
Resumen
Se encontró, por absorción atómica y escaneado electrónico de barrido concentraciones entre 25,3% y 39,45 % de aluminio, además de sodio, magnesio, calcio y silicio en los lodos de anodizado de aluminio de una industria que opera en Ecuador. Por lo tanto el objetivo del presente trabajo fue investigar a nivel de laboratorio, la posibilidad de utilizar estos residuos como fuente de precursores en la síntesis de zeolitas.
Utilizando una solución de hidróxido de sodio en concentraciones 0,5M, 1,0 M, 1,5 M, 2,0 M, 2,5 M y 3,0 M en mezcla con Na2SiO3 hidratado, se ajustó la composición química de 20 g de muestra de lodo a una constante de relación molar SiO2/Al2O3 de 1,24 para todas las pruebas y variando las relaciones molares de Na2O/Al2O3; Na2O/SiO2 y H2O/ Na2O, conforme a la variación de la concentración de la solución de hidróxido de sodio. Se mantuvo constante la temperatura de fusión de precursores, envejecimiento y cristalización de la zeolita a 100°C y tiempo de reacción de 48 horas.
Mediante la técnica de difracción de rayos X, se identificó la síntesis de la zeolita Na-P1 GIS 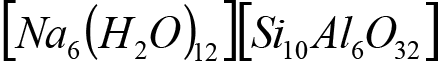 , con tres tipos de mineralogía, además las zeolitas ACP-1 y Sodalita Octahidrato. Las imágenes electrónicas muestran un producto con una morfología bien definida. Las mejores condiciones del resultado fueron la concentración 1,5 M de la solución de sosa y relaciones molares 1,24 de SiO2/Al2O3; 0,61 de Na2O/Al2O3; 2,02 de SiO2/Na2O; 15,51, de H2O/ Na2O y 7,68 de H2O/ SiO2.
, con tres tipos de mineralogía, además las zeolitas ACP-1 y Sodalita Octahidrato. Las imágenes electrónicas muestran un producto con una morfología bien definida. Las mejores condiciones del resultado fueron la concentración 1,5 M de la solución de sosa y relaciones molares 1,24 de SiO2/Al2O3; 0,61 de Na2O/Al2O3; 2,02 de SiO2/Na2O; 15,51, de H2O/ Na2O y 7,68 de H2O/ SiO2.
A mayores concentraciones de sosa se obtienen las mismas zeolitas, como lo demuestran los difractogramas de rayos X, pero las imágenes electrónicas de los productos muestran cristales deformados, posiblemente por el exceso de sosa.
Keywords
Anodizing sludge; NaP1; GIS, Zeolite; Scanning electronic microscopy (SEM); X-ray diffraction (XRD); Atomic absorption; diffractogram.
Abstract
There were found, by atomic absorption and scanning electronic microscopy techniques, concentrations in between of 25,3% and 39,45% of aluminium respectively, in the anodized aluminium sludge on an industry that operates in Ecuador. Besides there were identified minor concentrations of Na, Mg, Ca and Si. Therefore the objective of the present research was to investigate, at the laboratory level, the feasibility of using these industrial residues as a source of precursors for the zeolites synthesis.
The chemical composition of a fixed 20 g of sludge was adjusted by using a sodium hydroxide solutions in a varying concentrations of 0,5 M, 1,0 M, 1,5 M, 2,0 M, 2,5 M and 3,0 M in a mixture with hydrated Na2SiO3 in a constant amount added to the raw material. Molar ratio SiO2/Al2O was kept constant at 1,24 value, whereas the Na2O/Al2O3; Na2O/SiO2 and H2O/Na2O were varied as sodium hydroxide solutions changed in concentration.
The processes of precursor’s dilution, aging and zeolite crystallization were carried out a constant temperature of 100°C for a 48 hours reaction time.
By the X-ray diffraction technique, the synthesis of the Na-P1 GIS zeolite was identified, with three types of mineralogy. Besides the zeolites ACP-1 and Sodalite Octahydrate were identified. The electronic images show a product with a well-defined morphology. The optimum conditions for the synthesis were the 1.5 M concentration of the caustic soda solution, and molar ratios of 1,24 SiO2/Al2O3; 0,61 Na2O/Al2O3; 2,02 SiO2/Na2O; 15,51 H2O/ Na2O and 7,68 H2O/ SiO2.
was identified, with three types of mineralogy. Besides the zeolites ACP-1 and Sodalite Octahydrate were identified. The electronic images show a product with a well-defined morphology. The optimum conditions for the synthesis were the 1.5 M concentration of the caustic soda solution, and molar ratios of 1,24 SiO2/Al2O3; 0,61 Na2O/Al2O3; 2,02 SiO2/Na2O; 15,51 H2O/ Na2O and 7,68 H2O/ SiO2.
At higher concentrations of the sodium hydroxide solution, the same zeolites were obtained, as evidenced by X-ray diffractograms, but the electronic images of the products show deformed crystals, possibly due to the excess of sodium hydroxide.
Introducción
El objetivo general del presente trabajo fue investigar la factibilidad de sintetizar, a nivel de laboratorio, zeolitas utilizando como materia prima lodos provenientes del tratamiento de los efluentes industriales de los procesos químicos y electroquímicos de anodizado del aluminio de una industria de Ecuador.
La síntesis se realizó por activación alcalina de los óxidos de aluminio contenidos en el lodo de anodizado con silicato de sodio hidratado más hidróxido de sodio. La caracterización física y la microestructura de los lodos de anodizado se realizó por absorción atómica, por difracción de rayos X y por escaneado electrónico de barrido. La mineralogía y morfología de las zeolitas sintetizadas se realizó por difracción de rayos X y por escaneado electrónico de barrido, respectivamente.
La gestión ambiental de lodos de anodizado consiste en su disposición en vertederos. Otra práctica de disposición es el landfarming o disposición en el suelo [1]. Al respecto Kiely [2] hace conocer que en aguas cuyo pH fluctúa entre 4,0 y 4,5 el aluminio se encuentra como un monómero lábil biodisponible y en esta forma es tóxico para las especies acuáticas. Esta forma lábil del aluminio puede ser muy inestable termodinámicamente.
La investigación sobre la síntesis de zeolitas a partir de los residuos industriales resultantes de los procesos de oxidación anódica del aluminio, como una alternativa de manejo sustentable, es aún escasa, pues en su mayoría se enfocan en la utilización en pequeñas proporciones para la obtención de cementos refractarios o ladrillos en mezcla con arcillas [3], [4], [5], o la obtención de aluminato de sodio o sulfato de aluminio [6], [7].
Se ha reportado la síntesis de zeolita A con base en los efluentes del baño agotado del decapado alcalino [6], [8]. La presente investigación utilizó como materia prima, no los efluentes de los procesos intermedios, sino el lodo final que sale del filtro prensa de la planta de tratamiento de la industria.
Las zeolitas son aluminosilicatos cristalinos microporosos, en los que los átomos centrales de Silicio o Aluminio están enlazados por un oxígeno, formando una estructura tetraédrica de puentes de oxígeno no lineales. La unidad de construcción primaria de las zeolitas son los tetraedros [SiO4]4- y [AlO4]5- [9].
Como resultado del presente trabajo, se comprobó la hipótesis alternativa (H1), demostrando que es posible valorizar los lodos provenientes de los procesos de anodizado de aluminio, a través de la síntesis de la zeolita Na-P1 GIS. Esta zeolita tiene amplia aplicación en el área ambiental para la retención de elementos contaminantes en el tratamiento de aguas residuales y en el campo industrial [10].
Materiales y métodos
Muestreo y caracterización
Se tomaron muestras compuestas de lodos almacenados en cantidades de 7,92 m3 y 11,0 toneladas. Se determinó la humedad por gravimetría y el contenido de aluminio por el método de absorción atómica. Se analizó la microestructura y morfología de lodo seco y pulverizado, así como su composición elemental, utilizando la tecnología de escaneado electrónico de barrido.
La cristalinidad del lodo seco y pulverizado se determinó por difractometría de rayos X, con un ángulo 2θ variando desde 20° hasta 60° a intervalo constante.
Las mismas técnicas de difracción de rayos X y escaneado electrónico de barrido se emplearon para caracterizar las zeolitas sintetizadas. Los resultados del ángulo 2θ obtenidos por difracción de rayos X se contrastaron con los ángulos 2θ de las zeolitas sintéticas que constan en la tabla de patrones de identificación de zeolitas del Manual de patrones de zeolitas obtenidas por simulación y difracción de rayos X [11].
Método experimental de síntesis
Para determinar las condiciones químicas de síntesis se realizó el balance de masa de entradas al sistema de reacción. Los cálculos de realizaron con base en los resultados del análisis de microscopía en las muestras de lodos y el aporte químico del silicato de sodio más soluciones de hidróxido de sodio en concentraciones de 0,5 M, 1,0 M, 1,5 M, 2,0 M 2,5 M y 3,0 M. Así la variable independiente a ser estudiada es el efecto de la concentración de NaOH en la síntesis. El cuadro 1 presenta las relaciones molares resultantes del ajuste de la composición química del gel y dentro de las cuales se realizó la investigación.
Las relaciones molares en estudio se han definido como las variables específicas de la síntesis de zeolitas, en tanto que la temperatura, la naturaleza de los reaccionantes y su forma de mezclado se mencionan como las variables cinéticas [12].
Se mantuvo constante la temperatura de activación envejecimiento y cristalización y el tiempo, en 100°C y 48 horas, respectivamente.
Resultados y discusión
Lodos de anodizado
En las primeras muestras el contenido de humedad fue de 82,4% en tanto que en las segundas se redujo a un promedio de 42,75%, probablemente debido a una mejora en el equipo de filtración mecánica. El contenido de aluminio elemental en las primeras muestras, determinado por absorción atómica fue de 25,3%, en tanto que en las segundas muestras se obtuvo una media de 39,45% por escaneado electrónico (cuadro 2). Se observa la presencia de iones alcalino y alcalino térreos, que son necesarios para balancear la carga en la zeolita.
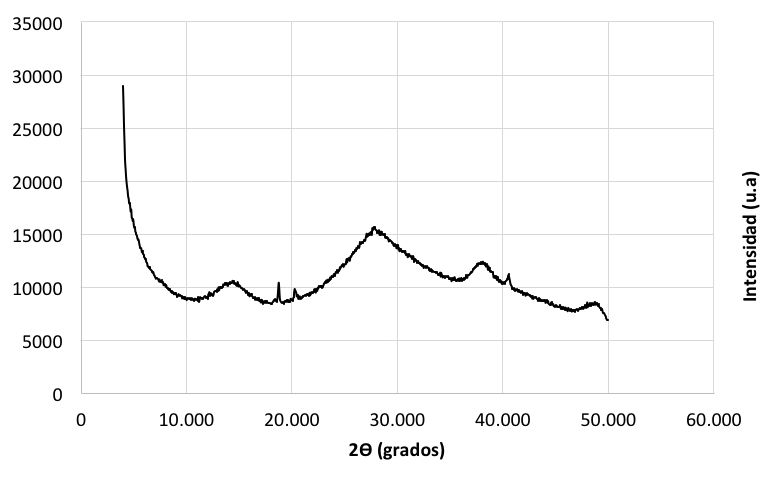
En la figura 1 no se observa la presencia de picos claramente definidos que puedan dar evidencia de alguna estructura cristalina. Los lodos sometidos a una segunda etapa de secado, igualmente no presentan ninguna fase cristalina (figura 2). En los dos casos el residuo anódico se encuentra en estado amorfo.
Las relación molar de SiO2/Al2O3 en la materia prima es 0,042 (cuadro 3), valor que no es adecuada para que se desarrolle el proceso de síntesis, por lo que se ajustó a un valor constante de 1,24. Dentro de este contexto se ha reportado un valor de 1,76 como adecuado para la síntesis de zeolitas de baja relación molar al utilizar lodos de plantas de tratamiento de agua [13], en tanto que lodos de los procesos de fabricación de papel con una relación molar SiO2/Al2O3 de 1,4 han sido favorables para la síntesis de zeolita A [14].
Cuadro 1. Relaciones molares a las que se realizó la investigación
|
Relación molar de los óxidos precursores y agua |
Concentración de la solución de NaOH |
|||||
|
0,5 M |
1,0 M |
1,5 M |
2,0 M |
2,5 M |
3,0 M |
|
|
Síntesis 1 |
Síntesis 2 |
Síntesis 3 |
Síntesis 4 |
Síntesis 5 |
Síntesis 6 |
|
|
SiO2/Al2O3 |
1,24 |
1,24 |
1,24 |
1,24 |
1,24 |
1,24 |
|
Na2O/Al2O3 |
0,48 |
0,55 |
0,61 |
0,68 |
0,75 |
0,81 |
|
Na2O/ SiO2 |
0,39 |
0,44 |
0,50 |
0,55 |
0,60 |
0,66 |
|
H2O/Na2O |
19,53 |
17,27 |
15,51 |
14,09 |
12,92 |
11,95 |
Cuadro 2. Composición elemental promedia de ocho escaneados en la muestra de lodo de anodizado secado a 100°C por 24 horas, determinada por MEB y relación molar Al/Si.
|
Elemento |
F |
Na |
Mg |
Al |
Si |
P |
S |
Ca |
O |
Relación Molar Si/Al |
|
% |
11,08 |
2,45 |
0,51 |
39,45 |
0,87 |
0,43 |
2,85 |
0,53 |
42,16 |
0,021 |
|
|
|
Cuadro 3. Óxidos presentes en la muestra de lodo de anodizado secado a 100°C por 24 horas, determinada por MEB y relaciones molares SiO2/Al2O3; Na2O/Al2O3 y SiO2/Na2O
|
Compuesto |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
CaO |
SiO2/Al2O3 |
Na2O/Al2O3 |
Na2O/SiO2 |
|
% |
3.31 |
0,85 |
74,54 |
1,86 |
0,99 |
7,11 |
0,74 |
0,042 |
0,073 |
1,74 |
Previo al tratamiento, los lodos de anodizado son amorfos, es decir, no presentan una microestructura definida, como se puede observar en la imagen electrónica de la figura 3, que corresponde al escaneado número 1 de los realizados en forma aleatoria y en diferentes sitios de la misma muestra.

Figura 3. Imagen de microscopía electrónica de barrido de lodo de anodizado seco a 100°C por 24 horas, no presenta ninguna microestructura definida.
Síntesis con solución de NaOH 0,5 M
En la figura 4 no se observan picos que puedan atribuirse a determinados minerales, es así que el lodo se encuentra aún en estado amorfo, lo cual indica que la concentración del activador químico y las relaciones molares en estudio aún no son las adecuadas.
La figura 5 evidencia que los lodos de anodizado activados con una solución alcalina 0,5 M, no presentan ninguna microestructura cristalina, permanecen amorfos. El nivel de alcalinidad de 19,53 de la prueba, definido por la relación molar H2O/Na2O aún es muy bajo como para solubilizar los iones de aluminio y de silicio en el agua para hacerlos disponibles para la síntesis.
Síntesis con solución de NaOH 1,0 M
La activación con la solución 1, 0 M aún no es efectiva en solubilizar el aluminio y el silicio en el agua para que se produzca la síntesis de la zeolita, pues el difractograma no evidencia aún picos que correspondan a un determinado compuesto químico (figura 6).
La imagen electrónica de la figura 7 exhibe un material amorfo, no presenta una microestructura definida, lo que significa que la concentración de la solución activante es aún insuficiente para activar la reacción de los precursores.
Síntesis con solución de NaOH 1,5 M a volumen constante
La activación de los elementos precursores con una solución de sosa 1,5 M condujo a la síntesis de la zeolita Na-P1 GIS ([Na6(H2O)12] [Si10Al6O32]), con tres tipos de mineralogía, además se obtuvo la zeolitas ACP-1 y sodalita octahidrato (cuadro 4).
|
|
|
|
Figura 4. Difractograma de lodos de anodizado de aluminio activados con solución de NaOH 0,5M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,48; 0,39 y 19, 53 respectivamente |
Figura 5. Imagen de microscopía electrónica de barrido de lodos amorfos de anodizado de aluminio activados con NaOH 0,5 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,48; 0,39 y 19, 53 respectivamente. |
|
|
|
|
Figura 6. Difractograma de lodos de anodizado de aluminio activados con solución de NaOH 1,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,55; 0,44 y 17, 27 respectivamente. |
Figura 7. Imagen electrónica MEB de lodos amorfos de anodizado de aluminio activados con NaOH 1,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,55; 0,44 y 17, 27 respectivamente |
Cuadro 4. Zeolitas sintetizadas con una solución activante de sosa 1,5 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,61; 0,50 y 15,51 respectivamente
|
2θ (figura 8) |
Tabla de patrones de identificación de zeolitas |
||
|
2θ |
Material |
Código |
|
|
12,626 |
12,60 |
ACP-1 |
ACO |
|
17,889 |
18,87 |
Garronita |
GIS |
|
21,837 |
21,67 |
Na-P1 |
GIS |
|
28,269 |
28,10 |
Na-P1 |
GIS |
|
33,581 |
31,99 |
Sodalita octahidrato |
SOD |
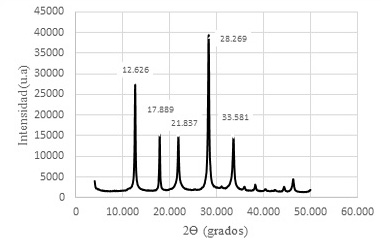
Figura 8. Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 1,5 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,61; 0,50 y 15,51 respectivamente.
Los ángulos 2θ, como ordenadas x en el difractograma de la figura 8 se han contrastado con los ángulos 2θ de la tabla patrón de identificación de zeolitas sintéticas y muestran una estrecha relación de valores, lo cual evidencia que en las condiciones de ensayo se han sintetizado las zeolitas con los códigos mencionados en el cuadro 4. La relación molar, que define el nivel de alcalinidad, H2O/Na2O con un valor de 15,51 prueba ser la adecuada para la síntesis.
La figura 9 evidencia una clara microestructura de zeolitas sintetizadas en las condiciones mencionadas de relaciones molares de los óxidos precursores. Para una mejor apreciación la imagen está ampliada a 7 µm.
De los datos procesados se obtiene un promedio de 10,07% de sodio en el gel de síntesis, esto representa un incremento del 311% con respecto al 2,45% presente en la materia prima.
Los valores promedios de las relaciones molares en el material zeolítico sintetizado, tomados de los resultados de escaneado electrónico, SiO2/Al2O3; Na2O/Al2O3; Na2O/SiO2 son respectivamente 4,84; 1,00 y 0,22.

Figura 9. Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 1,5 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,61; 0,50 y 15,51 respectivamente.
Síntesis con soluciones de NaOH en concentraciones 2,0 M; 2,5 M y 3,0 M y a volumen constante
Las soluciones molares de NaOH en concentraciones 2,0 M, 2,5 M y 3,0 M, favorecen la síntesis de las mismas zeolitas obtenidas a la concentración de 1,5 M. El sobrenadante es muy alcalino, siendo un efluente que debe ser neutralizado para poder gestionarlo ambientalmente. Las figuras 10, 11 y 12 constituyen los difractogramas que muestran los ángulos 2θ de los materiales zeolíticos sintetizados.

Figura 10. Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,0 M y con un módulo SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,68; 0,55 y 14,09 respectivamente.
Como puede observarse los valores de los ángulos 2θ son aproximadamente iguales a los ángulos de los productos sintetizados con la solución de activación 1,5 M; lo que demuestra que no se logra resultados diferentes a concentraciones mayores de solución activante. Más bien es importante puntualizar que el exceso de NaOH es complejo de eliminar vía lavados sucesivos, centrifugación y filtrada, hasta lograr condiciones de pH no reactivas.
Las figuras 13, 14, 15 y 16 son las imágenes electrónicas de las zeolitas sintetizadas, que reflejan una clara microestructura.
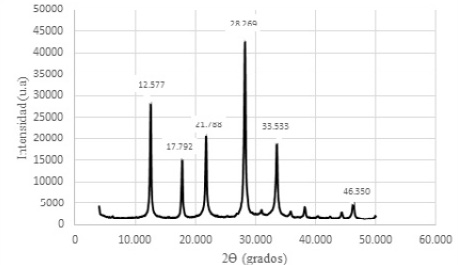
Figura 11. Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,5 M y con un módulo SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,75; 0,60 y 12,92 respectivamente.
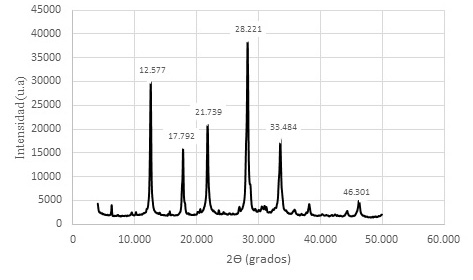
Figura 12. Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 3,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,81; 0,66 y 11.95 respectivamente
|
|
|
|
Figura 13. Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 1,5 M |
Figura 14. Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,0 M |
Se observa que a medida que la concentración de hidróxido de sodio aumenta, por sobre el valor de 1.5 M se crea un medio agresivo alcalino, que en lugar de mejorar la síntesis, provoca la deformación de los cristales (figuras 14, 15 y 16). El rango de pH en el sobrenadante al final del tiempo de reacción varió entre 11 y 12 para las soluciones molares de 3,0 M a 3,0 M y fue ligeramente menor para la solución 1,0 M.
|
|
|
|
Figura 15. Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,5 M |
Figura 16. Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 3,0 M |
La eliminación del exceso de sosa por centrifugación a 10 000 rpm por 15 minutos y filtración con papel filtro y mediante bomba de vacío, no es muy efectiva pues la disminución del pH luego de cada operación no es muy significativa. Se realizaron 4 operaciones de lavado. Los valores de pH en las soluciones sobrenadantes, estuvieron en el rango de 11, 43 y 12, 17. En estas condiciones se perderá parte del aluminio como Al(OH)4-, pues esta forma existe a valores de pH superiores a 9.
Conclusiones
Se sintetizó con solución 1,5 M de solución NaOH, la zeolita Na-P1 GIS  con tres tipos de mineralogía y además las zeolitas ACP-1 y sodalita octahidrato. A concentraciones mayores de la solución activante las zeolitas sintetizadas pierden su morfología.
con tres tipos de mineralogía y además las zeolitas ACP-1 y sodalita octahidrato. A concentraciones mayores de la solución activante las zeolitas sintetizadas pierden su morfología.
Recomendaciones
Se recomienda investigar la alternativa de neutralizar el producto sintetizado con ácidos orgánicos o inorgánicos de tal forma que el sobrenadante se obtenga en condiciones neutras y evitar de esta forma la pérdida de aluminio en su forma iónica de Al(OH)4-.
Referencias
[1] P. Rodolfi y D. Pelizzari, “Optimización de una planta de tratamiento de efluentes Líquidos de la industria de anodizado”, M.S. tesis, Instituto Tecnológico de Buenos Aires. Argentina, 2014. Disponible en:
https://ri.itba.edu.ar/bitstream/handle/123456789/270/500891_Rodolfi_M.pdf?sequence1
[2] G. Kiely, “Sistemas Ecológicos, Perturbaciones y Contaminación”, en Ingeniería Ambiental, Fundamentos, Entornos, Tecnologías y Sistemas de Gestión, 1st ed. Madrid: McGraw-Hill-Interamericana de España. 2014, pp. 309-349.
[3] M. Vargas y M. Montero, “Estudio del Uso del Lodo Residual de la Empresa Extralum S.A., Como Material Alternativo en la Fabricación de Cementos Especiales”, Tecnología en Marcha, vol. (19-3), p.p. 17-26, 2006. Disponible en: https://dialnet.unirioja.es/descarga/articulo/4835816.pdf
[4] M. Granda and G. Plaza, “Elaboración e implementación de un plan de manejo de residuos sólidos y vertidos líquidos Industriales generados por la Corporación Ecuatoriana de Aluminio S.A. CEDAL, M.S. tesis, Unidad de Postgrados, ESPE., Ecuador, 2012. Disponible en: https://repositorio.espe.edu.ec/bitstream/21000/6933/2/T-ESPE-047218.pdf
[5] I. Marquez et al. “Recycling of Residual Sludge from Aluminium Anodizing and Lacquering in Clay Bricks - Case Study of Portuguese Industries”. 4th International Conference on Engineering for Waste and Biomass Valorization, Porto, Portugal, 2012. Disponible en: https://www.researchgate.net/.../268803321_Recycling_of_Residual_Sludge_from_Al
[6] T. Saito et al. “Studies on production of zeolite and aluminum sulfate by reclamation of aluminum finishing sludges and waste solutions”. Journal of Japan Institute of Light Metals, vol. 35(11), pp. 624-629, 1985. Disponible en: https://www.jstage.jst.go.jp/article/jilm1951/35/11/35_11_624/_pdf
[7] P. Patel, “Studies of anodizing sludge and its uses” M.S. thesis, University of Waikato, New Zealand, 2008. Disponible en: http://researchgateway.ac.nz/pdf
[8] D. Supaporn et al. “Synthesis of Zeolite A from Aluminium Etching By-product”, in the 2nd Joint International Conference on Sustainable Energy and Environment, 2006. Disponible en: http://www.jgsee.kmutt.ac.th/see1/cd/file/E-045.pdf
[9] F. Morante, “Las zeolitas de la Costa del Ecuador: Geología, caracterización y aplicaciones”, PhD. Disssertation, Universidad Politécnica de Madrid, España, 2004.
[10] V. Sanhueza et al. “Síntesis de zeolita NaP-GIS con diferentes morfologías, a partir de dos diatomitas,” Revista Mexicana de Ingeniería Química, vol.10, pp. 117-123. 2011. Disponible en: http://www.scielo.org.mx/pdf/rmiq/v10n1/v10n1a12.pdf
[11] M. M. J. Treacy and J.B. Higgins, Eds., Collection of simulated XRD powder patterns for zeolites. Amsterdam, London, New York, Oxford, Paris, Shannon, Tokyo: ELSEVIER, 2001, pp. 1-586.
[12] I. Covian, “Síntesis de zeolita 13X para su uso en detergentes,” PhD. Disssertation, Universidad Complutense de Madrid, España, 1991. Disponible en: http://biblioteca.ucm.es/tesis/19911996/X/0/X0018201.pdf
[13] F. Espejel et al, “Use of drinking water sludge in the production process of zeolites”, Research on Chemical Intermediates, vol. 40, no. 8, pp. 2919-2928. FI: 1.54, 2015. Disponible en: http://www.researchgate.net/publication/280078523
[14] R. Padilla, “Aprovechamiento de lodos de la Industria papelera para la síntesis de zeolitas”, M.S. thesis, Universidad Nacional Autónoma de México, México, 2013. Disponible en: www.ptolomeo.unam.mx:8080/xmlui/bitstream/handle/132.248.52.../TESIS.pdf?
1 Instituto Interuniversitario de Investigación de Reconocimiento Molecular y Desarrollo Tecnológico-IDM. Universitat Politécnica de Valencia. España. Correos electrónicos: faupeavi@doctor.upv.es, fpenafiel100@yahoo.com. https://orcid.org/0000-0002-7571-3342
https://orcid.org/0000-0002-7571-3342
2 Instituto Interuniversitario de Investigación de Reconocimiento Molecular y Desarrollo Tecnológico-IDM. Coordinador del Programa de Doctorado en Química. Universitat Politécnica de Valencia. España Correo electrónico: rmaez@qim.upv.es. https://orcid.org/0000-0001-5873-9674
https://orcid.org/0000-0001-5873-9674