Comparación de tres metodologías de aislamiento, purificación y cultivo in vitro de linfocitos T murinos
Comparison of three methodologies of isolation, purification and in vitro culture of murine T lymphocytes
María I. Chaves-Rodríguez1, Johan E. Morales-Sánchez2,
Nazareth Mata-Rojas3, Laura A. Calvo-Castro4,
Erick Hernández-Carvajal5, Randall Loaiza-Montoya6
Fecha de recepción: 13 de junio de 2018
Fecha de aprobación: 6 de octubre de 2018
Chaves-Rodríguez, M; Morales-Sánchez, J; Mata-Rojas, N; Calvo-Castro, L; Hernández-Carvajal, E; Loaiza-Montoya, R. Comparación de tres metodologías de aislamiento, purificación y cultivo in vitro de linfocitos T murinos. Tecnología en Marcha. Vol. 32-2. Abril-Junio 2019. Pág 91-99.
DOI: https://doi.org/10.18845/tm.v32i2.4352
Palabras clave
CD3, amortiguador ACK; adherencia celular; Ficoll; microesferas magnéticas.
Resumen
El aislamiento y selección de linfocitos T puros de cultivo primario de bazo de ratón puede obtenerse de manera rápida y fácil utilizando kits comerciales con microesferas magnéticas para capturar y purificar las células. A pesar de estas ventajas, la carga financiera que puede representar para el presupuesto de un laboratorio, la adquisición constante de estos kits justifica la evaluación de otras opciones de menor costo. Por ello, se comparó el porcentaje de recuperación celular, viabilidad y pureza de tres métodos de aislamiento y purificación de linfocitos T; dos de bajo costo y fácil implementación (aislamiento con amortiguador de amonio-cloruro-potasio (ACK)-adhesión celular y aislamiento con Ficoll), y un kit comercial de selección negativa con microesferas magnéticas. Con el método de amortiguador ACK-adhesión celular se obtuvo un porcentaje de recuperación y purificación de linfocitos T viables comparable al obtenido con el kit. Aunque este método requiere más tiempo, dado que las células deben ser incubadas durante toda la noche, es de fácil implementación y tiene una eficiencia comparable al kit, así como un menor costo. Este método puede ser tomado en cuenta para utilizar en experimentos que puedan trabajar con linfocitos activados.
Keywords
CD3; ACK buffer; cellular adherence; Ficoll; magnetic microbeads.
Abstract
The isolation and selection of pure T lymphocytes from spleen primary culture can be obtained easily and quickly using commercial kits that use magnetics microbeads to capture and purify the cells. Despite these advantages, the financial burden that the constant acquisition of these kits can impose to a laboratory budget makes it important to evaluate other options. We compared the cell recovery, viability and purity percentage of three isolation and purification methods; two of them of low cost and easy implementation (cell adhesion of cultures treated with Ammonium-Chloride-Potassium (ACK) buffer, and Ficoll), and a commercial with kit of negative selection with magnetics microbeads. With the ACK-cell adhesion method, we found a recovery and purity percentage of lymphocytes T comparable to the one obtained with the kit. Although this method requires more time, as cells must be incubated overnight, it is easily implemented and has a comparable efficiency to the kit, as well as a lower cost. This method can be taken into account for experiments that can use activated cells.
Introducción
Los linfocitos T son células del sistema inmunitario adaptativo que generan una respuesta dirigida contra células que son consideradas como extrañas en el contexto del organismo por presentar antígenos de microorganismos patogénicos, células cancerígenas, partículas virales, etc[1]. Los linfocitos T se distinguen de otras poblaciones celulares del sistema inmune por medio de una serie de marcadores de membrana, como las proteínas de cluster de diferenciación: CD3, CD4 y CD8, que pueden ser utilizados para aislar esta fracción celular para su estudio particular [2]–[4]. Su estudio se ha desarrollado tanto en enfermedades propias del sistema inmune como patologías autoinmunitarias [5], deficiencias en la respuesta inmunitaria [6], [7] alergias[8], y enfermedades complejas como el cáncer (en el caso de linfomas y leucemias), desde el punto de vista patológico y terapéutico[9]–[12].
El estudio de linfocitos T a nivel in vitro se ha establecido a través de protocolos de aislamiento basados en las propiedades del cultivo (son células que crecen en suspensión y pueden ser seleccionadas por afinidad a anticuerpos específicos). Sin embargo, los diferentes métodos varían en el costo, el tiempo de implementación, la necesidad de realizar cultivo celular tras el aislamiento, así como en la reproducibilidad y confiabilidad [13]. De igual manera, el rendimiento en la recuperación y pureza puede variar entre los diferentes métodos.
Actualmente, existen kits comerciales de purificación de linfocitos mediante selección por anticuerpos acoplados a microesferas magnéticas. La afinidad de la unión célula-anticuerpo garantiza que la fuerza magnética permita recuperar la fracción celular con rendimientos y pureza muy altos [14]. Sin embargo, estos kits poseen un costo económico alto, lo cual constituye una limitante en laboratorios con presupuestos limitados. Algunos de los protocolos tradicionales de aislamiento de linfocitos han reportado buenos rendimientos [3]; sin embargo, no se ha realizado una comparación de este tipo de protocolos con respecto al rendimiento presentado con el empleo de kits de microesferas magnéticas, lo cual podría representar una disminución de costos económicos en un procedimiento fundamental del cual se derivan células para otras aplicaciones. Así, el objetivo de este trabajo fue comparar la eficiencia en recuperación y pureza de linfocitos T murinos de dos protocolos tradicionales, utilizando separación con solución amortiguadora ACK y separación con Ficoll, con un protocolo comercial más reciente de aislamiento por selección negativa empleando microesferas magnéticas.
Metodología
Todos los experimentos que involucraron el uso de animales fueron previamente aprobados por el Comité sobre el Cuido y Uso de Animales (CICUA-044-2015) de la Universidad de Costa Rica (UCR).
Se utilizaron ratones sanos adultos de aproximadamente 3 meses de edad y 25 g de peso, de la cepa C57BL/6J, provenientes del Laboratorio de Ensayos Biológicos (LEBi) de la UCR o bien, criados en el Centro Nacional de Innovaciones Biotecnológicas (CENIBiot). Todos los animales se mantuvieron en cautiverio durante el tiempo previo a los ensayos, en condiciones de alimentación y agua ad libitum con recambio de jaula una vez por semana, en condiciones de aislamiento ambiental con filtros de aire de alta eficiencia tipo HEPA (High Efficiency Particulate Air).
Extracción de órgano
Para la extracción del bazo, se utilizó una combinación de 100 mg/kg ketamina + 10 mg/kg xilacina inyectada por vía intraperitoneal como anestesia quirúrgica en los animales. Posteriormente, se realizó dislocación cervical como método de eutanasia previo a la extracción del bazo. Luego, se retiró el pelaje de los animales cercano a la zona de incisión en el costado izquierdo del animal, y se realizó una desinfección con 50% etanol y 30% yodo v/v, transfiriendo finalmente el animal a una zona estéril.
Bajo técnica aséptica, se realizó una incisión vertical de aproximadamente 1.5 cm en el cuadrante abdominal superior izquierdo, justo por debajo de las costillas. Cuidadosamente se extrajo el bazo, y se eliminó todo el tejido conectivo o grasa que tuviera adherido. El bazo se transfirió a un tubo estéril con medio de transporte Roswell Park Memorial Institute (RPMI)-1640 + 5% penicilina-estreptomicina, a 4°C.
Aislamiento de células
Se maceró el órgano a través de un tamiz de 100 µm (Corning®), y se realizaron dos lavados con solución salina de fosfatos (PBS) libre de Ca2+ y Mg2+ suplementado con 2% suero fetal bovino (SFB) y 2 mM de ácido etilendiaminotetraacético (EDTA). Posteriormente, se centrifugó por 10 minutos a 100 g. Se descartó el sobrenadante y el precipitado fue resuspendido en 1 mL de medio de cultivo RPMI-1640 + 10% SFB. Se tomó una muestra de 10 uL a la que se le realizó un conteo celular con hematocitómetro utilizando azul tripán (Gibco®) en una proporción 1:1, para determinar el porcentaje de viabilidad tal como se indicó anteriormente. Con base en esto, se ajustó el volumen a la concentración celular requerida.
Selección de linfocitos T
Para la selección de linfocitos T, en dos de los métodos de selección utilizados, se preparó previamente placas de cultivo celular de 96 pozos con 100 µL de anticuerpo para detección del receptor CD3 (eBioscience®, 16-0032-82) a una concentración de 25 µg/mL, y se incubó durante toda la noche a 4°C. Luego de retirar el exceso de anticuerpo, se agregó 200 µL de solución post-cobertura (PBS pH ٧.٢ + ٥٪ SFB) por pozo y se incubó por 4 horas a 4°C. Posteriormente, se realizaron tres lavados con PBS a toda la placa.
Método 1. Selección con solución amortiguadora de amonio-cloruro-potasio (ACK) y adherencia empleando anticuerpos anti-CD3 (anti-CD3): Se resuspendió el precipitado celular obtenido en 10 mL de solución amortiguadora ACK (1.5 M NH4Cl, 100 mM KHCO3, 10 mM EDTA), y luego se centrifugó a 100 g durante 10 minutos. Se descartó el sobrenadante, y se sembró en una placa de 6 pozos con 3 mL de medio de cultivo RPMI-1640 + 10% SFB con activadores para proliferación linfocitaria (250 µg/mL ionomicina y 5 µg/mL forbol 12-miristato 14-acetato (PMA por sus siglas en inglés)) por pozo, y se incubaron durante toda la noche a 37°C. Posteriormente, se inoculó 100 µL de suspensión celular por pozo, con aproximadamente 7 x 104 células/pozo en la placa sensibilizada con anti-CD3, y se incubaron por 2 h a 37°C. Luego de ello, se realizó un conteo de las células en suspensión en el sobrenadante, y se contabilizó la cantidad de células adheridas por exclusión.
Método 2. Selección con Ficoll y adherencia empleando anti-CD3: Se agregó el precipitado celular resuspendido en 4 mL de RPMI-1640 con 3 mL de Ficoll Paque PLUS (GE Healthcare®), y se centrifugó a 400 g durante 30 minutos. Se separó la capa superior sin perturbar los linfocitos acumulados en la interfaz.
Estas células se ajustaron a la misma concentración que en el método anterior, y se continuó el proceso de la misma manera para la selección positiva por adherencia con anti-CD3.
Método 3. Selección negativa empleando microesferas magnéticas: Para estos ensayos se utilizó un kit de selección negativa para linfocitos T por microesferas magnéticas. Se resuspendió el precipitado celular a una concentración de 1 x 107 células/mL y se tomaron 500 µL, a los que se agregó 100 µL de SFB inactivado por calor a 56°C durante 30 minutos y 100 µL de mezcla de anticuerpos del kit. Se incubó durante 20 minutos a 4°C.
Posteriormente, se realizó un lavado con 10 mL de amortiguador de aislamiento del kit, y se centrifugó por 8 minutos a 350 g. Luego, el precipitado celular se resuspendió en 4 mL de amortiguador de aislamiento y se agregó 1 mL de las microesferas magnéticas preparadas como indica la casa comercial. Se incubó durante 15 minutos a 25°C, y posteriormente se agregó ٥ mL de amortiguador de aislamiento. Las células resuspendidas se expusieron a un imán para separar las células no deseadas (adheridas a las microesferas magnéticas), se recuperó el sobrenadante con las células de interés y se realizó un conteo celular como se indicó anteriormente.
En los tres métodos, una vez que se seleccionaron los linfocitos T, se realizó un conteo celular. La relación entre la cantidad de células iniciales aisladas del bazo y la cantidad de linfocitos T viables, se considera el porcentaje de recuperación.
Identificación de linfocitos T
Se realizaron ensayos de inmunofluorescencia para identificar linfocitos T. Para ello se colectaron aproximadamente 4 x 105 células por muestra, tanto de las células obtenidas del aislamiento del bazo, como de las obtenidas al final de cada método de selección.
Se realizó un bloqueo a las células con 100 µL de solución de bloqueo (PBS + 2% SFB + 1 mM EDTA) durante 1 hora a 4°C, para reducir interferencias en la identificación de los linfocitos T, y luego se centrifugó durante 5 minutos a 300 g. Cada precipitado celular se resuspendió en 100 µL de la dilución 1:250 del anticuerpo primario anti-CD3 en solución de bloqueo, se incubó por 30 minutos a 4°C y luego se centrifugó 5 minutos a 300 g. Posteriormente, el precipitado celular se resuspendió en 100 µL de solución FACS para su lavado y se procedió a una nueva centrifugación, para resuspenderlo en 100 µL de una dilución 1:400 de anticuerpo secundario anti-conejo IgG ligado a Alexa Fluor Plus 555 (A32732, Thermo Scientific®) en solución de bloqueo. Se incubó 1 hora a 4°C y luego se centrifugó una última vez. Tras eliminar el sobrenadante, las células se montaron en un portaobjetos recubierto con gelatina para promover la adherencia de los linfocitos T, al cual se añadió una gota de medio de montaje ProlongTM Gold con 4’,6-diamino-2-fenilindol (DAPI, Life Technologies) como medio de montaje y para marcar los núcleos.
Resultados
En los tres métodos de selección: con amortiguador ACK-adhesión celular, con Ficoll y con microesferas magnéticas (kit), se comprobó la presencia de linfocitos T utilizando inmunotinción con anti-CD3 (figura 1).
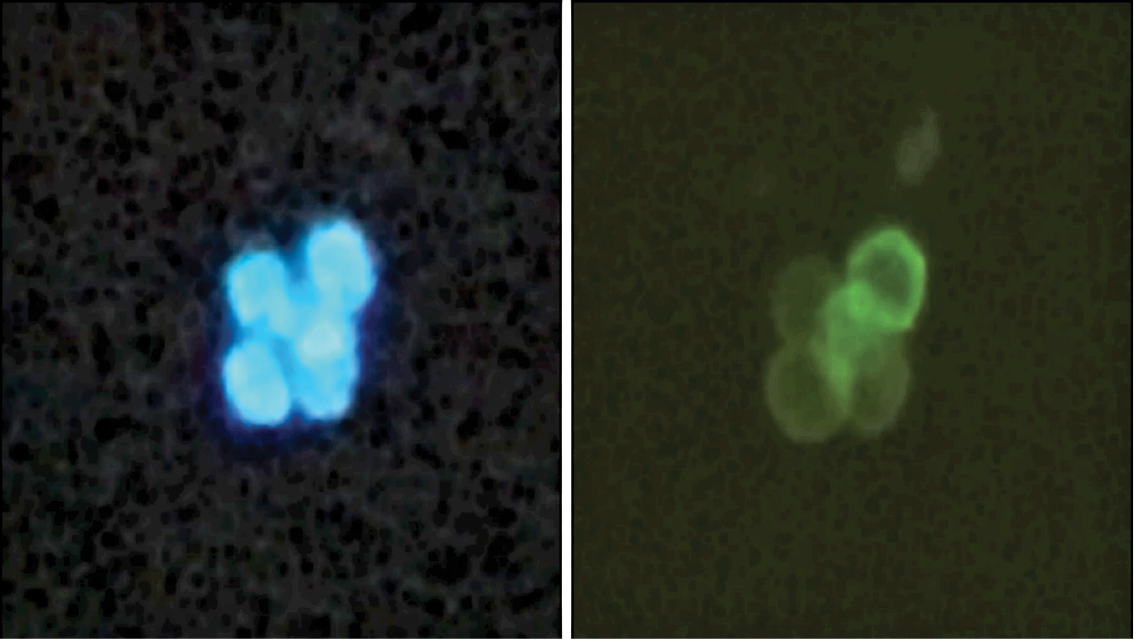
Figura 1. Inmunofluorescencia de una suspensión de linfocitos T purificados a partir de bazo de ratón. En color azul se observa los núcleos teñidos con DAPI (4’,6-diamino-2-fenilindol), y en color verde se detecta la presencia del receptor CD3 (40X).
Se muestra el porcentaje de pureza, porcentaje de viabilidad y porcentaje de recuperación respecto a los valores teóricos esperados para bazos de ratón (figura 2). Los tres métodos de aislamiento y selección de linfocitos T, evidenciaron un alto porcentaje de viabilidad celular (95%). Además, se observó un mayor grado de pureza (90%) con el método de aislamiento que utiliza microesferas magnéticas. El método que emplea la solución amortiguadora ACK y selección con anti-CD3, obtuvo el mayor porcentaje de recuperación (70%) de linfocitos T.
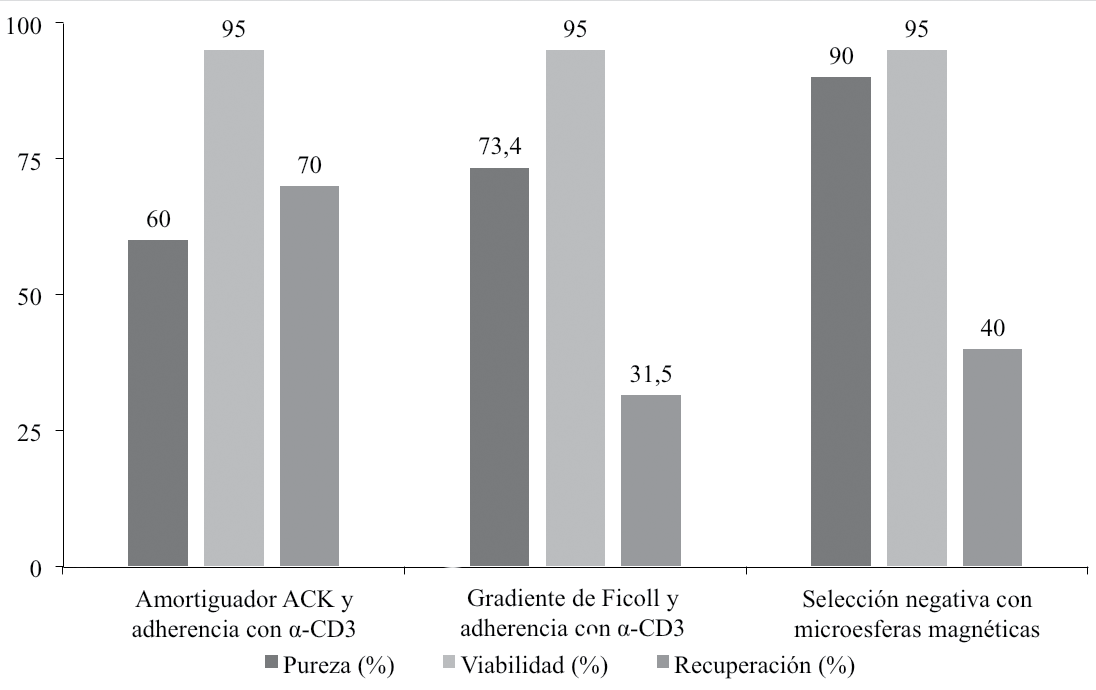
Figura 2. Parámetros para la evaluación del aislamiento y selección de linfocitos T de bazo de ratón por tres métodos: aislamiento con amortiguador de amonio-cloruro-potasio (ACK) y selección positiva con anti-CD3 (método 1), aislamiento con Ficoll y selección positiva con anti-CD3 (método 2) y aislamiento y selección negativa con microesferas magnéticas (kit comercial, método 3). Cabe resaltar el alto porcentaje de viabilidad obtenido con los tres métodos.
Discusión
La implementación de kits comerciales de selección de linfocitos T es una alternativa efectiva para obtener poblaciones purificadas de este tipo celular. Sin embargo, dado su alto costo económico, es relevante evaluar la relación efectiva de su implementación, comparando con métodos más básicos que podrían ser igualmente efectivos y de menor costo.
Cabe mencionar, que muchos de los reportes de grupos de investigación que trabajan con linfocitos T de cultivo primario los obtienen de sangre periférica [15], [16], esto por cuanto facilita la obtención de la muestra, ya sea en seres humanos o animales, y en este último caso, evita el sacrificio de los individuos que son objeto de estudio [17]. Sin embargo, debido a la necesidad de contar con una cantidad considerable de células murinas para aplicaciones subsecuentes, la extracción del bazo representa la opción más conveniente, dado que se conoce que posee zonas enriquecidas con linfocitos T [18] y que es de relativamente fácil acceso. Una vez obtenido el bazo, la utilización de la técnica adecuada de aislamiento, permite obtener la fracción de células mononucleadas enriquecida en linfocitos con menor cantidad de eritrocitos y células polimorfonucleadas.
Haciendo un análisis puntual de los resultados presentados, como primera impresión se observa que el método 2 tuvo el porcentaje de recuperación más bajo de los tres evaluados; el método 3 (kit comercial) fue el más selectivo para recuperar células CD3 de alta pureza (90% de las células recuperadas); y el método 1 logró mayor porcentaje de recuperación (70%) que el kit comercial (40%), pero fue el método menos selectivo: sólo 60% de las células recuperadas son CD3 (30% menos que el kit comercial).
Sin embargo, al comparar en términos relativos la recuperación para cada uno de los tres métodos, se puede determinar que el método 1 y el método 3 obtuvieron un rendimiento similar en cuanto a la cantidad final de linfocitos T viables recuperados. Esto es debido a que para comparar los tres métodos, es necesario evaluar la pureza y viabilidad obtenidas a partir del porcentaje de linfocitos T recuperados del órgano. Es decir, tomando en cuenta la proporción de células recuperadas que son linfocitos T viables al final de la selección, en ambos casos se obtuvo un rendimiento similar.
En cuanto a la pureza evaluada en los cultivos, el método 1 de aislamiento, además de utilizar el amortiguador ACK para eliminar los eritrocitos, implica la adhesión de varios tipos celulares, entre los que se puede encontrar células del sistema inmune como natural killer (NK), monocitos y linfocitos B [19]. Estos tipos celulares también forman parte de la fracción blanca que se aísla con el Ficoll (método 2) [2], [20]. Es posible que, dado que los leucocitos polimorfonucleares son células adherentes [21], también sean separadas de la fracción en suspensión por adhesión con el método 1. En este sentido, el método 1 implica dos pasos independientes de separación de las fracciones celulares contaminantes (eritrocitos, polimorfonucleares y mononucleares adherentes) de la fracción de linfocitos T, mientras que el método 2 separa todas las fracciones en un solo paso en un gradiente de densidad generado con el Ficoll. Esto puede provocar que a la hora de separar la fracción de linfocitos del gradiente de Ficoll, se arrastren células contaminantes que afecten la pureza de la fracción de linfocitos T, principalmente por la presencia de células mononucleares [2] que se separan en el gradiente bajo las mismas características de los linfocitos T. Así, dado que la fracción recuperada del método 1 tras la adhesión a la placa de cultivo posee menos tipos celulares, es probable que la purificación en la placa de anti-CD3 sea más eficiente en comparación con el método de separación por Ficoll.
Una característica que llama la atención es la alta viabilidad de la porción de linfocitos T en los tres métodos. Esta viabilidad pudo ser mantenida hasta 72 horas post-cultivo (tiempo máximo de los ensayos) con la activación inespecífica de los activadores para proliferación linfocitaria, PMA y ionomicina (datos no mostrados). Es bien conocido que uno de los requisitos para mantener la viabilidad y proliferación de los linfocitos T en cultivo es su activación [22]. En el caso del kit, la viabilidad de 95% determinada por conteo celular con azul tripán, corresponde a células no activadas pues no se utilizan activadores químicos ni anticuerpos hasta el cultivo. Sin embargo, el corto tiempo que implica la selección y cultivo de los linfocitos, puede favorecer la alta viabilidad (dado que en el cultivo las células se exponen a los activadores químicos). Cabe destacar que si bien el cultivo se mantuvo por 72 horas máximo, es posible que su viabilidad se mantenga por más tiempo, para lo que sería relevante realizar una curva de crecimiento con diferentes métodos de activación, a tiempos aún mayores a 72 horas para determinar el tiempo máximo de cultivo que se puede alcanzar, así como su pico de proliferación.
La principal ventaja encontrada con el uso del kit, fue la facilidad y rapidez en el aislamiento de los linfocitos T. Esto permitió, obtener cultivos frescos de manera expedita, lo cual representa una ventaja cuando el cultivo requiere obtenerse de manera continua. Sin embargo, su uso dependerá de las posibilidades económicas de cada laboratorio. Además, cabe destacar que en términos generales, la utilización del kit permite obtener una población de linfocitos no activados por el método de selección, por lo que pueden ser estimulados por la vía que sea más conveniente para cada investigación. Este aspecto representa una ventaja sobre los otros dos protocolos aquí planteados.
Así, se observa que la utilización del método de aislamiento por ACK (método 1) puede representar una opción viable, menos costosa y comparable en la obtención de linfocitos T viables, en relación con el kit de microesferas magnéticas (método 3). Sin embargo, en términos de rapidez y facilidad del aislamiento, el kit representa la mejor opción. Dependerá del enfoque del estudio, así como los recursos del laboratorio la utilización de uno u otro método para la obtención de linfocitos T murinos de bazo.
Conclusiones
El enfoque del estudio con linfocitos T determina las variables a tomar en cuenta a la hora de seleccionar un método de aislamiento de cultivo primario. El aislamiento de linfocitos T con el amortiguador ACK-adhesión de celular y selección por anti-CD3, es un método de bajo costo que presentó una mayor eficiencia de recuperación de linfocitos T viables en comparación a la obtenida por el kit de selección negativa de linfocitos T con microesferas magnéticas, aunque de menor pureza. La utilización necesaria del kit depende de las condiciones del estudio, pero en los casos donde se pueda prescindir de su uso, el método aquí presentado es una opción de fácil implementación para obtener linfocitos T viables activados para subsecuentes aplicaciones.
Recomendaciones
Como se mencionó anteriormente, el objetivo del estudio determinará el tipo de aislamiento de linfocitos T requerido, sin embargo, la utilización del kit permite obtener células en su estado nativo, lo cual presenta una ventaja pues se puede dirigir el tipo de activación específica que se requiera.
Adicionalmente, se podría utilizar el anticuerpo anti-CD28 en conjunto con el anticuerpo anti-CD3, dado que su función es complementaria tanto para la selección por adherencia, como para la detección de linfocitos T mediante inmunofluorescencia.
Agradecimientos
Agradecemos a la Vicerrectoría de Investigación y Extensión del TEC por el financiamiento de este proyecto (VIE CF 1510076) y al Centro Nacional de Innovaciones Biotecnológicas por el aporte y el apoyo brindado.
Referencias
[1] S. Abbas, A. Lichtman, and A. Pillai, Cellular and molecular immunology, 9th ed. Elsevier, 2017.
[2] K. Murphy, Janeway’s Immunobiology, 8th ed. United States of America: Garland Science, 2011.
[3] C. Lamers, R. Van de Griend, E. Braakman, C. Ronteltap, J. Bénard, G. Stotter, J. Gratama, and R. L. H. Bolhuis, “LARGE-SCALE EXPANSION OF HUMAN T LYMPHOCYTES FOR,” Int. J. Cancer, vol. 979, pp. 973–979, 1992.
[4] M. L. Zandvliet, E. Van Liempt, I. Jedema, S. Kruithof, M. G. D. Kester, H. Guchelaar, J. H. F. Falkenburg, and P. Meij, “Simultaneous Isolation of CD8 + and CD4 + T Cells Specific for Multiple Viruses for Broad Antiviral Immune Reconstitution After Allogeneic Stem Cell Transplantation,” J. Immunother., vol. 34, no. 3, pp. 307–319, 2011.
[5] P. Sourav, S. Girdhari, and G. Lal, “Role of gamma-delta ( gd ) T cells in autoimmunity,” J. Leukoc. Biol., vol. 97, no. February, pp. 259–271, 2015.
[6] W. A. Comrie and M. J. Lenardo, Molecular Classification of Primary Immunodeficiencies of T Lymphocytes, 1st ed., vol. 138. Elsevier Inc., 2018.
[7] A. J. Kleinman, R. Sivanandham, I. Pandrea, C. A. Chougnet, and C. Apetrei, “Regulatory T Cells As Potential Targets for Hiv Cure Research,” Front. Immunol., vol. 9, no. April, pp. 1–16, 2018.
[8] H. Kahlert, “Production of T-Cell Lines,” in Methods in Molecular Medicine: Allergy Methods and Protocols-, no. 1, M. G. Jones and P. L. Lympany, Eds. Totowa, N.J.: Humana Press, 2008, pp. 31–41.
[9] Y. K. Chae, A. Arya, W. Iams, M. R. Cruz, S. Chandra, J. Choi, and F. Giles, “Current landscape and future of dual anti- CTLA4 and PD-1 / PD-L1 blockade immunotherapy in cancer ; lessons learned from clinical trials with melanoma and non- small cell lung cancer ( NSCLC ),” J. Immunother. Cancer, vol. 6, no. 39, p. 27, 2018.
[10] N. M. Ratnam, R. . Mark, and A. J. Giles, “Immunotherapy in CNS cancers: the role of immune cell trafficking,” Oxford Univ. Press, 2018.
[11] M. Rodríguez-Zúñiga, F. Cortez-Franco, and F. Qujiano-Gomero, “Leucemia / linfoma de células T del adulto . Revisión,” Actas Dermo-Sifilográficas, pp. 1–9, 2018.
[12] B. Shang, Y. Liu, S. Jiang, and Y. Liu, “Prognostic value of tumor- infiltrating FoxP3 + regulatory T cells in cancers : a systematic review and meta-analysis,” Nat. Publ. Gr., vol. 15179, no. 5, pp. 1–9, 2015.
[13] C. Pelegri, M. Rodriguez-palmer, M. Paz, J. Comas, M. Caste, and A. Franch, “METHODS Comparison of four lymphocyte isolation methods applied to rodent T cell subpopulations and B cells,” J. Immunol. Methods, vol. 187, pp. 265–271, 1995.
[14] A. M. Thornton, “Fractionation of T and B Cells Using,” Curr. Protoc. Immunol., vol. 55, pp. 1–11, 2003.
[15] C. T. Lefort and M. Kim, “Human T Lymphocyte Isolation , Culture and Analysis of Migration In Vitro,” J. Vis. Exp., vol. 40, pp. 2–5, 2017.
[16] M. Raulf-Heimsoth, T Cell — Primary Culture from Peripheral Blood. Totowa, N.J.: Humana Press, 2008.
[17] U. C. Nygaard and M. Løvik, “Blood and spleen lymphocytes as targets for immunotoxic effects in the rat — a comparison,” Toxicology, vol. 174, pp. 153–161, 2002.
[18] R. E. Mebius and G. Kraal, “STRUCTURE AND FUNCTION OF THE SPLEEN,” Nat. Publ. Gr., vol. 5, no. August, pp. 606–616, 2005.
[19] N. Delirezh, E. Shojaeefar, P. Parvin, and B. Asadi, “Comparison The Effects of Two Monocyte Isolation Methods , Plastic Adherence and Magnetic Activated Cell Sorting Methods , on Phagocytic Activity of Generated Dendritic Cells,” Cell J., vol. 15, no. 3, pp. 218–223, 2013.
[20] A. Boyum, “Isolation of Lymphocytes , Granulocytes and Macrophages,” Scand. J. Immunol., vol. 5, no. 5, pp. 9–15, 1976.
[21] T. Tanigawa, Y. Kotake, M. Itanigawa, and L. A. Reinke, “Mutual Contact of Adherent Polymorphonuclear Leukocytes Inhibits Their Generation of Superoxide,” Free Radic. Res., vol. 5762, no. March, pp. 361–373, 2016.
[22] S. Hashimoto, Y. Takahashi, Y. Tomita, T. Hayama, S. Sawada, T. Horie, C. C. Mccombs, and J. P. Michalski, “Mechanism of Calcium Ionophore and Phorbol Ester-Induced T-cell Activation Accessory Cell Requirement for T-cell Activation,” Scand. J. Immunol., vol. 33, pp. 393–403, 1991.
1 Investigador Instructor. Ingeniero en Biotecnología. Centro de Investigación en Biotecnología, Tecnológico de Costa Rica. Correo electrónico: marchaves@tec.ac.cr
2 Investigador Instructor. Ingeniero en Biotecnología. Centro de Investigación en Biotecnología, Tecnológico de Costa Rica.
3 Ingeniero en Biotecnología. Centro de Investigación en Biotecnología, Tecnológico de Costa Rica.
4 Investigador Instructor. Investigador Adjunto. Doctora en Ciencias Naturales. Centro de Investigación en Biotecnología, Tecnológico de Costa Rica.
5 Investigador Asociado. Doctor en Biomedicina. Centro de Investigación en Biotecnología, Tecnológico de Costa Rica. Correo electrónico: erhernandez@tec.ac.cr
6 Investigador. Doctor en Fisiología. Centro Nacional de Innovaciones Biotecnológicas (CENIBiot-CENAT).