El hongo de la Pudrición gris
(Botrytis cinerea): amenaza creciente para el cultivo de frutos rojos en Costa Rica
|
Erick Vindas-Reyes Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica evindas@itcr.ac.cr |
Giovanni Garro-Monge Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica ggarro@itcr.ac.cr |
|
|
Karla Meneses-Montero Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica kmeneses@itcr.ac.cr |
Luis Barboza-Fallas Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica lubarboza@itcr.ac.cr |
|
|
Luis Alvarado-Marchena Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica lalvarado@itcr.ac.cr |
Randall Chacón-Cerdas Centro de Investigación en Biotecnología Tecnológico de Costa Rica. Costa Rica rchacon@itcr.ac.cr |
Fecha de recepción: 30 de mayo del 2025 | Fecha de aprobación: 20 de noviembre del 2025
Resumen
El cultivo de frutos rojos en un país tropical como Costa Rica enfrenta retos agronómicos importantes debido a enfermedades como la pudrición gris de los frutos causada por el hongo Botrytis cinerea. Mediante diversos proyectos de extensión desarrollados en el Instituto Tecnológico de Costa Rica (ITCR) se generó conocimiento local sobre el impacto de esta enfermedad en frutos como la fresa, arándano, frambuesa y la mora al combinar los criterios de productores, comercializadores y consumidores. Los resultados evidenciaron que la fresa es el cultivo que se ve también más afectado con pérdidas que en campo abierto pueden alcanzar el 80%. También se confirmó que la producción en invernadero mejora el manejo de la enfermedad y que la aplicación de fungicidas químicos convencionales es recurrente entre los diferentes sistemas de producción, con porcentajes variables que pueden representar hasta el 40% de la cuota de agroquímicos totales del cultivo. Además, dentro de los esfuerzos realizados en el ITCR se desarrolló y evaluó un bioinsumo con efecto protector postcosecha, logrando una disminución de la incidencia de la pudrición en fresa y arándano, extendiendo su vida útil en hasta 5 días y reduciendo las pérdidas entre un 20% y 30% de fruta. Las lecciones aprendidas al interactuar con los productores incluyen la necesidad de fortalecer capacidades en manejo postcosecha, mejorar la articulación institucional asociada con estos cultivos y continuar la investigación para adaptar tecnologías disponibles y eficientes a condiciones locales que permitan producir de forma sostenible.
Palabras clave: frutos rojos, pudrición gris, protector postcosecha, extensión agrícola.
Abstract
The cultivation of berries in a tropical country such as Costa Rica faces significant agronomic challenges due to diseases like gray mold, caused by the fungus Botrytis cinerea. Through various extension projects developed at the Instituto Tecnológico de Costa Rica (TEC), local knowledge was generated on the impact of this disease on crops such as strawberry, blueberry, raspberry, and blackberry by integrating the perspectives of producers, marketers, and consumers. The results confirmed that strawberries are the most affected crop, with open-field losses reaching up to 80%. It was also verified that greenhouse production allows growers to improve disease management, and that the application of conventional chemical fungicides is common across different production systems, with usage levels representing up to 40% of the total agrochemical quote. Additionally, TEC developed and evaluated a postharvest bioprotective, which significantly reduced the incidence of gray mold in strawberries and blueberries, extending their shelf life by up to 5 days and reducing postharvest losses by 20–30%. Key lessons learned through collaboration with producers include the need to strengthen local capacities in postharvest management, improve institutional coordination related to berry crops, and continue applied research to adapt efficient technologies to local conditions that promote more sustainable agricultural practices.
Keywords: berries, gray mold, postharvest protector, agricultural extension.
Introducción
Los frutos rojos, como las fresas, arándanos, moras y frambuesas, han ganado gran popularidad en nuestro país en los últimos años debido a su sabor, versatilidad y beneficios para la salud. Normalmente a estos frutos se les conoce como bayas o frutos rojos a pesar de que botánicamente comparten diversas categorías de frutos. Estos frutos son ricos en antioxidantes y nutrientes esenciales, múltiples investigaciones han validado sus beneficios para la salud debido a sus componentes funcionales lo que ha impulsado su consumo masivo a nivel mundial [1], [2], [3], [4], [5]. Para finales de este 2025, se estima que el mercado global de bayas alcanzará los $26.91 mil millones, con un crecimiento anual del 5.1%, proyectando un tamaño de mercado al 2029 de $32.43 mil millones [6].
Sin embargo, la producción de frutos rojos enfrenta múltiples desafíos en cuanto a sostenibilidad. Las condiciones climáticas cambiantes, como temperaturas extremas y lluvias inesperadas, pueden afectar negativamente la calidad y el rendimiento de las cosechas. Además, los productores deben lidiar con plagas y enfermedades que amenazan sus cultivos. Enfermedades como la Botrytis cinerea, también conocida como moho gris, pueden causar pérdidas significativas de flores y frutas si no se controlan adecuadamente [7], [8], [9], [10].
¿Qué es Botrytis cinerea y que enfermedad produce?
Botrytis cinerea es el nombre del hongo asociado a la pudrición gris de flores y frutos en múltiples cultivos de interés comercial. Es una de las 35 especies que forman el género Botrytis (familia Sclerotiniaceae) donde la mayoría son agentes causales de enfermedades en plantas [11], [12]. Sin embargo, la especie B. cinerea es el más importante de todo este género ya que es capaz de infectar más de 500 especies de plantas [13], [14] y se encuentra dispersa por todo el mundo, siendo considerada por muchos años el segundo fitopatógeno con mayor impacto causando pérdidas de cultivos pre y postcosecha [15], [16]. Investigaciones previas han determinado afectación variable sobre el rendimiento dependiendo del sistema de cultivo, la variedad de la planta, las condiciones climáticas y las cepas del patógeno. Su impacto negativo en la agrocadena mundial ha alcanzado hasta $100 mil millones de dólares (USD) por año [14].
Este hongo produce un ablandamiento en los tejidos al segregar sus enzimas y toxinas [17], [18], [19], [20], y en etapas avanzadas de su infección llega a cubrir completamente los frutos y flores con su micelio gris. Puede penetrar en el fruto sin necesidad de heridas y debido a su alta capacidad de propagación durante la cosecha los frutos sanos se pueden contaminar con esporas provenientes de los infectados. Su desarrollo se ve favorecido con la alta humedad y un amplio rango de temperaturas. Cualquier factor que tienda a producir daños como magulladuras o exceso de manipulación en la cosecha favorece la propagación de la enfermedad.
Dentro de la amplia variedad de cultivos afectados se incluyen fresa, frambuesa, mora y arándano en la mayoría de las etapas de crecimiento, cosecha, transporte y almacenamiento [21], [22].
¿Cuál es el nivel de amenaza de esta enfermedad?
Algunos ejemplos de investigaciones previas para poner en contexto la problemática, son el caso de la disminución de hasta el 36% del área sembrada de fresa en California en un periodo de 11 años, lo que se tradujo a pérdidas de $250 millones anuales [23]. Para el caso de la frambuesa, el nivel de afectación se ha reportado entre 20 y hasta el 70% de reducción del rendimiento en algunas zonas productoras de Estados Unidos [15], [24]. En Canadá esta enfermedad es la responsable del 20% de las pérdidas del mercado de arándano [25]. En Colombia durante las épocas críticas de producción de mora se han reportado pérdidas entre el 50-76% de la fruta [26]. En el cuadro 01 se amplían algunos casos a nivel global sobre afectación en las frutas mencionadas.
Cuadro 1. Resumen no exhaustivo de reportes sobre la afectación global de la enfermedad en algunos frutos rojos.
|
Especie y cultivares |
País de reporte |
Afectación |
|---|---|---|
|
Frambuesa (Rubus idaeus) cv comercial provenientes de Chile y España Mora (Rubus ulmifolius) cv comercial proveniente de México Arándano (Vaccinium corymbosum) cv comercial proveniente de Chile |
Chile |
Incidencia del patógeno en el 25-50% de los frutos de frambuesa en postcosecha almacenados entre 5-10°C durante un lapso de 7-11 días [22]. 12% de frutos de mora en postcosecha con infección del patógeno luego de 23 días de almacenamiento a 5°C [22]. Menos del 10% de frutos de arándano en postcosecha con infección del patógeno luego de 21 días de almacenamiento a 10°C [22]. |
|
Frambuesa (Rubus idaeus) cv. comercial ‘Glen Ample’ |
Italia |
4-6% de incidencia del patógeno en fruta postcosecha luego de 9 días de almacenada en secuencia de frío (6d 4°C + 3d 20°C) [27]. |
|
Frambuesa (Rubus idaeus) cv. comercial ‘Wakefiel’ |
USA |
Incidencia dependiente del órgano afectado. Alta incidencia (>90%) en frutos verdes y maduros, mediana incidencia (43%) en flores desarrolladas. Condiciones climáticas de 70-90% de humedad relativa, temperaturas entre 10-20°C y niveles moderados de lluvia (<20mm/semana) [28]. |
|
Mora (Rubus ulmifolius) cv. comercial ‘Chester’ |
USA |
Incidencia del patógeno en el 10% de los frutos en postcosecha almacenados a 4°C durante 14 días [29]. |
|
Mora (Rubus ulmifolius) cv. comercial proveniente de Ecuador |
Ecuador |
Incidencia del 40% en la producción de frutos en clima tropical [30]. |
|
Arándano (Vaccinium corymbosum) cv silvestre proveniente de Canadá |
Canadá |
Afectación variable según condiciones agroclimáticas. Incidencia del 12-45% en zonas con temperaturas entre 8-15°C y precipitaciones moderadas (<15mm/h) provocando humedad sobre las hojas por periodos de hasta 12 horas [31]. |
|
Arándano (Vaccinium corymbosum) cv comercial ‘Brigitta’ y ‘Duke’ |
Chile |
Incidencia dependiente del órgano afectado. Cerca del 70-90% de las flores infectadas y entre el 10-20% de los frutos maduros en postcosecha, siendo el grado de madurez determinante para el incremento de la infección. Temperatura de almacenamiento a 20°C y humedad relativa mayor al 90% [32]. |
|
Fresa (Fragaria × ananassa Duch) cv. comercial ´Florida Fortuna´ |
Egipto |
En condiciones de alta humedad y ausencia de fungicida el patógeno puede infectar entre el 53-87% de frutos postcosecha en un lapso de 7-10 días [33]. |
|
Fresa (Fragaria × ananassa Duch) cv comercial ‘Monterrey’ |
China |
Incidencia del patógeno en el 50% de los frutos en postcosecha almacenados a 22°C y 91% de humedad relativa durante 4 días [34]. |
|
Fresa (Fragaria x ananassa Duch) cv. comercial ´Benihoppe´ |
China |
Entre el 75-100% de los frutos postcosecha pueden mostrar signos de infección al sexto día de almacenamiento [35]. |
|
Fresa (Fragaria x ananassa Duch) cv comercial proveniente de China |
China |
45% de incidencia del patógeno en fruta postcosecha luego de 10 días de almacenamiento a 4°C [36]. |
|
Fresa (Fragaria x ananassa Duch) cv comercial proveniente de China |
China |
Luego de 4 días posterior a la infección, el 40% del área de la fruta infectada en postcosecha muestra pudrición severa. Condiciones de Incubación a 90% de humedad relativa y 15°C [37]. |
Además de su impacto económico, Botrytis cinerea también tiene un impacto ambiental significativo. Los productores a menudo utilizan fungicidas para controlar la enfermedad, lo que puede tener efectos negativos en la salud humana y el medio ambiente. Además, el uso excesivo de fungicidas puede provocar la aparición de cepas resistentes del hongo, lo que dificulta aún más su control. Actualmente el control de esta enfermedad representa el 8% del mercado global de fungicidas [38].
¿Cuál es su impacto en los frutos rojos nacionales?
En nuestro país estas frutas se cultivan principalmente en el Gran Área Metropolitana, la información disponible sobre área de siembra de la fresa y el impacto económico data del 2015 cuando el censo agrícola contabilizó 335 fincas comerciales como soporte económico para decenas de familias asociadas al cultivo[39]. Para el caso de la mora, un dato del 2022 publicado por la Presidencia de Costa Rica indicó que se contabilizaban al momento 1115 productores [40]. Las otras frutas como la frambuesa y el arándano han ganado interés comercial y se integran generalmente en los cultivos de fresa y mora, no obstante, no existe a la fecha un registro específico de su crecimiento.
De acuerdo con datos de una pequeña muestra de 13 productores localizados en la zona norte de Cartago y la zona de Los Santos, con áreas de siembra que oscilan entre cientos y miles de metros cuadrados, las pérdidas en la producción de frutas ocasionadas por esta enfermedad son muy variables.
Esta variación se atribuye a múltiples factores propios de cada finca, como el tipo de manejo preventivo o curativo que realizan de las enfermedades, el enfoque químico/orgánico/mixto, la frecuencia y rotación de aplicaciones de fungicidas tradicionales o insumos biológicos, el sistema de cultivo en invernadero o campo abierto, la forma hidropónica o en montículos, la cercanía con otros cultivos susceptibles a la enfermedad que pueden actuar como reservorios permanentes del hongo, las variedades de las planta, la edad productiva de la plantación, la época lluviosa o la estación seca, la zona de siembra en cuanto a la altura y colindancia con otras actividades agrícolas, entre otros factores propios de las prácticas agrícolas propias.
Para el caso de la fresa, los datos resumidos sugieren que la producción en invernadero es generalmente más controlada y menos afectada que en campo abierto. Las pérdidas locales del cultivo en ambiente protegido oscilan entre un 7% y hasta un 20% por cosecha, donde la inversión en manejo de enfermedades asociadas con la pudrición de frutas y flores es del 10% de la cuota total de aplicación de agroquímicos. En campo abierto, las pérdidas históricas oscilan desde un 5% hasta un 80%, y la inversión en el control de pudrición puede ascender hasta el 40% de la cuota total de agroquímicos. Los números menos alentadores se han registrado en invierno cuando las condiciones climáticas favorecen la propagación de la enfermedad y se observa mayor afectación incluso a nivel de flores. Dependiendo del tamaño de la producción afectada, estas pérdidas pueden llagar a anular los compromisos comerciales de los productores y esto ha sido una de las razones por las que algunos de ellos han confirmado que disminuyeron su área de siembra en los últimos 5 años, o empezaron a sembrar otras frutas en asocio para no depender tanto de la fresa.

Figura 1. Datos resumidos de afectación máxima y porcentaje de gastos de la cuota de agroquímicos en relación con el manejo de la pudrición gris en algunos frutos rojos de Costa Rica. Fuente: Elaboración propia de los autores.
En cuanto a la afectación en cultivos de arándano, mora y frambuesa, que son frutas de menor área de siembra en el país, pero que se asocian generalmente con el cultivo de fresa, se repite el mismo patrón variable del nivel de afectación de la enfermedad. En el caso del arándano se ha visto que presenta mayor resistencia natural a la enfermedad, se siembra principalmente en invernadero y de las frutas en asocio es la que sufre menor impacto con aproximadamente el 5% de afectación en época lluviosa. La proporción que representa el manejo de enfermedades asociadas con la pudrición es solo el 2% de la inversión total de agroquímicos para este cultivo.
|
|
|
|
|
Mora: día 4 |
||
|
|
|
|
|
Frambuesa: día 7 |
Arándano: día 13 |
Fresa: día 13 |
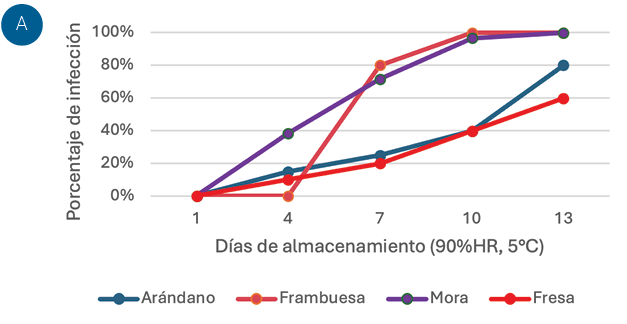
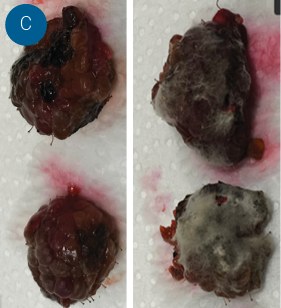
Figura 2. Progreso de la pudrición en frutos postcosecha. A. Gráfico comparativo resumen para dos semanas de almacenamiento a 5°C y 90% de humedad relativa. B. Muestra del estado de la fruta de mora a los 4 días de incubación. C. Muestra del estado de la fruta de frambuesa a los 7 días de incubación. D. Muestra del estado de la fruta de arándano a los 13 días de incubación. D. Muestra del estado de la fruta de fresa a los 13 días de incubación. Fuente: Elaboración propia de los autores.
La mora es un cultivo más susceptible, se siembra generalmente en campo abierto y las plantaciones tienen mucha relación con el manejo de fresa. La afectación en calidad de la fruta por la pudrición rápida, principalmente en postcosecha puede llegar al 20% de la cosecha y su control en planta puede llegar a demandar un porcentaje del 20% de las aplicaciones de agroquímicos para el cultivo. La figura 01 presenta el resumen de los máximos de afectación reportado y la inversión porcentual para su control según los datos locales obtenidos de la muestra de productores.
Por último, pero no menos importante, el caso de la frambuesa, aunque es la fruta de menor área de siembra entre las mencionadas, es la de mayor valor de venta al compararla por gramo. Su cultivo es de pocos miles de metros entre los productores de la zona quienes también tienen poco tiempo de producirla con fines comerciales. Estas son algunas de las razones por las que aún no se cuenta con un registro histórico del daño por pudrición en la planta o en postcosecha, e incluso los productores utilizan remanentes del paquete de agroquímicos general de la finca para manejarla. Parte de los retos de este cultivo es la poca dureza de la fruta, su deshidratación y descomposición incluso durante el manejo en la cosecha, lo que ha hecho que las pérdidas por pudrición hayan pasado a un segundo plano hasta el momento.
Pruebas postcosecha con fruta de diferentes localidades confirmaron la agresividad del patógeno, donde se observan signos de la enfermedad de forma rápida y severidad variable en un periodo de dos semanas de observación de fruta en refrigeración a 5°C y alta humedad relativa de 90% (Figura 02).
Como se mencionó anteriormente, este mercado de frutos rojos está en crecimiento global, y en Costa Rica los principales cultivos de esta categoría no están exentos de los retos agronómicos y fitosanitarios, por lo cual es necesario atender de forma integral y sostenible los requerimientos para la producción comercial, tomando ventaja de las nuevas tendencias en aplicación de bio-insumos, por ejemplo, con sistemas de nano y micro fabricación de moléculas y biomasa encapsuladas para uso agrícola [41].
Conclusiones
El análisis de la información presentada evidencia que Botrytis cinerea, conocido comúnmente como el hongo de la pudrición gris, representa una amenaza creciente para la producción de bayas tanto a nivel global como nacional. En Costa Rica, esta enfermedad encuentra condiciones altamente favorables para su desarrollo, especialmente durante la época lluviosa y en cultivos establecidos a cielo abierto. Las pérdidas asociadas pueden ser significativas, afectando no solo el rendimiento en campo, sino también la calidad de la fruta durante la postcosecha, lo cual repercute directamente en la viabilidad económica de los pequeños y medianos productores.
Entre los cultivos evaluados, la fresa se posiciona como el más afectado por la pudrición gris, particularmente cuando se cultiva fuera de ambientes protegidos. La mora también presenta una alta susceptibilidad, mientras que el arándano, gracias a su mayor resistencia fisiológica y al hecho de cultivarse en condiciones más controladas, experimenta una incidencia relativamente menor. No obstante, todas las bayas son susceptibles en mayor o menor medida, y su manejo requiere atención constante. Si bien el uso de fungicidas ha sido la estrategia principal para su control, esta solución es parcial y viene acompañada de preocupaciones ambientales y riesgos asociados a la generación de cepas resistentes del patógeno. Esto demuestra la necesidad de adoptar estrategias más sostenibles y adaptativas.
Recomendaciones
Frente al impacto creciente de Botrytis cinerea en la producción de bayas en Costa Rica, es imperativo avanzar hacia un enfoque de manejo integral de la enfermedad que combine prácticas culturales, físicas, biológicas y químicas de forma estratégica. Esto incluye, por ejemplo, el uso racional y rotativo de fungicidas, así como la incorporación de bioinsumos y agentes de control biológico que permitan reducir la presión selectiva sobre el hongo. Además, se recomienda fortalecer la capacitación técnica de los productores en la identificación temprana de síntomas, las condiciones predisponentes a la enfermedad y la optimización de las prácticas postcosecha.
Asimismo, resulta urgente generar información sistemática y actualizada sobre la incidencia y severidad de esta enfermedad en otros cultivos como la frambuesa y el arándano, que, aunque poseen menor área de siembra, están en expansión comercial y podrían beneficiarse de estrategias preventivas basadas en evidencia. Finalmente, es crítico fomentar la investigación aplicada orientada al desarrollo de variedades resistentes, así como la innovación en tecnologías de conservación postcosecha que mejoren la vida útil de estos frutos sin comprometer la calidad ni la inocuidad alimentaria.
Referencias
[1] N. Sivapragasam et al., “Edible Berries- An Update on Nutritional Composition and Health Benefits- Part III,” Curr Nutr Rep, vol. 14, no. 1, p. 11, Jan. 2025, doi: 10.1007/S13668-024-00606-Z.
[2] S. Jain et al., “Edible Berries- An Update on Nutritional Composition and Health Benefits-Part I,” Curr Nutr Rep, vol. 14, no. 1, Dec. 2025, doi: 10.1007/S13668-024-00607-Y.
[3] P. Thorakkattu et al., “Edible Berries-An Update on Nutritional Composition and Health Benefits-Part II,” Curr Nutr Rep, vol. 14, no. 1, p. 10, Jan. 2025, doi: 10.1007/S13668-024-00608-X.
[4] S. Pedisić et al., “Valorization of Berry Fruit By-Products: Bioactive Compounds, Extraction, Health Benefits, Encapsulation and Food Applications,” Foods 2025, Vol. 14, Page 1354, vol. 14, no. 8, p. 1354, Apr. 2025, doi: 10.3390/FOODS14081354.
[5] O. Golovinskaia and C. K. Wang, “Review of Functional and Pharmacological Activities of Berries,” Molecules 2021, Vol. 26, Page 3904, vol. 26, no. 13, p. 3904, Jun. 2021, doi: 10.3390/MOLECULES26133904.
[6] The Business Research Company, “Berry Market Report 2025 - Berry Market Share And Trends By 2034,” London, UK, Jan. 2025. Accessed: May 19, 2025. [Online]. Available: https://www.thebusinessresearchcompany.com/report/berry-global-market-report.
[7] Y. Zhao, B. De Coninck, B. Ribeiro, B. Nicolaï, and M. Hertog, “Early detection of Botrytis cinerea in strawberry fruit during quiescent infection using selected ion flow tube mass spectrometry (SIFT-MS),” Int J Food Microbiol, vol. 402, Oct. 2023, doi: 10.1016/j.ijfoodmicro.2023.110313.
[8] S. Rupp et al., “Botrytis fragariae, a new species causing gray mold on strawberries, shows high frequencies of specific and efflux-based fungicide resistance,” Appl Environ Microbiol, vol. 83, no. 9, May 2017, doi: 10.1128/AEM.00269-17.
[9] D. Riquelme, Z. Aravena, H. Valdes-Gomez, B. A. Latorre, G. A. Diaz, and J. P. Zoffoli, “Characterization of Botrytis cinerea and B. Prunorum from Healthy Floral Structures and Decayed ‘Hayward’ Kiwifruit during Post-Harvest Storage,” Plant Dis, vol. 105, no. 8, Aug. 2021, doi: 10.1094/PDIS-04-20-0878-RE.
[10] M. Dwivedi, P. Singh, and A. K. Pandey, “Botrytis fruit rot management: What have we achieved so far?,” Food Microbiol, vol. 122, Sep. 2024, doi: 10.1016/j.fm.2024.104564.
[11] A. R. Garfinkel, “The history of botrytis taxonomy, the rise of phylogenetics, and implications for species recognition,” Phytopathology, vol. 111, no. 3, pp. 437–454, Mar. 2021, doi: 10.1094/PHYTO-06-20-0211-IA/ASSET/IMAGES/LARGE/PHYTO-06-20-0211-IAF4-1616020603590.JPEG.
[12] J. K. Richards, C. L. Xiao, and W. M. Jurick, “Botrytis spp.: A contemporary perspective and synthesis of recent scientific developments of a widespread genus that threatens global food security,” Phytopathology, vol. 111, no. 3, pp. 432–436, Mar. 2021, doi: 10.1094/PHYTO-10-20-0475-IA.
[13] Y. Elad, I. Pertot, A. M. Cotes Prado, and A. Stewart, “Plant hosts of Botrytis spp,” Botrytis - The Fungus, the Pathogen and its Management in Agricultural Systems, pp. 413–486, Jan. 2015, doi: 10.1007/978-3-319-23371-0_20/TABLES/1.
[14] N. Cheung, L. Tian, X. Liu, and X. Li, “The destructive fungal pathogen Botrytis cinerea—insights from genes studied with mutant analysis,” Pathogens, vol. 9, no. 11, pp. 1–46, Nov. 2020, doi: 10.3390/PATHOGENS9110923.
[15] R. Dean et al., “The Top 10 fungal pathogens in molecular plant pathology,” Mol Plant Pathol, vol. 13, no. 4, pp. 414–430, May 2012, doi: 10.1111/J.1364-3703.2011.00783.X.
[16] C. Pons, T. Le Noan, S. Laurent, H. Sallanon, P. Brat, and V. Vidal, “Pre and postharvest application of phenylalanine reduces Botrytis cinerea infection in strawberries during storage,” J Stored Prod Res, vol. 113, p. 102693, Jun. 2025, doi: 10.1016/J.JSPR.2025.102693.
[17] W. Brown, “Toxins and Cell-Wall Dissolving Enzymes in Relation to Plant Disease,” Annu Rev Phytopathol, vol. 3, no. Volume 3, 1965, pp. 1–21, Sep. 1965, doi: 10.1146/ANNUREV.PY.03.090165.000245.
[18] S. Fillinger and Y. Elad, “Botrytis - The fungus, the pathogen and its management in agricultural systems,” Botrytis - The Fungus, the Pathogen and its Management in Agricultural Systems, pp. 1–486, Jan. 2015, doi: 10.1007/978-3-319-23371-0.
[19] T. Mengiste, “Plant immunity to necrotrophs,” Annu Rev Phytopathol, vol. 50, pp. 267–294, Sep. 2012, doi: 10.1146/ANNUREV-PHYTO-081211-172955,.
[20] B. Williamson, B. Tudzynski, P. Tudzynski, and J. A. L. Van Kan, “Botrytis cinerea: the cause of grey mould disease,” Mol Plant Pathol, vol. 8, no. 5, pp. 561–580, Sep. 2007, doi: 10.1111/J.1364-3703.2007.00417.X.
[21] S. Petrasch, S. J. Knapp, J. A. L. van Kan, and B. Blanco-Ulate, “Grey mould of strawberry, a devastating disease caused by the ubiquitous necrotrophic fungal pathogen Botrytis cinerea,” Mol Plant Pathol, vol. 20, no. 6, pp. 877–892, Jun. 2019, doi: 10.1111/MPP.12794.
[22] M. P. Junqueira-Gonçalves, E. Alarcón, and K. Niranjan, “The efficacy of potassium sorbate-coated packaging to control postharvest gray mold in raspberries, blackberries and blueberries,” Postharvest Biol Technol, vol. 111, pp. 205–208, Jan. 2016, doi: 10.1016/J.POSTHARVBIO.2015.09.014.
[23] B. Qushim, F. Wu, Z. Guan, and N. Peres, “The Economic Impact of Botrytis Fruit Rot on Strawberry Production in Florida,” 2018 Annual Meeting, February 2-6, 2018, Jacksonville, Florida, Jan. 2018, doi: 10.22004/AG.ECON.266724.
[24] O. Kozhar and T. L. Peever, “How does Botrytis cinerea infect red raspberry?,” Phytopathology, vol. 108, no. 11, pp. 1287–1298, Nov. 2018, doi: 10.1094/PHYTO-01-18-0016-R/ASSET/IMAGES/LARGE/PHYTO-01-18-0016-R_F8-1539039025305.JPEG.
[25] J. A. Abbey, D. Percival, S. K. Asiedu, B. Prithiviraj, and A. Schilder, “Management of Botrytis blossom blight in wild blueberries by biological control agents under field conditions,” Crop Protection, vol. 131, p. 105078, May 2020, doi: 10.1016/J.CROPRO.2020.105078.
[26] L. Isaza, Y. P. Zuluaga, and M. L. Marulanda, “Morphological, pathogenic and genetic diversity of Botrytis cinerea Pers. in blackberry cultivations in Colombia,” Rev Bras Frutic, vol. 41, no. 6, p. e-490, Dec. 2019, doi: 10.1590/0100-29452019490.
[27] E. Lo Piccolo et al., “Can Chitosan Applications in Pre- and Post-Harvest Affect the Quality and Antioxidant Contents of Red Raspberries?,” Horticulturae 2023, Vol. 9, Page 1135, vol. 9, no. 10, p. 1135, Oct. 2023, doi: 10.3390/HORTICULTURAE9101135.
[28] O. Kozhar and T. L. Peever, “Colonization of red raspberry flowers and fruit by Botrytis cinerea under commercial production conditions in northwestern Washington, USA,” Plant Pathol, vol. 70, no. 2, pp. 336–348, Feb. 2021, doi: 10.1111/PPA.13284.
[29] D. S. Park, S. Y. Park, K. H. Liu, and K. M. Ku, “Optimal allyl isothiocyanate concentration on Botrytis cinerea during the postharvest storage of blackberries and mechanism of blackberry color changes at high concentration of allyl isothiocyanate,” Postharvest Biol Technol, vol. 199, p. 112292, May 2023, doi: 10.1016/J.POSTHARVBIO.2023.112292.
[30] I. E. Jinez and F. J. Flores, “Botrytis cinerea as a cause of blackberry gray mold disease in Ecuador,” Journal of Plant Pathology, vol. 106, no. 3, pp. 1421–1422, Aug. 2024, doi: 10.1007/S42161-024-01681-5/METRICS.
[31] J. Abbey, D. Percival, L. Jaakola, and S. K. Asiedu, “Efficacy, persistence and residue levels of fungicides for Botrytis control in wild blueberry,” Crop Protection, vol. 179, p. 106633, May 2024, doi: 10.1016/J.CROPRO.2024.106633.
[32] B. A. Latorre, S. A. Rivera, and J. P. Zoffoli, “Postharvest Control of Gray Mold on Blueberry Based on Critical Growth Stages and Infection Risk Estimations,” Post-harvest Pathology, pp. 81–87, 2014, doi: 10.1007/978-3-319-07701-7_7.
[33] D. Y. Abd-Elkader et al., “Post-Harvest Enhancing and Botrytis cinerea Control of Strawberry Fruits Using Low Cost and Eco-Friendly Natural Oils,” Agronomy 2021, Vol. 11, Page 1246, vol. 11, no. 6, p. 1246, Jun. 2021, doi: 10.3390/AGRONOMY11061246.
[34] X. Li, X. Xie, F. Xing, L. Xu, J. Zhang, and Z. Wang, “Glucose oxidase as a control agent against the fungal pathogen Botrytis cinerea in postharvest strawberry,” Food Control, vol. 105, pp. 277–284, Nov. 2019, doi: 10.1016/J.FOODCONT.2019.05.037.
[35] S. Jia, Y. Wang, G. Zhang, Z. Yan, and Q. Cai, “Strawberry FaWRKY25 Transcription Factor Negatively Regulated the Resistance of Strawberry Fruits to Botrytis cinerea,” Genes 2021, Vol. 12, Page 56, vol. 12, no. 1, p. 56, Dec. 2020, doi: 10.3390/GENES12010056.
[36] D. Wang, H. Yang, X. Lu, Y. Wu, and F. Blasi, “The Inhibitory Effect of Chitosan Based Films, Incorporated with Essential Oil of Perilla frutescens Leaves, against Botrytis cinerea during the Storage of Strawberries,” Processes 2022, Vol. 10, Page 706, vol. 10, no. 4, p. 706, Apr. 2022, doi: 10.3390/PR10040706.
[37] Y. Wang et al., “Impact of chitosan, sucrose, glucose, and fructose on the postharvest decay, quality, enzyme activity, and defense-related gene expression of strawberries,” Horticulturae, vol. 7, no. 12, p. 518, Dec. 2021, doi: 10.3390/HORTICULTURAE7120518/S1.
[38] R. Nishimoto, “Global trends in the crop protection industry,” J Pestic Sci, vol. 44, no. 3, pp. 141–147, Aug. 2019, doi: 10.1584/JPESTICS.D19-101.
[39] INEC, “Censo Agropecuario 2014 | INEC.” Accessed: May 25, 2025. [Online]. Available: https://inec.cr/estadisticas-fuentes/censos/censo-agropecuario-2014?filtertext=fresa
[40] Presidencia de Costa Rica, “Túnel de congelado rápido mejorará producción de mora en Cartago, Los Santos y Pérez Zeledón. ,” https://www.presidencia.go.cr/comunicados/2022/01/tunel-de-congelado-rapido-mejorara-produccion-de-mora-en-cartago-los-santos-y-perez-zeledon/.
[41] A. Tópor, F. F. Veras, F. A. Cacciatore, K. C. Hernandes, P. da Silva Malheiros, and J. E. Welke, “Nanoencapsulation reduces the perception of carvacrol odor, enhances the control of Botrytis cinerea growth and preserves grape quality,” Food Research International, vol. 201, p. 115589, Feb. 2025, doi: 10.1016/J.FOODRES.2024.115589.
Sobre los autores
Erick Vindas-Reyes
Profesor de cursos de anatomía vegetal de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Ingeniero en Biotecnología con maestría en Ciencia y Tecnología para la Sostenibilidad, ambos del TEC. Trabaja en el desarrollo de sistemas de encapsulamiento de moléculas de interés biotecnológico para aplicaciones agrícolas y farmacológicas. ORCID: https://orcid.org/0000-0002-9949-0008.
Karla Meneses-Montero
Profesora de cursos de control de calidad y tratamiento de aguas residuales de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Ingeniera en Biotecnología del TEC con doctorado en Ciencias de la Universidad de Montpellier, Francia. Trabaja en biotecnología microbiana y enzimática desarrollando productos a base de microalgas. ORCID: https://orcid.org/0009-0008-4062-7728.
Luis Alvarado-Marchena
Profesor de cursos de anatomía vegetal de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Ingeniero en Biotecnología del TEC, máster en Biología Molecular de la Universidad de Costa Rica y tiene un Doctorado en Biotecnología de la Universidad Politécnica de Valencia, España. Trabaja en el estudio del efecto de virus en plantas y en el desarrollo de pruebas de detección bioquímicas y moleculares de fitopatógenos, así como en microscopía electrónica. ORCID: https://orcid.org/0000-0001-8670-3214.
Giovanni Garro-Monge
Profesor de cursos de ingeniería genética y biotecnología de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Licenciado en Biología y Máster en Ciencias de la Universidad de Costa Rica. Trabaja en biotecnología vegetal aplicando ingeniería genética, cultivo de tejidos y fitoquímica, esto para la obtención de material vegetal y la expresión de metabolitos de alto valor científico y comercial. ORCID: https://orcid.org/0000-0001-7578-1938.
Luis Barboza-Fallas
Profesor de cursos de bioinformática y de formulación de proyectos de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Ingeniero en Biotecnología y Máster en Gestión de Recursos Naturales y Tecnologías de Producción, ambos del TEC. Trabaja en proyectos de investigación en áreas como bioinformática, bacteriología, biología molecular, ingeniería genética y biología sintética, esto para el desarrollo y mejora de productos biotecnológicos. ORCID: https://orcid.org/0000-0003-1669-3764.
Randall Chacón-Cerdas
Profesor de cursos de fisiología vegetal y análisis estadístico de la Escuela de Biología del Tecnológico de Costa Rica (TEC). Ingeniero en Biotecnología y máster en Sistemas Modernos de Manufactura del TEC, doctor en ingeniería por parte de la UCR-TEC. Trabaja desarrollando micro y nanopartículas de uso en agricultura, producidas a través de la modificación de polímeros naturales, además en el proceso y análisis bioestadístico de datos. ORCID: https://orcid.org/0000-0002-5364-4649.